Наиболее химически активный из платиновых металлов 8
Обновлено: 17.05.2024
Металлы платиновой группы – это шесть благородных драгоценных химических элементов, которые расположены рядом в периодической таблице. Все они являются переходными металлами 8–10 групп 5–6 периода.
Металлы платиновой группы: список
Группа состоит из следующих шести химических элементов, расположенных в порядке возрастания атомного веса:
- Ru – рутений.
- Rh – родий.
- Pd – палладий.
- Os – осмий.
- Ir – иридий.
- Pt – платина.
Металлы платиновой группы обладают серебристо-белым оттенком, за исключением осмия, цвет которого голубовато-белый. Их химическое поведение парадоксально в том, что они обладают высокой устойчивостью к воздействию большинства реагентов, но используются в качестве катализаторов, легко ускоряющих или контролирующих скорость окисления, восстановления и реакций гидрирования.
Рутений и осмий кристаллизуются в гексагональную плотноупакованную систему, а другие обладают гранецентрированной кубической структурой. Это выражается в большей твердости рутения и осмия.
История открытия
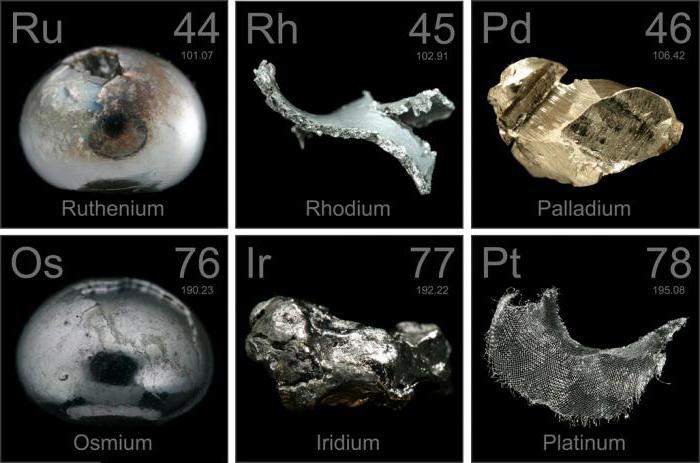
Хотя платиносодержащие золотые артефакты датированы 700 г. до н. э., присутствие этого металла является, скорее, случайностью, чем закономерностью. Иезуиты в XVI веке упоминали серые плотные камешки, связанные с аллювиальными месторождениями золота. Эти камешки нельзя было расплавить, но они образовывали сплав с золотом, при этом слитки становились ломкими, и их уже было невозможно очистить. Камешки стали называть platina del Pinto – гранулы серебристого материала из реки Пинто, впадающей реку Сан-Хуан в Колумбии.
Ковкая платина, которую можно получить только после полной очистки металла, была выделена французским физиком Шабано в 1789 году. Из нее был сделан кубок, преподнесенный папе Пию VI. Об открытии палладия в 1802 году сообщил английский химик Уильям Волластон, который назвал хим. элемент группы платиновых металлов в честь астероида. Волластон впоследствии заявлял об обнаружении еще одного вещества, присутствующего в платиновой руде. Его он назвал родием из-за розового цвета солей металла. Открытия иридия (по имени богини радуги Ириды из-за пестрой окраски его солей) и осмия (от греческого слова «запах» из-за хлорного запаха его летучего окисла) были сделаны английским химиком Смитсоном Теннантом в 1803 году. Французские ученые Ипполит-Виктор Колле-Дескоти, Антуан-Франсуа Фуркруа, и Николя-Луи Воклен выделили два металла одновременно. Рутений, последний изолированный и идентифицированный элемент, получил свое название по латинскому наименованию России от русского химика Карла Карловича Клауса в 1844 году.
В отличие от таких легко выделяемых в относительно чистом состоянии путем простого огневого рафинирования веществ, как золото, серебро, металлы платиновой группы требуют сложной водно-химической обработки. Эти методы не были доступны до конца 19 века, поэтому выявление и изоляция платиновой группы отстала от серебра и золота на тысячи лет. Кроме того, высокая температура плавления этих металлов ограничивала их применение, пока исследователи в Британии, Франции, Германии и России не разработали методы преобразования платины в форму, пригодную для обработки. Как драгоценные металлы платиновой группы начали использоваться в ювелирных изделиях с 1900 года. Хотя такое применение остается актуальным и сегодня, промышленное намного его превзошло. Палладий стал очень востребованным материалом для контактов в телефонных реле и других системах проводной коммуникации, обеспечивая длительный срок службы и высокую надежность, а платина, из-за своей устойчивости к искровой эрозии, во время Второй мировой войны стала применяться в свечах зажигания боевых самолетов.
После войны расширение методов молекулярной конверсии при переработке нефти создало огромный спрос на каталитические свойства, которыми обладают металлы платиновой группы. К 1970-м годам потребление выросло еще больше, когда стандарты автомобильных выбросов в США и других странах привело к использованию данных химических элементов в каталитической конверсии выхлопных газов.
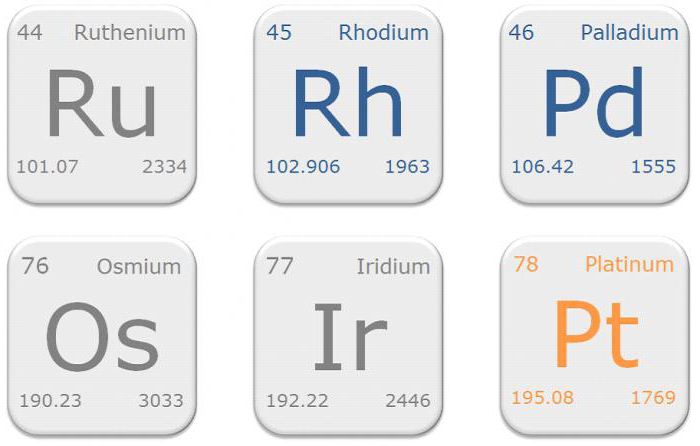
За исключением малых россыпных месторождений платины, палладия и осмистого иридия (сплава иридия и осмия), практически нет руды, в которой бы основным компонентом был химический элемент – металл платиновой группы. Минералы, как правило, содержатся в сульфидных рудах, в частности в пентландите (Ni, Fe)9S8. Наиболее распространены лаурит RuS2, ирарсит, (Ir,Ru,Rh,Pt)AsS, осмиридиум (Ir,Os), куперит, (PtS) и браггит (Pt,Pd)S.
Крупнейшее в мире месторождение металлов платиновой группы – Бушвельдский комплекс в ЮАР. Большие запасы сырья сосредоточены в месторождениях Садбери в Канаде и Норильско-Талнахском в Сибири. В США наибольшие залежи минералов платиновой группы расположены в Стилуотере, Монтана, но здесь они значительно меньше, чем в ЮАР и России. Крупнейшими в мире производителями платины являются Южная Африка, Россия, Зимбабве и Канада.

Добыча и обогащение
Основные южноафриканские и канадские месторождения эксплуатируются шахтным способом. Практически все металлы платиновой группы извлекаются из медных или никелевых сульфидных минералов с помощью флотационной сепарации. Плавка концентрата производит смесь, которая вымывается из меди и сульфидов никеля в автоклаве. Твердый остаток выщелачивания содержит от 15 до 20% металлов платиновой группы.
Иногда до флотации используется гравитационное разделение. В результате получается концентрат, содержащий до 50% платиновых металлов, что избавляет от необходимости выплавки.
Механические свойства
Металлы платиновой группы значительно отличаются механическими свойствами. Платина и палладий довольно мягкие и очень ковкие. С этими металлами и их сплавами можно работать как в горячем, так и в холодном состоянии. Родий сначала обрабатывают горячим, а позже его можно обрабатывать холодным с довольно частым отжигом. Иридий и рутений должны быть нагреты, холодной обработке они не поддаются.
Осмий – самый твердый из группы и имеет наиболее высокую температуру плавления, но его склонность к окислению накладывает свои ограничения. Иридий наиболее коррозионностойкий из платиновых металлов, а родий ценится за сохранение своих свойств при высоких температурах.

Структурные применения
Поскольку дочиста отожженная платина очень мягкая, она восприимчива к царапинам и порче. Для увеличения твердости ее сплавляют со множеством других элементов. Платиновые драгоценности очень популярны в Японии, где ее называется «хаккин» и «белое золото». Сплавы для ювелирных изделий содержат 90% Pt и 10% Pd, который легко обрабатывать и паять. Добавление рутения повышает твердость сплава, сохраняя стойкость к окислению. Сплавы платины, палладия и меди используются в кованых изделиях, так как они тверже платино-палладиевых и менее затратны.
Тигли, используемые для производства монокристаллов в полупроводниковой промышленности, требуют коррозионной устойчивости и стабильности при высоких температурах. Для этого применения лучше всего подходят платина, платина-родий и иридий. Платинородиевые сплавы используются в производстве термопар, которые предназначены для измерения повышенных температур до 1800 °C. Палладий применяют как в чистом, так и в смешанном виде в электрических устройствах (50% потребления), в стоматологических сплавах (30%). Родий, рутений и осмий редко используются в чистом виде – они служат легирующей добавкой для других металлов платиновой группы.

Катализаторы
Около 42% всей платины, произведенной на Западе, используется в качестве катализатора. Из них 90% применяется в автомобильных выхлопных системах, где тугоплавкие гранулы или сотовые конструкции с платиновым покрытием (а также палладиевым и родиевым) содействуют преобразованию несгоревших углеводородов, окиси углерода и окислов азота в воду, углекислый газ и азот.
Сплав платины и 10% родия в виде раскаленной докрасна металлической сетки служит катализатором в реакции между аммиаком и воздухом для получения окислов азота и азотной кислоты. При подаче вместе со смесью аммиака метана можно получить синильную кислоту. При переработке нефти платина на поверхности гранул оксида алюминия в реакторе является катализатором преобразования длинноцепочечных молекул нефти в разветвленные изопарафины, которые желательны в смеси высокооктановых бензинов.

Гальваника
Все металлы платиновой группы можно наносить гальванически. Из-за твердости и блеска получаемого покрытия наиболее часто применяется родий. Хотя его стоимость выше, чем платины, меньшая плотность позволяет использовать меньшую массу материала при сопоставимой толщине.
Палладий – металл платиновой группы, который проще всего использовать для нанесения покрытий. Благодаря этому прочность материала значительно повышается. Рутений нашел применение в инструментах, предназначенных для обработки трением при низком давлении.
Химические соединения
Органические комплексы металлов платиновой группы, такие как комплексы алкилплатины, используются в качестве катализаторов в процессе полимеризации олефинов, производстве полипропилена и полиэтилена, а также при окислении этилена в ацетальдегид.
Соли платины находят все более широкое применение в химиотерапии рака. Например, они входят в состав таких лекарств, как "Карбоплатин" и "Цисплатин". Покрытые оксидом рутения электроды используются в производстве хлора и хлората натрия. Сульфат и фосфат родия применяются в родиевых гальванических ваннах.
Металлы платиновой группы: обзор, список, свойства и применение
Основные свойства платиновых металлов

Платиновые металлы — элементы 5-го и 6-го переходных периодов периодической системы. Для них характерно заполнение 4d- и 5d-электронных орбиталей при наличии одного или двух s-электронов на более высоких (5s- и 6s-электронных) орбиталях.
Некоторые соединения рутения и осмия во многом напоминают соответствующие соединения железа — элемента той же группы 4-го периода. Родий по поведению в некоторых металлургических процессах сходен с кобальтом, палладий и платина — с никелем.
Сходство конфигураций внешних электронных оболочек в атомах платиновых металлов и близость эффективных атомных радиусов обусловливают близость химических свойств элементов. Наибольшие аналогии проявляются у элементов, стоящих в периодической системе друг под другом: у рутения и осмия, родия и иридия, палладия и платины.
У элементов же, стоящих рядом по горизонтали, проявляются заметные различия в свойствах. Вследствие сходства структур последнего электронного уровня наблюдается сходство свойств некоторых однотипных соединений элементов, расположенных по диагонали: рутения и иридия, родия и платины.
Будучи элементами переходных периодов, платиновые металлы ха-рактеризуются различными степенями окисления. Тенденции к присоединению электронов у них нет, они имеют только металлический характер. Максимально возможные, а также характерные степени окисления возрастают сверху вниз по вертикали (увеличивается расстояние внешних электронных оболочек от ядра) и убывают слева направо по горизонтали (d-орбитали постепенно заполняются электронами).
Осмий и рутений, которые имеют восемь внешних электронов, способны к проявлению максимальных степеней окисления VII и VIII (особенно с кислородом и оксигалогенидами). Степень окисления VI, характерная для рутения, осмия и лишь иногда для платины, иридия и родия, реализуется, главным образом, в кислородных соединениях.
Для рутения, осмия, платины и иридия наиболее характерна степень окисления IV, для родия — III, хотя степень окисления III довольно часто встречается в соединениях рутения и иридия. Низшие степени окисления (II, I) у родия, рутения, иридия, осмия встречаются реже. В основном они характерны для их соединений с органическими литандами. Степени окисления I и 0 у всех платиновых металлов реализуются весьма редко, главным образом, в карбонильных соединениях.
Благодаря высоким зарядам, небольшим ионным радиусам и наличию незаполненных d-орбиталей платиновые металлы представляю собой типичные комплексообразователи. Так, в растворах все их соединения, включая простые (галогениды, сульфаты, нитраты), превращаются в комплексные, поскольку в комплексообразовании участвуют ионы соединений, присутствующих в растворе, а также вода. Поэтому гидрометаллургия платиновых металлов основана на использовании их комплексных соединений.
Физические свойства платиновых металлов
Физические свойства металлов платиновой группы весьма сходны между собой . Это очень тугоплавкие и труднолетучие металлы светло-серого цвета разных оттенков. По плотности платиновые металлы разделяют на легкие (рутений, родий, палладий) и тяжелые (осмий, иридий, платина). Самые тяжелые металлы — осмий и иридий, самый легкий — палладий.
Платина, палладий, родий и иридий кристаллизуются в гранецентрированные кубические (г. ц. к.) решетки. Кристаллические решетки осмия и рутения — гексагональные с ротной упаковкой. При воздействии на растворы солей восстановителями платиновые металлы могут быть получены в виде «черни», обладающей высокой дисперсностью.
Температуры кипения и плавления металлов в обеих триадах убывают слева направо — от рутения к палладию и от осмия к платине, и снизу вверх по вертикали в периодической системе. Наиболее тугоплавкие осмий и рутений, самый легкоплавкий — палладий. Температуры кипения платиновых металлов очень высокие. Однако при прокаливании на воздухе рутений постепенно, а осмий быстро улетучиваются вследствие образования летучих тетраоксидов. Наблюдается также улетучивание платины (начиная с 1000 °С), иридия (с 2000 °С) и родия, объясняемое образованием летучих оксидов.
Осмий, рутений, иридий и родий очень тверды и хрупки. Наибольшей твердостью обладает осмий, однако и он может быть растерт в порошок. Родий поддается обработке почти так же трудно, как осмий, иридий—лишь при температуре красного каления. Платина в горячем состоянии хорошо прокатывается и сваривается. Особенно легко механически обрабатывается мягкий и пластичный палладий. Наибольшей тепло- и электропроводностью обладают родий и иридий.
Характерным свойством платиновых металлов является способность абсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к абсорбции значительно возрастает у металлов, находящихся в тонкодисперсном и коллоидном состояниях.
Наибольшая способность к абсорбции водорода присуща палладию: 1 объем палладия при комнатной температуре может поглотить до 900 объемов водорода. При поглощении определенного объема водорода кристаллическая решетка палладия расширяется, так как образуются твердые растворы водорода в металле. Абсорбционная способность по отношению к водороду убывает в ряду: Pd>Ir>Rh>Pt>Ru>Os. Абсорбированный водород может быть удален при нагревании металлов до 100 °С в вакууме. Легче всего он удаляется из палладия, труднее-из платины и, особенно, иридия.
Платина (особенно платиновая чернь) довольно сильно» поглощает кислород: 100 объемов кислорода на один объем платиновой черни. Палладий и другие платиновые металлы поглощают кислород значительно меньше.
Вследствие способности к абсорбции газов платиновые металлы, главным образом, палладий, платина и рутений, применяют в качестве катализаторов при реакциях гидрогенизации и окисления. Каталитическая активность их увеличивается при использовании черни. Осмий также обладает высокой каталитической активностью, но осмиевые катализаторы легко отравляются.
Химические свойства платиновых металлов
Для платиновых металлов характерна высокая стойкость по отношению к химическим реагентам, которая для разных платиновых металлов проявляется по-разному. Более того, стойкость этих металлов в большой степени зависит от степени их дисперсности. Если компактные платиновые металлы весьма стойки к различным реагентам, даже при повышенной температуре то дисперсные формы металлов активно взаимодействуют с различными окислителями, особенно» при повышенной температуре.
Платина
При обычной температуре платина не взаимодействует с минеральными и органическими кислотами Серная кислота при нагреве медленно растворяет платину Полностью платина растворяется в царской водке:
При повышенных температурах платина взаимодействует с едкими щелочами, фосфором и углеродом.
С кислородом платина образует оксиды (II), (III) и (IV): РtO, Pt2O3 и РtO2. Оксид РtO получается при нагревании порошка платины до 430 °С в атмосфере кислорода при давлении 0,8 МПа. Оксид Pt2O3 можно получить при окислении порошка металлической платины расплавленным пероксидом натрия. Оксид РtO2 — порошок черного цвета— получается при кипячении гидроксида платины (II) со щелочью:
Гидроксид платины (IV) можно получить осторожным приливанием щелочи к раствору хлороплатината калия:
Сернистое соединение PtS — порошок коричневого цвета, не растворимый в кислотах и царской водке; PtS2— черный осадок, получаемый из растворов действием сероводорода, растворимый в царской водке.
Хлориды платины часто используют в гидрометаллургии и аналитической практике. При 360°С воздействием хлора на платину можно получить тетрахлорид PtCl4, который при температуре выше 370 °С переходит в трихлорид PtCl3, а при 435 °С распадается на хлор и дихлорид PtCl2, разлагающийся при 582 °С на хлор и металлическую платину; PtCl2 растворяется в слабой соляной кислоте с образованием платинисто-хлористоводородной кислоты H2[PtCl4], при действии на которую солей металлов получаются хлороплатиниты Me2[PtCl4] (где Me—К, Na, NH4 и т.д.).
Тетрахлорид платины PtCl4 при воздействии соляной кислоты образует платинохлористоводородную кислоту H2[PtCl6]. Соли ее — хлороплатинаты Me2[PtCl6]. Практический интерес представляет хлороплатинат аммония (NH4)2 [PtCl]6 — кристаллы желтого цвета, малорастворимые в воде, спирте и концентрированных растворах хлористого аммония. Поэтому при аффинаже платину отделяют от других платиновых металлов, осаждая в виде (NH4)2[PtCl6].
В водных растворах сульфаты легко гидролизуются, продукты гидролиза в значительном интервале рН находятся в коллоидном состоянии. В присутствии хлорид-ионов сульфаты платины переходят в хлороплатинаты.
Палладий
Палладий химически менее стоек, чем платина. Он растворяется в горячей серной и концентрированной азотной кислотах:
С кислородом палладий образует оксид PdO, который при повышении температуры диссоциирует по уравнению
При температурах выше 870 °С палладий полностью восстанавливается. Диоксид PdO2 темно-красного цвета, сильный окислитель, медленно теряющий кислород уже при комнатной температуре. При 200 °С PdO2 разлагается на PdO и кислород; PdO2 образуется при обработке Me2[PdCl6] щелочами.
Из соединений палладия с серой известны PdS и PdS2. С селеном и теллуром палладий образует соединения PdSe, PdSe2, PdTe и PdTe2.
Дихлорид палладия PdCl2 получается из элементов при. температуре темно-красного каления. При растворении палладия в царской водке образуется тетрахлорид палладия, образующий с соляной кислотой палладохлористоводородную кислоту H2[PdCl6], которая при кипячении переходит в палладистохлористоводородную кислоту:
Соли этих кислот — хлоропалладаты Me2[PdCl6] и хлоропалладиты Me2[PdCl4].
Сульфат палладия PdSO4•2H2O, получаемый растворением палладия в серной кислоте, подвергается гидролизу с образованием Pd(OH)2. В присутствии соляной кислоты он переходит в H2[PdCl4]. Известен нитрат палладия Pd(NO3)2. Аммиачные соединения характерны для двухвалентного палладия. При добавлении избытка аммиака к раствору хлоропалладита получается тетраминхлорид:
(NH4)2[PdCl4] + 4NH3 ⇄ [Pd(NH3)4]Cl2 + 2NH4Cl
Если к этому раствору добавить хлоропалладита, то выпадает красный осадок соли Вокелена:
[Pd(NH3)4]Cl2 + (NH4)2[PdCl4] ⇄ [Pd(NH3)4] [PdCl4] + 2NH4Cl
При осторожном добавлении соляной кислоты к раствору тетраминхлорида выпадает светло-желтый мелкокристаллический осадок хлоропалладозамина:
[Pd(NH3)4]Cl2 + 2HCl ⇄ [Pd(NH3)2Cl2] + 2NH4Cl
Соль мало растворяется в воде, что используют при отделении палладия от других платиновых металлов.
При прокаливании хлоропалладозамины разлагаются:
3[Pd(NH3)2Cl2] ⇄ 3Pd + 2НСl + 4NH4Cl + N2
Иридий
Иридий не взаимодействует с кислотами, щелочами, даже царская водка не растворяет компактный иридий. Обычно порошок иридия растворяют спеканием с пероксидом бария или натрия с последующей обработкой спека соляной кислотой или смесью соляной и азотной кислот.
Из кислородных соединений иридия наиболее известны оксиды Ir2O3 и IrO2. Оксид иридия (IV) —сине-черный порошок с металлическим блеском, растворимый в кислотах,получается из гидроксида Ir(OH)4 нагреванием до 350 °С.
Оксид иридия (III) — порошок черного цвета, не растворимый в соляной кислоте и царской водке. Гидроксиды ири-дия получают из солей иридия (III) и (IV) осаждением щелочами при нагревании. При пропускании сероводорода через раствор солей иридия при 100 °С и выше выпадает осадок тиоиридатной кислоты H3lrS3(Ir2S3•3H2S).
При воздействии на иридий хлора в зависимости от температуры получаются хлориды IrCl, IrСl2, IrCl3. Хлорирование в водных растворах позволяет выделять хлороиридаты Н2[IrСl6], которые легко восстанавливаются до хлороиридитов Н3[IrCl6]. Эти соединения в водных растворах легко гидролизуются и переходят в аквогидроксохлорокомплексы, которые с большим трудом выделяются из растворов.
Из солей иридийхлористоводородной кислоты большое значение при аффинаже имеет хлороиридат аммония, используемый для отделения иридия от других платиновых металлов.
Желтый сульфат иридия (III) состава Ir2(SО4)3• хH2О получают растворением гидроксида иридия (III) в серной кислоте без доступа воздуха. В водных растворах сульфаты иридия находятся в виде сложных аквогидроксосульфат-ных комплексов, причем состав их значительно меняется в зависимости от способа получения, поэтому определение форм нахождения иридия в сульфатных растворах — чрезвычайно сложная задача.
Обычно наиболее устойчивы многоядерные сульфаты иридия с разным соотношением атомов иридия, находящихся в различной степени окисления (III, IV). Изучение сульфатов иридия необходимо для построения рациональной технологии извлечения этого металла из технологических растворов первичного обогащения шламов.
Родий
Так же, как иридий, родий — малоактивный металл и в компактном виде не растворяется в царской водке. С кислородом он образует соединения Rh2О3 и RhО2. При пропускании сероводорода через раствор родиевых солей образуется сернистый родий Rh2S3, который при нагревании в токе кислорода или воздуха разлагается с образованием металлического родия.
Хлорид родия RhCl3 при растворении в соляной кислоте образует родиевохлористоводородную кислоту H3[RhCl6]. Однако ион [RhCl6]³⁻ подвергается акватации уже при концентрации хлор-иона, меньшей 6 М:
[RhCl6]³⁻+ H2O ⇄ [Rh(H2O)Cl5]²⁻ + Сl⁻
При pH>2,9 начинается процесс гидролиза родиевых комплексов:
[RhCl6]³⁻ + nH2O ⇄ [Rh(H2O)n-1 (OH)Cl6-n]³⁻ + nСl⁻ + H⁺.
Поэтому в водных растворах трихлорид родия может существовать в виде катионных, анионных и нейтральных аквогидроксохлорокомплексов. Такое многообразие форм затрудняет выделение этого металла из раствора обычными гидрометаллургическими методами.
Аналогично ведут себя соли родиевой кислоты — хлорородиаты (Na3[RhCl6], K3[RhCl6] и т. д.). При обработке хлорородиата аммония нитритом натрия образуется Na3[Rh (NO2)6]. Добавка хлористого аммония к раствору этой соли вызывает выпадение практически нерастворимого аммоний натриевого гексанитрита родия:
Na3[Rh(NO2)6] + 2NH4Cl ⇄(NH4)2Na[Rh(NO2)6] + 2NaCl.
При взаимодействии Na3[Rh (NO2)6] с NH4OH образуется триаминнитрит родия:
Na3[Rh(NO2)6] + 3NH4OH ⇄ 2[Rh(NH3)3](NO2)3 + 3NaNO2 + 3H2O,
который, взаимодействуя с соляной кислотой, дает малорастворимый триаминхлорид родия:
2[Rh(NH3)3](NO2)3 + 6HCl ⇄ 2[Rh(NH3)3Cl3] + 3H2O + 3NO2 + 3NO
Прокаливание триаминхлорида позволяет получить порошок металлического родия. Все приведенные выше реакции используют на аффинажных предприятиях.
Сульфаты родия в водных растворах, как и хлориды, акватируются и гидролизуются, поэтому в сульфатных растворах родий, так же как иридий, находится в виде катионов, анионов и нейтральных акво- и гидроксосульфатных комплексов.
Рутений
В отсутствие кислорода воздуха на рутений не действует даже царская водка. Однако содержащая кислopод соляная кислота медленно растворяет рутений. Порошкообразный рутений полностью переходит в RuО2 при прокаливании в струе кислорода. При температуре выше 600°С образуется летучий тетраоксид рутения RuО4— сильный окислитель.
Дисульфид рутения RuS2 может быть получен осаждением сероводородом из рутениевых солей или непосредственным взаимодействием элементов. Выше 1000 °С начинается распад этого соединения на металл и серу. Селенид и теллурид рутения RuSe2 и RuTe2 очень похожи на сульфид, но менее устойчивы. Трихлорид рутения RuCl3 образуется при действии хлора на Ru(OH)3, дихлорид RuCl2 — при взаимодействии хлора с металлическим рутением. Тетрахлорид рутения RuCl4 — непрочное соединение, разлагается, отщепляя хлор.
Комплексные хлориды рутения — Me2[RuCl6], Me4[Ru2OCl10] и Me2[Ru(H2O)Cl5]—образуются при поглощении тетраоксида рутения соляной кислотой. Однако в зависимости от концентрации соляной кислоты и времени ее взаимодействия с RuO4 могут образоваться самые различные промежуточные соединения.
Комплексные анионы рутения легко гидролизуются и акватируются с образованием различных аквагидроксохлорокомплексов. Трехвалентный рутений в водных растворах образует также легко акватируемый и гидролизуемый комплекс [Ru(H2O)Cl5]2-. Поэтому в реальных хлоридных растворах рутений может находиться в виде нейтральных, положительно и отрицательно заряженных аквагидроксохлорокомплексов.
Те же самые процессы акватации и гидратации протекают в сульфатных растворах, содержащих рутений. Обычно в сульфатных растворах присутствуют многоядерные полимеризованные аквагидроксокомплексы рутения (III) и (IV). При этом в растворе находятся одновременно катион-ные, анионные и нейтральные комплексы этого металла. Поэтому выделение рутения из подобных растворов чрезвычайно затруднено.
Осмий
Порошок осмия легко окисляется кислородом до тетраоксида OsO4, который восстанавливается различными органическими восстановителями до диоксида OsO2.
Дисульфид осмия OsS2 может быть получен аналогично RuS2. Для осмия, как и для рутения, характерно образование OsSe2 и OsTe2.
Тетрахлорид осмия OsCl4 получается при хлорировании осмия. Одновременно может быть получен трихлорид OsCl3.
При сплавлении металлического осмия со смесью щелочи и пероксида натрия (или бария) получается осмиат натрия, который при растворении в соляной кислоте образует комплексный хлорид осмия:
Na2[OsO4] + 8HCl ⇄ Na2[OsCl6] + Cl2 + 4Н2O
Это соединение можно восстановить соляной кислотой до Na3[OsCl6]. Свойства водных растворов комплексных хлоридов осмия напоминают свойства рутениевых комплексов.
В аффинажных операциях большое значение имеет соль Фреми [OsO2(NH3)4]Cl2, которую получают по реакции:
При прокаливании этой соли получается металлический осмий.
Статья на тему общие свойства платиновых металлов
Похожие страницы:
Агломерация платиновых металлов В процессе агломерации сульфидный концентрат подвергается окускованию и частичной десульфурации при 1000—1100°С, что сопровождается процессами разложения высших.
Аффинаж платиновых металлов Концентраты платиновых металлов, полученные непосредственно из коренных руд или после переработки анодных шламов, и шлиховую платину из.
Палладий (Palladium) Aт. вес 106,4. Иридий (Iridium); ат. вес 192,2. Палладий — серебристо-белый металл уд. веса, 11,9, плавящийся при 1552°.
Платина обогащение Формы нахождения платиновых металлов в рудах определяют их поведение в последующих процессах обогащения. Поэтому их изучение имеет большое.
ПЕРЕРАБОТКА КОНЦЕНТРАТОВ ПЛАТИНЫ Для перевода благородных металлов в раствор издавна пользуются смесью соляной и азотной кислот — царской водкой, известной.
Что такое платина самородная Это Pt — минерал класса самородных металлов. К группе платине самородной относятся минералы, представляющие собой природные.
ПАЛЛАДИЙ
(Palladium; от назв. астероида Паллады), Pd — хим. элемент VIII группы периодической системы элементов; ат. н. 46, ат. м. 106,4; относится к металлам группы платины. В соединениях проявляет степени окисления +2, +3 (редко) и +4, наиболее характерна +2. Серебристо-белый, мягкий металл, в порошке — серого цвета. Природный палладий состоит из изотопов с массовыми числами 102 (0,96%), 104 (10,97%), 105 (22,23%), 106 (27,33%), 108 (26,71%) и 110 (11,81%). Получены радиоактивные изотопы с массовыми числами от 98 до 115, из них долго-живущий — изотоп 107Pd с периодом полураспада 7 • 10 6 лет. Изотопы П. образуются при делении урана и плутония в ядерных реакторах. П. открыл в 1803 англ. химик У.-Х. Вол-ластон при исследовании платины самородной.
П.— редкий элемент, содержание его в земной коре 1 • 10-6%. Как и платина, встречается в самородном состоянии, по крайне редко. Известно около 30 минералов, в состав к-рых входит от 70 до 0,3% Pd; бреггит (Pt, Pd, Ni) S, палладистая платина (Pt, Pd), аллопалладий, палладит PdO, стибиопалладинит Pd3Sb и др. Кристаллическая решетка палладия гранецентрированная кубическа типа меди, с периодом а =3,8902 А (т-ра 23° С). Плотностъ (т-ра 20° С) 12,02 г/см3; tпл 1552° С; tкип 2937 ±30° С; удельная теплоемкость (температура 25° С) 0,0584 кал/г град; коэфф. теплопроводности (т-ра 20°С) 0,170 кал/см х сек х град; температурный коэфф. линейного расширения (в интервале т-р 0—100 С) 11,1 х 10-6 град-1 , удельное электрическое сопротивление (т-ра 25° С) 9,96 мком х см; температурный коэфф. электр. сопротивления (в интервале т-р 0—100° С) 0,00379 град1 . П. парамагнитен.
Его удельная магнитная восприимчивость при комнатной т-ре 5,231 • 10—6. Давление насыщенного пара П. при т-рах 1200 и 1500° С соответственно 10-4 и 10-2 ммрт. ст. У отожженного П. модуль норм, упругости 12 360 кгс/мм2; модуль сдвига 5100 кгс/мм2; предел прочности на растяжение 18,5 — 20 кгс/мм2; относительное удлинение 25—40%; HV = 37 — 50 (различие величин объясняется чистотой и состоянием исследованного металла). П. легко поддается ковке, штампованию, прокатке в тончайшие листы, протяжке в тонкую проволоку, его можно отлично полировать и сваривать. Холодное деформирование заметно упрочняет его. Так, предел прочности на растяжение после холодной протяжки с обжатием до 50% увеличивается до 33 кгс/мм2, твердость возрастает в 2—2,5 раза.
При последующем отжиге металл опять становится более мягким. Легирующие элементы, особенно рутений и никель, также повышают твердость палладия. Из металлов группы платины П.— наиболее химически активный. При комнатной т-ре на воздухе не окисляется и не тускнеет, при нагревании до т-ры 600—700° С на его поверхности образуется плотная окисная пленка. В процессе нагревания порошкообразного П. в токе кислорода образуется окись PdO, к-рая при болей высокой т-ре (> 870° С) вновь разлагается на элементы. При нагревании взаимодействует с галогенами (влажный хлор и жидкий бром разъедают П. и при комнатной т-ре), серой, селеном, фосфором, мышьяком и кремнием. С большинством металлов образует сплавы. Растворяется в азотной и горячей серной кислотах, «царской водке», расплавленном бисульфате калия KHS04, может быть переведен в раствор анодным растворением в соляной к-те. Плавиковая и уксусная к-ты, растворы щелочей на него не действуют. При сплавлении с перекисью натрия Na202 окисляется до PdO. Как и все металлы группы платины, образует многочисленные комплексные соединения.
Характерное св-во палладия способность поглощать водород (до 900 объемов на 1 объем металла), после чего он заметно увеличивается в в объеме, становится хрупким. При умеренном нагревании в вакууме поглощенный водород снова выделяется. Водород и дейтерий способны легко диффундировать через нагретый листовой П. (при т-ре от 400 до 600° С он проницаем только для водорода). В мелкораздробленном состоянии Палладий обладает высокой каталитической активностью. Сырьем для получения П. служат концентраты платиновых металлов, получаемые непосредственно из руд и гл. обр. после переработки анодных шламов электролиза никеля. При обработке концентратов «царской водкой» П. переходит в раствор. После «доводки» раствора и осаждения из него платины и иридия Палладий осаждают в виде комплексной соли [Pd (NH3)2Cl2]. Осадок очищают переосаждением из аммиачного раствора соляной к-той и прокаливают при температуре 800— 900° С. Полученный губчатый Палладий восстанавливают в среде водорода, получая палладиевый порошок чистотой 99,8—99,9%.
Поставляют П. в виде порошка, прутков, жести, фольги и проволоки. Для приготовления сплавов П. используют в основном индукционные или дуговые печи. Плавку и термическую обработку ведут в вакууме или в среде аргона либо гелия. Изделия из П. чаще всего вырабатывают штампованием и холодной прокаткой. Чистый П. применяют в произ-ве электр. контактов, в качестве фильтров при получении сверхчистого водорода, для нанесения декоративных и защитных покрытий и др. В виде сплавов с платиной и др. пла-тиновыми металлами, медью, серебром, золотом и никелем П. применяют как катализатор (напр., при получении аммиака); в электро-и радиотехнической пром-сти, точном приборостроении (различного вида резисторы, электр. контакты); в произ-ве жаропрочных твердых припоев; для изготовления трубок, стеклоплавильных сосудов и фильер в произ-ве искусственного волокна, лабораторных изделий, медицинских игл, шприцев и наконечников, в зубопротезной технике и ювелирном деле. Вследствие относительно низкой стоимости палладием все чаще заменяют платину, родий и иридий.
Палладий — простое вещество , обозначается символом Pd , в нормальных условиях пластичный серебристо — белый металл . В таблице Д.И. Менделеева значится как элемент побочной подгруппы пятого периода .
Палладий хоть и пластичен но микродобавки некоторых металлов таких как кобальт, родий , рутений и никель повышают его механические свойства повышая твёрдость .
Температура плавления палладия 1554 °C , а температура кипения 2940 °C , теплопроводность 0, 161 кал/(см.сек.град ) и обладает твёрдость по Бринеллю 52 кгс/мм2.
Применение палладия
Основное применение большого количества металла нашло в химической промышленности как катализатор . Из за более дешевой стоимости и по характеристикам таких как у золота и платины его используют в процессе крекинга нефти ( разложение более высоких углеводородов на более низкие , используется для получения бензина , солярки и керосин , а керосин используется опять для получения бензина или получения чистого керосина для использования в авиа промышленности ) .
Хлорид палладия нашёл применение как катализатор по обнаружению угарного газа , что нашло применение как в угольной промышленности так и в химической промышленности .
Применение палладия в радиопромышленности
Благодаря своим свойствам которые выражаются в стойкости к окружающей среде , его также широко используют для изготовления радиодеталей таких как конденсаторов и микросхем . Помимо палладия в таких деталях также используют золото , платину и серебро .
Использование палладия для очистки водорода
Для получения чистого водорода , который используется в качестве получения других более важных водород содержащих соединений таких как перекись водорода который в свою очередь используется как дезинфицирующее и рано очищающее средство в медицине . Также водород используется в получении некоторых жиров в химической промышленности .
Применение палладия в медицине
Как более дешевый по стоимости металл его используют в медицине для изготовления нержавеющих инструментов , а также в производстве кардиостимуляторов , стоматологии в некоторых странах используют для изготовления коронок , мостов и пломб .
Палладий как и другие благородные металлы ( золото , платина , серебро ) используется в производстве ювелирных украшений , причём как чистый металл ( в производстве медалей ) так и в сплаве с другими металломи таких как золото , платина , серебро . Но в основном его добавляют в серебро , тем самым повышая его изящество и красоту изделия .
Для изготовления химической аппаратуры и деталей , деталей насосов для перекачки некоторых кислот которые реагируют с другими благородными металоми .
Содержание статьи1 Палладий свойства1.1 Свойства палладия1.2 Палладий 9 фактов Палладий свойства О легчайшем из платиноидов и о «черни», ускоряющей прогресс. Серебристо-белый.
Палладий история открытия Известный в Лондоне торговец минералами мистер Форстер не высказал особого удивления, когда в один из слякотных осенних.
Содержание статьи1 ПАЛЛАДИЙ анализ Pd, Качественная реакция на Палладий1.1 Диметилдиоксим1.2 Диэтилдитиокарбаминат натрия (ДДКNa)1.3 n-Нитрозодифениламин1.4 Нитроксаминазо1.5 Сульфонитрофенол М1.6 α, α’-Фурилдиоксим1.7 β-Фурфуральдоксим ПАЛЛАДИЙ.
Родий история открытия элемента Элемент № 45 Родий открыт в Англии в 1803 г. замечательным ученым своего времени Уильямом Гайдом.
Аффинаж платиновых металлов
Концентраты платиновых металлов, полученные непосредственно из коренных руд или после переработки анодных шламов, и шлиховую платину из россыпных руд передают на аффинажные заводы для получения чистых платиноидов.
Сырьем для получения платиновых металлов служат: шлиховая платина, извлекаемая при разработке и обогащении россыпей, концентраты, выделяемые в результате обогащения и гидрометаллургической обработки анодных шламов электролиза никеля и меди, лом вторичных платиновых металлов и другие отходы.
Шлиховая платина — это смесь зерен самородной платины, представляющая собой сплав платиновых металлов с железом, медью, никелем и другими элементами. Для шлиховой платины характерен следующий состав, %: да 85—90 Pt; 1—3 Ir; < 1 Rh и Ru; до 15 Fe.
При общем достаточно высоком содержании платиновых металлов (>50 %) они характеризуются повышенным количеством палладия и значительным количеством меди, никеля, железа, серы, селена и теллура.
Переработка шлиховой платины
Шлиховую платину вследствие высокого содержания в ней платины и относительно малого количества загрязняющих элементов — серы и цветных металлов — перерабатывают по относительно простой схеме. Главнейшими операциями являются растворение, доводка растворов и избирательное осаждение отдельных платиновых металлов.
Первый этап переработки шлиховой платины — ее растворение в царской водке, которую готовят смешением соляной кислоты (плотность 1,12) и азотной (плотность 1,58) в объемном отношении 3:1. Вследствие высокой плотности шлиховой платины и быстрого оседания ее на дно реактора растворение осуществляют в чане с набором тарелок или при интенсивном перемешивании с помощью механических мешалок.
Вначале шлихи растворяют без подогрева, так как в первое время реакция растворения протекает весьма энергично, а затем (через 4—5 ч) подогревают до ПО—120°СГ что ускоряет процесс растворения, который заканчивается примерно через сутки. Растворение платины происходит в царской водке .
Растворение других платиновых металлов и примесей, содержащихся в шлиховой платине, протекает с образованием H2[PdCl6], H3[RhCl6], H2[IrCl6], H2[Ru(H2О)Cl5], H[AuCl4], FeCl3, CuCl2. В раствор переходит свыше 99 % платины и палладия, около половины иридия и значительная часть родия, а также основная масса цветных металлов. Осмий в этих условиях не образует химических соединений с хлором и переходит в оксид OsO4. Количество и растворимого остатка обычно находится в пределах 4—6 % поступающей на растворение массы шлиховой платины. В этом остатке содержится до 30 % Ir, 12 % Os, 10 % Pt, 3 % Rh, небольшие количества палладия и рутения.
Для последующего избирательного осаждения платины в виде нерастворимого хлороплатината аммония (NH4)2[PtCl6] необходимо предварительно перевести ири дий (IV) и палладий (IV) соответственно в иридий (III) и палладий (II), иначе при осаждении платины хлористым аммонием иридий (IV) и палладий (IV) также выпадут в осадок в виде труднорастворимых соединений (NH4) 2 [PdCl6] и (NH4)2[IrCl6], загрязняющих платиновый осадок.
Избирательное восстановление иридия и палладия можно осуществить различными методами. Обычно иридий восстанавливают сахаром, который одновременно восстанавливает и золото. Однако предварительно необходимо разрушить азотную кислоту. Поэтому операцию начинают с разрушения азотной кислоты спиртом при 100—105°С. Спирт полностью разрушает азотную кислоту и частично восстанавливает иридий до трехвалентного, а золото до металлического:
Читайте также:
