Наиболее плотноупакованная кристаллическая решетка металла
Обновлено: 02.07.2024
Как отмечалось в предыдущем параграфе, атомы в кристаллическом твердом теле располагаются в пространстве закономерно, периодически повторяясь в трех измерениях через строго определенные расстояния, т. е. образуют кристаллическую решетку. Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором — сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т. е. известна его атомно-кристаллическая структура.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки и три угла между ними (см. рис. 6). Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки (рис. 8). Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решеток. В простой решетке атомы располагаются только по вершинам решетки, в объемноцентрированной еще один атом в центре решетки, в гранецентрированной еще по одному атому в центре каждой грани, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
Узлы (положения атомов), направления в плоскости и пространстве обозначаются с помощью так называемых индексов Миллера (рис. 9). Положение любого узла кристаллической решетки относительно произвольно выбранного начала координат определяют заданием координат Для одной элементарной ячейки очевидно эти координаты равны параметрам решетки с соответственно.
(кликните для просмотра скана)
Для удаленной от начала координат ячейки координаты узла определяются как где целые числа. Если за единицу измерения длин вдоль осей решетки выбрать величины , то координаты узла будут просто числа Они называются индексами узла и записываются Например для узла с координатами х индексы равны Для отрицательных индексов узла (отрицательные значения над индексом ставится знак минус. Индексы направления определяются индексами первого узла, через который проходит прямая, проведенная от начала координат, поэтому индексы направления, обозначаемые как численно равны индексам узла Положение плоскости определяется отрезками , которые она отсекает на осях решетки. Далее определяются величины, обратные им и полученные дроби приводят к общему знаменателю, например к числу Тогда индексы плоскости определяются как и записываются в виде Например, при
Если плоскость не пересекает какую-нибудь ось (например ), то соответствующий индекс Миллера равен нулю [например (110)]. Для описания кристаллов с гексагональной решеткой пользуются четырехосной системой координат (в основании призмы лежат три оси координат под углом 120°, а четвертая ось перпендикулярна им). В этом случае плоскость обозначается , где
Рис. 9. Символы некоторых важнейших узлов, направлений и плоскостей в кубической решетке
Непараллельные плоскоти, имеющие одинаковое атомное строение, кристаллографически эквивалентны. Совокупность таких плоскостей заключается в фигурные скобки. Например плоскости (100), (010), (001), (100), (010) и (001) можно обозначить индексами одной плоскости: или (010) и т. д. Совершенно аналогично совокупность непараллельных кристаллографически эквивалентных направлений, например [100], [010], [001] и т. д. можно обозначить индексами одного из них, заключив для этого их ломаные скобки: (100) и т. д.
Наиболее распространенными среди металлов являются гексагональная плотноупакованная решетка , гранецентрированная кубическая (г. ц. к.) , объем ноцентрированная кубическая (табл. 6). Ряд металлов (например, в зависимости от температуры и давления может существовать в состояниях с различными кристаллическими решетками — это явление называется полиморфизмом.
Реализация в металлах отмеченных структур является следствием их высокой компактности, т. е. отношение объема, занимаемого атомами в элементарной ячейке к объему ячейки. Компактность структуры является одним из факторов, уменьшающим свободную энергию твердого тела, т. е. обеспечивающим его равновесное состояние и следствием особенностей электронной структуры металлов и характером их межатомного взаимодействия.
Таблица 6. (см. скан) Кристаллические решетки металлических элементов
Таблица 7. (см. скан) Характеристика кристаллов
Приведем (табл. 7) наиболее важные характеристики кристаллов с кубической решеткой. За координационное число принято число ближайших соседей данного атома.
Точечное расположение атомов в кристаллических решетках, приведенных на рис. 6 и 8, является условным, так как в действительности атомы имеют определенный размер и могут соприкасаться друг с другом (рис. 10).
Рис. 10. (см. скан) Кристаллические решетки (слева изображение в виде плотно-упакованных шаров атомов): а — объемиоцеитрированиая кубическая (о. ц. к.); б — гранецентрированная кубическая (г. ц. к.); в — гексагональная плотноупакованная г. п. у.)
Для характеристики величины атома служит атомный радиус (табл. 8), под которым понимается половина расстояния между ближайшими соседними атомами. Параметры
Таблица 8. (см. скан) Атомные радиусы металлических элементов в нанометрах (по Г. Б. Бокию) (для координационною числа 12)
элементарной ячейки и атомные радиусы измеряются в ангстремах или в нанометрах . Параметры решетки металлов (их также называют периодами решетки) находятся в пределах 0,2-0,7 нм и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Лекция 3. Атомно – кристаллическое строение металлов и сплавов
Атомно – кристаллическое строение металлов и сплавов. Основные типы кристаллических решеток: объемно - центрированная кубическая, гранецентрированная кубическая, гексагональная плотноупакованная, тетрагональная решетки. Параметры кристаллических решеток. Кристаллографические плоскости и направления. Определение индексов кристаллографических плоскостей и направлений. Реальное строение металлов. Классификация дефектов кристаллического строения. Их краткая характеристика.
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии F (F = U — TS, где U — внутренняя энергия; Т —температура; S — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 10 5 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится.
Т.о. можно отметить, что в газообразном состоянии атомы расположены хаотически, в жидком состоянии имеют близкий порядок в расположении атомов, а в кристаллическом состоянии имеется и ближний и дальний порядок в расположении атомов.
Правильное, закономерное расположение частиц в пространстве и характеризует кристаллическое состояние. Кристаллическое состояние можно представить в виде плоской решетки, в узлах которой расположены атомы (рисунок 11) Такое изображение решетки называется кристаллографической плоскостью.
Это обуславливает то, что в кристалле каждый атом имеет одно и тоже ближайшее количество атомов – соседей, расположенных на Одинаковом расстоянии.
Кристаллическая решетка – это неоднократное повторение кристаллографической плоскости во всех направлениях.
Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором — сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т.е. известна его атомно-кристаллическая структура.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки а, Ь, с и три угла между ними. Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки (рис. 12). Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решеток. В простой решетке атомы располагаются только по вершинам решетки, в объемноцентри-рованной еще один атом в центре решетки, в гранецентрированной еще по одному атому в центре каждой грани, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
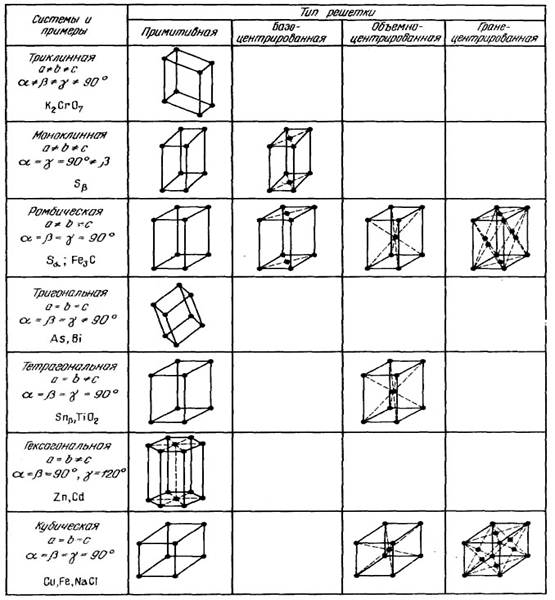
Рисунок 12 – Основные типы кристаллических решеток и их характеристики
Наиболее распространенными среди металлов являются гексагональная плотноупакованная решетка (ГПУ) –Mg, Zn, Co, Ti; гранецентрированная кубическая решетка (ГЦК) – Fe, Ni, Cu, Al, Pb, Ag, Au; объемно-центрированная кубическая решетка (ОЦК) – Fe, Cr, W, V, Mo (рисунок 13).
Компактность структуры является одним из факторов, уменьшающим свободную энергию твердого тела, т. е. обеспечивающим его равновесное состояние и следствием особенностей электронной структуры металлов и характером их межатомного взаимодействия. Поэтому основной характеристикой кристаллической решетки является координационное число. За координационное число принято число ближайших соседей данного атома, находящихся от него на одинаково близком расстоянии.
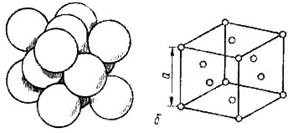
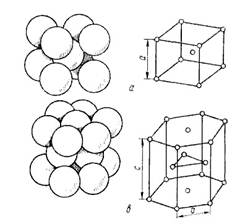
Рисунок 13- Основные виды кристаллических решеток и расположение в них атомов.
Точечное расположение атомов в кристаллических решетках, приведенных на рисунке 3, является условным, так как в действительности атомы имеют определенный размер и могут соприкасаться друг с другом. Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Параметры элементарной ячейки а, Ь, с и атомные радиусы измеряются в ангстремах (1Å – 10 -8 см). Параметры решетки металлов (их также называют периодами решетки) находятся в пределах 0,2—6,7 Å и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Типы кристаллических решеток, особенности строения реальных металлических материалов
В большинстве случаев техника использует кристаллические материалы. Субструктура материала - кристаллическое строение наряду с химическим составом определяет все свойства. В реальных металлах кристаллы выпадают из расплавов при охлаждении и создаются физико-химическими процессами при нагреве твердого тела.
Атомы в кристаллах расположены закономерно в узлах кристаллической решетки или в местах пересечения кристаллических плоскостей. Все пространство кристалла можно разбить на элементарные ячейки. Повторяя в пространстве элементарную ячейку, можно описать весь кристалл. Простейшей кристаллической ячейкой является куб, по вершинам которого располагаются атомы. Основные типы кристаллических решеток металлов: объемоцентрированная кубическая (О.Ц.К.); гранецентрированная кубическая (Г.Ц.К.).; гексоганальная плотноупакованная (Г.П.У.) рис.1.
Кристаллические решетки характеризуются параметрами: периодом решетки, координационным числом, атомным радиусом, базисом или количеством атомов, приходящимся на одну ячейку, энергией решетки, плотностью упаковки атомов и др.
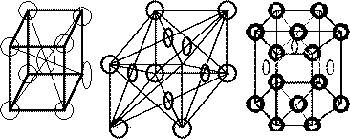
Рис 1. Типы кристаллических решеток. (1.1 - объемоцентрированная кубическая ОЦК; 1.2 - гранецентрированная кубическая плотноупакованная ГЦК; 1.3 - гексоганальная плотноупакованная решетка ГПУ).
Периодом решетки называется расстояние между центрами двух соседних атомов. Координационное число - количество атомов, находящихся на наиболее близком расстоянии от любого атома в решетке. Атомный радиус (половина атомного диаметра) - половина межатомного расстояния между центрами ближайших атомов.
Металлы имеют плотную упаковку атомов, т.е. высокие координационные числа и большое количество атомов, приходящихся на одну элементарную ячейку.
Вследствие неодинаковой плотности атомов в различных направлениях, многие свойства кристалла анизотропны. Металлы и другие элементы и вещества имеют полиморфные превращения. Кристаллическая структура изменяется в зависимости от температуры. Например, кристаллическая решетка железа в интервале температур от 0 до 910 о С - ОЦК (Fe-α); от 910 до 1400 о С - ГЦК (Fe-γ); от 1400 до 1539 о С (плавление) - ОЦК (Fe-α или Fe-δ).
Реальные металлы являются поликристаллическими веществами. Размеры зерен (кристаллов) колеблются в широких пределах от долей микрона до нескольких миллиметров. В приведенных выше примерах рассматривались идеальные кристаллические решетки. Особенностью строения реальных металлических материалов является наличие искажений и дефектов кристаллического строения, вызванное действием температурных, электромагнитных и иных полей, а т .ж. механическими напряжениями. Наибольшее число дефектов возникает при первичной кристаллизации расплава или при пластической деформации твердого тела. Кристаллические дефекты разделяют на точечные, линейные, поверхностные и объемные. Источниками дефектов являются прежде всего примеси. Например, если в алюминии содержится 0.001% (10-5) примеси кремния, то в 1 мм 3 будет 6·10Е14 посторонних атомов. Атомы примесей искажают кристаллические решетки. Примеси могут располагаться в виде отдельных атомов, скоплений по поверхностям или в определенных объемах. Рис 2.1. Другим источником дефектов являются тепловые колебания атомов. Среднее значение амплитуды тепловых колебаний равно 5-10% межатомного расстояния, но энергия тепловых колебаний в решетке распределена неравномерно. Колебания атомов тоже различны. Если на поверхности атом обладает энергией, необходимой для испарения, он может выйти из кристаллической решетки. Образуется дефект, который называется вакансией. Рис 2.2.
Образование дислоцированных атомов (рис. 2.3.) требует большей энергии активации, поэтому количество таких дефектов меньше, преимущественно они возникают при облучении кристаллов.
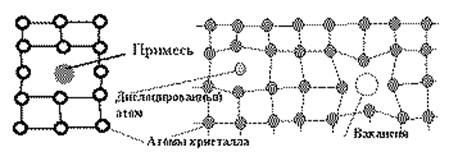
Рис. 2.1 Рис. 2.3. Рис. 2.2.
Рис.2. Точечные дефекты кристаллических решеток. 2.1. - примесный атом; 2.2. - вакансия (дефект Шоттки); 2.3. - дислоцированный атом (дефект Френкеля).
Вакансии имеют большое значение особенно для протекания диффузии, создают условия для повышения пластичности металла при низких температурах.
Реальные кристаллы разделены на фрагменты и блоки (мозаичная структура). Поверхности кристаллов (границы зерен), границы фрагментов и блоков являются местом скопления всевозможных дефектов и местом их возникновения Рис 3. Основными линейными дефектами являются дислокации. Дислокации бывают линейными (краевыми), представляющие собой край экстра - плоскости (полуплоскости) рис 4.1., рис 4.2.; и винтовыми рис. 4
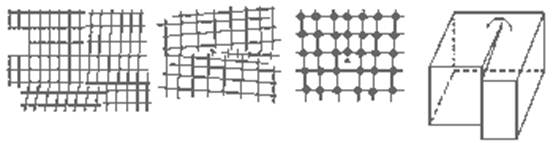
| Рис. 3. Мозаичная структура кристалла | Рис. 4.1. Дислокация на границе блоков | Рис. 4.2. и Рис.4.3. Краевая и винтовая дислокации |
Дефекты влияют на структурночувствительные свойства. Например, наличие дислокаций изменяет прочность металлов. Теоретический подсчет предела упругости дает величину, превышающую реальную в 1000 раз (10 Е5 и 100 МПа) для чистых металлов и в 100 раз для сталей. Бездефектные кристаллические металлические и керамические материалы в виде волокон и НК (нитевидных кристаллов) применяются как арматура - фаза упрочнитель конструкционных композитов. Рис. 5.
В настоящее время разработана дислокационная теория, объясняющая механизмы пластической деформации и причины разрушения металлов, их упрочнения при обработке давлением и иных технологических способах.
Кристаллическая структура металлов
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А1 – кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g - Fe, Al, Cu, Ni, a - Co, Pb, Ag, Au, Pt и др.
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а.
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g - Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
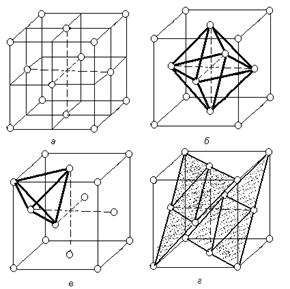 |
| Рисунок 1.5. Гранецентрированная кубическая решетка (а), размещение в ней октаэдрических (б) и октаэдрических (в) пустот; г - расположение плотноупакованных плоскостей (111) |
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение (рисунок 1.5., г).
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы a - Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а – длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические - 0,154 r.
 |
| Рисунок 1.6. Объемноцентрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей (110) б; тетраэдрических (в) и октаэдрических (г) |
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a - Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства (рисунок 1.6.б). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А3 (ГПУ) обладают такие металлы, как Zn, b - Co, Cd, Mg, a - Ti, a - Zr.
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).
 |
| Рисунок 1.7. Гексагональная плотноупакованная решетка (ГПУ): а - расположение атомов; б - выделенные типы пустот в решетке: октаэдрическая (вверху) и тетраэдрическая (внизу) |
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки (рисунок 1.8, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
 |
| Рисунок 1.8. Схема расположения плотноупакованных атомных слоев в решетках: а - ГПУ; б - ГЦК |
Углерод в виде алмаза, кремний, германий, a - олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
| Рисунок 1.9. Кристаллическая решетка алмаза |
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.
Основные типы кристаллических решёток металлов
Физические свойства металлов определяются их электронным строением и природой кристаллической решётки.
Поскольку металлическая связь ненасыщаема и ненаправлена, для металлов характерны кристаллические структуры с высокими координационными числами (количество атомов, которое окружает один атом). Как правило, металлы кристаллизуются в одном из трёх типов решёток, для двух из них координационное число равно 12, а для третьей – 8.
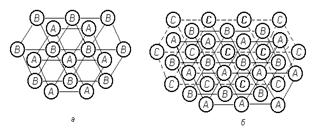
Строение первых двух кристаллических решёток можно представить следующим образом. Мысленно положим шарообразные атомы металлов на стол и плотно придвинем их друг к другу. Мы заметим, что каждый шар окажется в окружении шести соседних шаров (на рисунке ниже – а).

Затем положим сверху на первый слой шаров (А) второй слой (В) так, чтобы шары второго слоя попали в углубления между шарами первого слоя (на рисунке выше – б). Проделаем то же самое, укладывая сверху шары третьего слоя. Укладка шаров третьего слоя возможна двумя различными способами. Однако это не влияет на координационное число, но в результате образуются две неодинаковые структуры.
Первый способ приводит к расположению шаров третьего слоя в точности над шарами первого слоя (на рисунке выше –в). Такая структура называется гексагональной плотнейшей упаковкой (ГПУ) и состоит из чередующихся слоёв атомов металла АВАВ. Слово «гексагональный» означает шестиугольный и указывает, что каждый шар в своём слое окружён шестиугольником ближайших соседей.
Второй способ отличается от первого тем, что расположение шаров третьего слоя С повернуто на 60 градусов вокруг вертикальной оси по отношению к первому слою (на рисунке выше – г). При этом шары третьего слоя оказываются над углублениями между шарами первого слоя. В таком случае только следующий, четвёртый, слой шаров в точности повторяет структуру шаров первого слоя. Такая структура называется кубической плотнейшей упаковкой (КПУ) или гранецентрированной кубической упаковкой (ГЦК) и состоит из чередующихся слоёв атомов металлов АВСАВС.
Третья кристаллическая структура (координационное число равно 8) может рассматриваться как цент куба, в вершинах которого находятся восемь его ближайших соседей. Такая структура называется объёмно-центрированной кубической упаковкой (ОЦУ).
Элементарные ячейки для всех типов кристаллических решёток металлов показаны на рисунке ниже.
Описанные кристаллические структуры отличаются степенью заполнение пространства: наиболее плотноупакованными (степень заполнения пространства составляет 74%) являются кристаллические решётки ГПУ и КПУ, менее плотноупакована (на 68%) – решётка типа ОЦУ. Пустоты играют важную роль в определении структуры металлических соединений и их сплавов.
Кристаллические решётки некоторых металлов
Также важно знать, что ряд металлов в зависимости от температуры может кристаллизоваться в разных типах кристаллических решёток (явление полиморфизма), например белое и серое олово.
Читайте также:
