Наиболее прочная оксидная пленка образуется у металла
Обновлено: 20.05.2024
В атмосферных условиях металлы покрыты оксидными пленками. Первично образующаяся на металле оксидная пленка может иметь аморфную или кристаллическую структуру. Например, в случае окисления алюминия при комнатной температуре образуется аморф-ная пленка толщиной 20¸45Å, которая при нагреве становится кри-сталлической. Первичная пленка на железе меди, цинке с самого на-чала имеет кристаллическое строение. Образование аморфных или кристаллических первичных оксидных пленок зависит не только от физико-химической природы окисляемого металла, но и от условий ее образования, в основном от температуры.
При комнатной температуре в атмосфере воздуха вначале окисление металла идет быстро, но при достижении определенной толщины пленки процесс окисления практически заканчивается. Так, при окислении меди приблизительно через 2 часа толщина пленки достигает 24Å, а затем почти не изменяется. После образования первичной пленки дальнейшее окисление определяется скоростью диффузии через нее металла и кислорода. При диффузии металла зоной роста является внешняя поверхность оксидной пленки. При диффузии кислорода зоной роста является граница металл-оксидная пленка. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста находится внутри оксидной пленки. Схема роста оксидной пленки в этом случае представлена на рис. 1
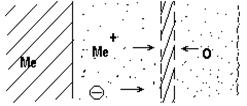 |
Рис. 1 – Схема роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют кристаллическую структуру, обладающую ионной, а также электронной проводимостью, то при диффузии через пленку перемещаются не непосредственные атомы металла, а ионы и свободные электроны. Это не исключает возможности атомной диффузии, но поскольку радиусы ионов металлов значительно меньше атомов, то можно предположить, что основной диффузионный поток от металла будет состоять из их ионов. Кислород же проникает внутрь оксидной пленки в виде атомов, а не ионов, т.к. размер атомов кислорода в два с лишним раза меньше радиуса иона кислорода.
В процессе образования оксидных пленок закон их роста может быть различным, что в основном определяется соотношением объема оксида Vокк объему металла Vм, из которого он образовался. Например, это отношение для некоторых металлов имеет следующее значение:
Mg – 0,35 Zn – 1,57 Ni – 1,64
Sn – 1,31 Cu – 1,71 W – 3,50
Al – 1,38 Fe – 1,78
= k, (1)
где y – толщина оксидной пленки;
t– время окисления;
k – константа.
После интегрирования зависимости (4.1) получим
y = kt + A(2)
Линейный характер роста пленки устанавливается через некоторое время после начала окисления, когда пленка достигает критической величины. Это наблюдается на щелочных и щелочноземельных металлах, а также на таких металлах как ванадий, молибден, вольфрам, образующих оксиды, легко испаряющиеся при нагреве.
y 2 = kt + A(3)
Для некоторых металлов рост пленки можно описать зависимостью
y n = kt + A (4)
(Частный случай – кубическая парабола при n = 3)
Иногда наблюдается логарифмическая зависимость роста оксидной пленки.
y = ln(kt)(5)
Скорость роста оксидной пленки в процессе окисления зависит от температуры. С повышением температуры скорость увеличивается в соответствии с зависимостью
= Ае – Q / RT ,(6)
где Q – энергия активации процесса;
R – газовая постоянная;
T – абсолютная температура.
Следует отметить, что рассмотренные закономерности роста оксидной пленки соблюдается лишь для чистых металлов. Наличие даже следов примесей может сильно изменить свойства поверхности металла и характер реакций его с кислородом.
Образующиеся на металлах в результате окисления пленки делятся на тонкие, средние и толстые. Тонкими принято считать невидимые пленки от мономолекулярных до 400Å, средними от 400 до 5000Å и толстыми – выше 5000Å (0,5 мкм). В процессе пайки металлов большое значение имеют не только толщины, но и свойства оксидных пленок. Плотные, прочно связанные с металлом оксидные пленки труднее удалить с поверхности металла, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом и, чем менее устойчива она при нагреве, тем меньше затруднений возникает в процессе удаления ее при пайке.
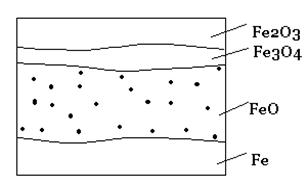
При окислении железа кислородом возможно образование разных соединений в соответствии с диаграммой состояния железо-кислород. Оксидная пленка на железе обычно имеет четко выраженный слоистый характер. На границе с металлом образуется монооксид железа FeO, соответствующая наименьшему содержанию кислорода в оксиде, затем следует промежуточный слой монооксида-оксида железа Fe3O4 и на внешней поверхности пленки – высший оксид Fe2O3. Предполагается, что поверхностный слой металла, находящийся под оксидной пленкой, содержит некоторое количество кислорода в виде твердого раствора с металлом.
Прилегающий к металлу слой монооксида железа FeO (вюстит) имеет кубическую кристаллическую решетку по типу каменной соли. FeO устойчив только при температурах выше 570 0 С. При более низких температурах он не образуется, а при медленном охлаждении распадается с выделением металла по реакции:
4FeO Þ Fe + Fe3O4
При температуре 1377 0 С монооксид железа плавится.
Монооксид-оксид железа Fe3O4 (магнетит) имеет кристалличесую кубическую решетку. Магнетит кристаллографически является самостоятельной фазой, а не молекулярной смесью монооксида и оксида железа. Он устойчив при всех температурах, начиная от комнатной и до точки плавления железа. При нагреве в окислительной среде магнетит переходит в оксид железа a-Fe2O3. Этот переход совершается в две стадии. При нагреве до температуры 220 0 С образуется промежуточная структура оксида g- Fe2O3 с сохранением кубической шпинельной решетки. Двухвалентное железо при этом превращается в трехвалентное:
 |
При дальнейшем нагреве до 400-500 0 С оксид теряет магнитные свойства и образуется решетка оксида железа a- Fe2O3.
Рис. 2 – Микроструктура оксидной пленки на железе (схема)
Оксид железа Fe2O3 (гематит) имеет ромбоэдрическую структуру. Гематит устойчив в широком интервале температур, но при нагреве выше 1100 0 С частично разлагается. При температуре плавления железа гематит полностью диссоциирует на железо и кислород.
При окислении меди образуются три вида оксидов – монооксид меди Cu2O, оксид меди CuO и полуторный оксид меди Cu2O3. Имеются также предположения об образовании в интервале 950-1050 0 С соединения типа недооксида Cu4O. Окисление меди начинается с адсорбции газа на ее поверхности. При комнатной температуре на воздухе происходит образование оксида меди, кристаллизующегося в кубической решетке. Кристаллическая решетка оксида меди ориентирована так, что ребра и грани кубической решетки Cu2O лежат параллельно и граням кубической решетки меди.
Нагрев меди выше 250 0 С вызывает более интенсивное окисление, при этом пленка состоит из смеси оксида и монооксида меди. Рост пленки происходит по диффузионному механизму; предполагают, что при повышенных температурах через пленку диффундируют ионы меди, имеющие малый размер. При 300 0 С и выдержке 5÷10 мин в атмосфере воздуха медь покрывается цветами побежалости.
Наряду с монооксидом меди при окислении также образуется полуторный оксид меди, который, как и монооксид, имеет красный цвет. Кристаллическая решетка его соответствует решетке монооксида меди и отличается от последней только удельной проводимостью. Полуторный оксид меди неустойчив, он начинает разлагаться при 75 0 С. При 400 0 С разложение происходит по уравнению
В интервале 400 – 500 0 С и выдержке 5¸15 мин окисная пленка на меди двухслойная. К металлу примыкает монооксид меди, верхний более тонкий слой состоит из оксида меди, имеющий почти черный цвет. Оксидная пленка в интервале 600 – 800 0 С имеет мелкокристаллическую структуру и плохую связь с металлом. Выше 800 0 С образовавшийся оксид меди разлагается по уравнению
4 CuO Þ 2 Cu2O + O2
В интервале 800 – 950 0 С пленка состоит только из монооксида меди. Этот интервал характерен несколько более прочной связью пленки с основным металлом. При 950¸1050 0 С оксидная пленка приобретает ярко малиновый цвет, что связано, по-видимому, с образованием соединения Cu4O. Оксидная пленка в этом интервале имеет крупнокристаллическую структуру и наиболее прочно держится на металле.
Алюминий при взаимодействии с кислородом при комнатной температуре окисляется с образованием первичной оксидной пленки толщиной 40¸100 мкм. Дальнейшее окисление алюминия тормозится, т.к. образовавшаяся пленка надежно изолирует металл от кислорода. Для оксида алюминия известны модификации a, b, g и др. Наряду с оксидом алюминия известны оксиды состава Al2O – недооксид алю-миния и AlO – субоксид алюминия, существующие при высоких температурах. Первоначально образующийся на поверхности алюми-ния оксидный слой в атмосферных условиях представляет собой аморфное образование. Умеренное нагревание этого слоя до темпе-ратуры выше 200 0 С приводит к возникновению модификации g- Al2O3. В результате взаимодействия с влагой воздуха в оксидной пленке на поверхности алюминия могут образовываться гидрооксиды.
Применяемые в качестве припоев металлы и сплавы также имеют на своей поверхности оксидную пленку. Нагрев под пайку при недостаточной защите может вызывать дальнейшее окисление припоя. Наличие на поверхности припоя в процессе пайки оксидной пленки приводит к ухудшению условий пайки и свойств паяных соединений. Поэтому для получения качественных паяных соединений необходима очистка припоя перед пайкой и надежные условия удаления оксидов в процессе пайки.
В зависимости от состава припои имеют различную окисляемость. Наибольшей стойкостью при высоких температурах отличаются припои на основе никеля.
При легировании основы паяемого металла или припоя легирующие элементы по-разному могут влиять на образование оксидной пленки. Скорость окисления металла может или уменьшаться или увеличиваться. Если легирующие элементы обладают меньшим сродством к кислороду по сравнению с основным металлом, то они обычно остаются под оксидной пленкой в неокисленном состоянии.
На основе анализа состава и строения оксидных пленок можно видеть, что даже при самых благоприятных условиях окисления чистых металлов и сплавов в атмосфере воздуха образующиеся пленки имеют толщину более 20Å. Силы взаимодействия атомов металлов между собой практически исчезают на расстояниях более 10 ангстрем, поэтому обеспечить взаимодействие паяемого металла и расплавленного припоя при наличии на их поверхности оксидных пленок невозможно. Следовательно, металлы необходимо тщательно очищать от оксидных пленок и загрязнений, для чего перед пайкой надо производить механическую зачистку или травление их поверхности в растворах щелочей или кислот. Однако за время между очисткой и пайкой на поверхности металлов вновь образуется тонкая оксидная пленка. Поэтому непосредственно в процессе пайки необходимо удалять оксидную пленку не только с паяемого металла, но и с расплавленного припоя, что достигается применением при пайке флюсов, искусственных газовых сред, вакуума, а также физико-механическими способами разрушения оксидной пленки.
Оксиды на поверхности металлов, механизм их образования и роста. Сравнительная характеристика физической и химической стойкости оксидов
Свойства оксидных пленок
Свойства анодных оксидных пленок в основном определяются их строением и фазовым составом, т.е. структурой. Наблюдениями с помощью обычного оптического микроскопа было установлено, что утолщенные пленки являются пористыми и имеют волокнистую структуру. В зависимости от состава используемого электролита диаметр пор может колебаться в пределах нескольких сотен ангстрем, а их количество может доходить до 10 8 на квадратный сантиметр поверхности пленки.
Применение электронного микроскопа позволило построить идеализированную модель структуры оксидной пленки пористого типа. Келлер и ряд последователей по рельефу поверхности металла, с которого удалена пленка, установили, что оксид состоит из гексагональных ячеек, имеющих форму граненых карандашей, плотно прижатых друг к другу. Если у этих “карандашей” удалить грифели, то образуются поры, которые заполняются электролитом во время формовки оксида. Идеализированная структура по Келлеру в настоящее время принимается за основу и приводится во всех монографиях.
Установление фазового состава стало возможным благодаря применению методов электроно- и рентгенографии, а также инфракрасной спектроскопии. Было установлено, что анодная оксидная пленка может быть аморфной или кристаллической, а иногда содержания и ту и другую фазы. Обнаружено также, что пористость кристаллического анодного оксида может на два порядка превышать пористость пленки.
Способность оксидных пленок предохранять металл от воздействия окружающей среды была обнаружена сразу после открытия процесса анодирования. Анодное окисление металлов стало одним из методов защиты от коррозии в машиностроении и электронной промышленности. Первоначально от защиты от коррозии применялись только тонкие плотные пленки. В настоящее время стали применятся и пористые покрытия, так как они после уплотнения и наполнения не только повышают свои коррозионно-защитные свойства, но и приобретают декоративный вид.
Для оценки коррозионной стойкости часто применяются ускоренные испытания пробой ВИАМ, разработанной во Всесоюзном институте авиационного машиностроения (отсюда ее название). При этом капля пробы наносится на испытываемую анодированную поверхность и измеряется время, в течение которого она разъедает пленку до металла. Результат обнаруживается по изменению цвета капли, когда начинается реакция пробы с металлом.
К электрофизическим свойствам относятся сопротивление электрическому току, диэлектрическая проницаемость, тангенс угла диэлектрических потерь и электрическая прочность. Они достаточно хорошо изучены и отражены практически во всех монографиях, посвященных анодным покрытиям.
Применение оксидных пленок в качестве изоляции обусловлено их высоким сопротивлением электрическому току и большой механической прочностью. Основным преимуществом оксидной изоляции является то, что она сохраняет свои свойства при повышенных температурах. Электрическая прочность, т.е. пробивное напряжение при данной толщине, у разных пленок зависит от многих факторов. Чем плотнее пленка, тем выше ее электрическая прочность. Даже пористые пленки имеют электрическую прочность на порядок выше, чем у воздуха.
Наличие в оксидной пленке пор приводит к тому, что ее эффективная диэлектрическая проницаемость может изменяться в широких пределах при изменении свойств окружающей среды. Это влияние, связанное с конденсацией паров воды в порах пленки, используется при создании датчиков влажности.
Анодные оксидные пленки по своим механическим свойствам относятся к разряду веществ высокой твердости. Особенно большой твердостью обладают пленки оксида алюминия. Обычно для оценки механической прочности оксидной пленки измеряют ее микротвердость на поперечных шлифах. С помощью прибора ПМТ – 3 при небольших нагрузках (обычно 50 гс) установлено, что твердость пористой пленки постепенно убывает при удалении от металла к поверхности оксида. Кроме микротвердости механическую прочность оценивают по сопротивлению истирания к информационным нагрузкам. Исследование износостойкости производится на рабочих поверхностях деталей, используемых в парах трения. Хорошие результаты были получены при анодировании зубчатых колес из алюминиевых сплавов. При анодировании наблюдается не только повышение прочности, но и улучшение антифрикционных свойств, так как оксидный слой легко полируется и становится гладким и твердым.
Контрольные работы 9 класс
тест по химии (9 класс)
Разноуровневые контрольные работы по темам, изученным в 9 классе.
| Вложение | Размер |
|---|---|
| kontrolnaya_rabota_no1_metally.docx | 33.54 КБ |
| kontrolnaya_rabota_no2_nemetally.docx | 16.7 КБ |
| kontrolnaya_rabota_no3_organicheskaya_himiya.docx | 43.38 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Контрольная работа по теме «Металлы»
Часть А. Выполните тестовые задания.
А 1. Электронная формула атома магния:
1) 1s 2 2s 2 2) 1s 2 2s 2 2p 1 3) 1s 2 2s 3 4) 1s 2 2s 2 2p 6 3 s 2
А 2. Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) литий 2) кальций3) калий 4) алюминий
А 3. Наиболее энергично взаимодействует с водой металл:
1) натрий 2) кальций 3) литий 4) калий
А 4. С разбавленной серной кислотой не взаимодействует:
1) железо 2) медь 3) магний 4) цинк
А 5. Тип химической связи в простом веществе натрии:
1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная
А 6. Верны ли следующие суждения о щелочных металлах?
А. Во всех соединениях щелочные металлы имеют степень окисления + 1.
Б. Щелочные металлы хранят под слоем керосина, либо вазелина
1) верно только А2) верно только Б 3) верны оба суждения 4) оба суждения не верны
В1. Заполните таблицу:
Техническое название вещества
Химическая формула вещества
Химическое название вещества
В2. Установите соответствие между исходными веществами и продуктами реакции
Исходные веществаПродукты реакции
А) Ca(OH) 2 + SO 3 1) BaSO 4 +NaCl
Б) CaO + SO 3 2) NaOH + H 2
В) Na 2 SO 4 + BaCl 2 3) CaSO 4 + H 2 O
Г) Na + H 2 O 4) Na 2 O + H 2
Часть С. Дайте развернутый ответ на вопрос.
С1. Осуществите цепочку превращений и назовите продукты реакций:
Вa(OH) 2 ←Вa→ ВaO→Вa (OH) 2 →ВaSO 4
С2. Решите задачу.
Какой объём водорода может быть получен при растворении в воде 80 граммов кальция, если выход газа составил 60% от теоретически возможного?
А 1. Электронная формула атома алюминия:
1) 1s 2 2s 2 2) 1s 2 2s 2 2p 1 3) 1s 2 2s 2 2p 6 3s 1 4) 1s 2 2s 2 2p 6 3s 2 3p 1
1) железо 2) литий3) калий 4) алюминий
А 3. Наиболее прочная оксидная пленка образуется у металла:
1) натрия 2) железа 3) алюминия 4) магния
А 4. С концентрированной серной кислотой не взаимодействует металл (то есть пассивируется):
1) медь 2) железо 3) магний 4) цинк
А 5. При взаимодействии щелочных металлов с неметаллами 7 группы (А) образуются вещества с типом химической связи:
1) ионной 2) металлической 3) ковалентной полярной 4) ковалентной неполярной
А 6. Верны ли следующие суждения об алюминии?
А. Во всех соединениях алюминий имеет степень окисления + 2.
Б. Оксиди гидроксид алюминия проявляют амфотерные свойства.
2) Гашенная известь
3) «Баритовая каша»
4) Горькая (английская) соль
А) NaOH + CO 2 1) Na [Al (OH) 4 ]
Б) BaO + SO 3 2) KOH + H 2
В) Al(OH) 3 + NaOH 3) BaSO 4 + H 2 O
Г) K + H 2 O 4) Na 2 CO 3 + H 2 O
C1 . Осуществите цепочку превращений и назовите продукты реакций:
К→ К 2 O 2 →К 2 O→КOН→К 2 SO 4
Какой объём водорода может быть получен при взаимодействии 48 граммов магния с соляной кислотой, если выход газа составил 80% от теоретически возможного?
А 1. Электронная формула атома железа:
1) 1s 2 2s 2 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 4) 1s 2 2s 2 2p 6 3s 2
1) литий 2) железо3) рубидий 4) алюминий
А 3. Менее энергично реагирует с водой:
1) калий 2) натрий 3) цезий4) литий
1) алюминий 2) цинк 3) магний 4) медь
А 5. При взаимодействии щелочно-земельных металлов с неметаллами 7 группы (А) образуются вещества с типом химической связи:
1) металлической 2) ковалентной полярной 3) ковалентной неполярной 4) ионной
А 6. Верны ли следующие суждения о соединениях железа?
А. Чаще всего в соединениях железо проявляет степень окисления + 2 и +3.
Б. Оксид и гидроксид железа (III) проявляют амфотерные свойства.
1) Известковая вода
2)Мрамор, мел, известняк
3) Поваренная соль
4) Желтая кровяная соль
А) NaOH + SO 2 1) Na [Al (OH) 4 ]
Б) Al 2 O 3 + NaOH (тв) 2) Ca(OH) 2 + H 2
В) Al(OH) 3 + NaOH (р-р)3) Na 2 SO 3 + H 2 O
Г) Ca + H 2 O 4) NaAlO 2 + H 2 O
5) Na 2 SO 4 + H 2 O
C1. Осуществите цепочку превращений и назовите продукты реакций:
Al→ Al 2 O 3 →AlCl 3 → Al(OН) 3 → КAlO 2
№4. Решите задачу.
Какой объём водорода может быть получен при растворении в воде 46 граммов натрия, если выход газа составил 90% от теоретически возможного?
1) алюминий 2) кальций3) калий 4) литий
1) кальций 2) литий 3) калий 4) натрий
А 4. С концентрированной азотной кислотой при комнатной температуре не взаимодействует:
1) цинк 2) медь 3) железо 4) натрий
А 5. Тип химической связи в простом веществе железе:
А 6. Верны ли следующие суждения о щелочно-земельных металлах?
А. Во всех соединениях данные металлы имеют степень окисления + 2.
Б. Щелочно-земельные металлы хранят под слоем керосина.
Б) Na + H 2 O 2) NaOH + H 2
Г) CaO + SO 2 4) Na 2 O + H 2
Fe →Fe 2 O 3 → FeCl 3 → Fe(OН) 3 → Fe 2 O 3
Какой объём водорода может быть получен при взаимодействии 128 граммов цинка с соляной кислотой, если выход газа составил 80% от теоретически возможного?
Контрольная работа №2 «Неметаллы»
А1.Не является неметаллом
А2. Является газом при обычных условиях
1.Бром 2.Йод 3.Хлор 4.Сера
А3.Ядовитый газ с запахом тухлых яиц
1.HCl 2.SO 2 3.H 2 S 4.Cl 2
А4.Азот входит в состав
1.Белков 2. Жиров 3.Углеводов 4. Воды
А6.При растворении аммиака в воде образуется
1.Спирт 2. Пероксид водорода 3. Уксус 4.Нашатырный спирт
А7.Укажите вещество, которое светится в темноте
1.Сера 2. Графит 3. Красный фосфор 4. Белый фосфор
А8.Укажите тип кристаллической решетки алмаза
1.Атомная 2. Молекулярная 3. Ионная 4. Металлическая
А9.Укажите газ, который не горит и не поддерживает горение
А10.Масса алмаза в 100 каратов равна
1.2г 2. 4г 3. 20г 4. 200г
В1.Расставьте коэффициенты методом электронного баланса в схеме реакции: HNO 3 + P + H 2 O H 3 PO 4 + NO
В2.Дайте характеристику реакции : 2SO 3 + H 2 O H 2 SO 4 + Q
С1.Сернистый газ используют для дезинфекции веществ и воздуха в помещениях. Определите массу серы, необходимую для получения 112 л (н.у.) сернистого газа.
А1.Является жидкостью при обычных условиях
1.F 2 2.Cl 2 3.Br 2 4.I 2
А2.Биологическими катализаторами являются
1.Витамины 2.Гормоны 3.Ферменты 4.Микроэлементы
А3.Укажите самый легкий газ
1.Гелий 2.Кислород 3.Азот 4. Водород
А4.Галоген, который в виде своих соединений участвует в построении зубной эмали и поэтому присутствует в зубных пастах
А5. Не является аллотропной модификацией углерода
1.Графит 2. Алмаз 3. Озон 4.Карбин
А6.Раствор аммиака в воде можно обнаружить
1.По вкусу 2.По запаху 3. По цвету 4.По наличию осадка
А7.Заряд ядра атома углерода равен
А8.Укажите газ, который образуется при неполном сгорании топлива
1.SO 2 2.NO 3.CO 2 4.CO
А9.Молярная масса воздуха
1.14 г/моль 2.16 г/моль 3. 32 г/моль 4.29 г/моль
А10.Для обработки ран используют 5% -ный раствор
В1. Расставьте коэффициенты методом электронного баланса в схеме реакции: HCl + KMnO 4 CL 2 + KCl + MnCl 2 + H 2 O
В2. Дайте характеристику реакции: N 2 + 3H 2 кат 2NH 3 + Q
С1. При взаимодействии хлора с иодидом калия получен йод массой
25,4г. Определите объем хлора, который потребовался для этого.
Контрольная работа по теме «Органическая химия», 9 класс
Часть А. Выберите 1 вариант ответа
1.Органическим веществом является.
- Вода.
- Гидроксид натрия.
- Глюкоза.
- Серная кислота.
2. Общая формула предельных углеводородов.
- C n H 2n .
- C n H 2n-2 .
- C n H 2n+2 .
- C n H 2n+1 .
3.Для этилена характерной является реакция:
- Дегидратации.
- Дегидрирования.
- Гидратации.
- Диссоциации.
4.Свойство, НЕ характерное для глюкозы:
- Придаёт прочность растительным клеткам.
- Сладкая на вкус.
- Хорошо растворима в воде.
- Является твёрдым веществом.
5. Органическим веществом является:
- Известковая вода
- Крахмал
- Нитрат серебра
- Ортофосфорная кислота
6.Общая формула спиртов:
- C n H 2n
- C n H 2n-2
- C n H 2n+2
- C n H 2n+1 OH
7. Формула предельного углеводорода, содержащего 7 атомов углерода:
- С 7 Н 10
- С 7 Н 12
- С 7 Н 14
- С 7 Н 16
8. Гомологом этана является вещество с формулой:
- СН 3 −СН 2 −СН 3
- СН 2 =СН−СН 3
- СН≡С−СН 3
- СН 3 СООН
9. Изомером углеводорода, имеющего формулу СН 2 =СН—СН 2 —СН 2 —СН 3 , является вещество с формулой:
- СН 3 −СН=СН−СН 2 −СН 3
- СН 3 −СН=СН−СН 3
- СН 2 =СН−СН 3
- СН 2 =СН 2
10. Формула карбоновой кислоты:
- СН 3 СОН
- СН 3 СООН
- НСООСН 3
- СН 3 −СН 2 ОН
11. Свойство, не характерное для крахмала:
- Взаимодействует с йодом
- Горит
- В горячей воде образует коллоидный раствор
- Растворяется в воде
12. Жиры НЕ бывают
- жидкими
- твёрдыми
- газообразными
13. Белки образуются из
- алканов
- спиртов
- аминокислот
- карбоновых кислот
14. Энергетическую функцию выполняют
- белки
- алканы
- углеводы
- карбоновые кислоты
15. В органических соединениях, углерод проявляет валентность
16. По происхождению полимеры делятся на
- натуральные и химические
- синтетические и природные
- искусственные и химические
- органические и неорганические
17. Мономером для получения полиэтилена является:
- СН 2 =СН 2
- СН 2 =СН-СН 3
- СН 3 −СН 3
- СН 2 =С=CH 2
- Полимер
- Одноатомные спирты.
- Карбоновые кислоты.
- Углеводы.
- Предельные углеводороды.
- Непредельные углеводороды
- Сложный эфир
- СН 3 СООН
- С 2 Н 5 ОН
- СН 3 СООС 2 Н 5
- С 4 Н 10
- С 2 Н 4
- С 6 Н 12 О 6
- (−СН 2 −СН 2 −)n
Выпишите и назовите вещества, которые относятся к классу:
- Составьте полные и сокращённые структурные формулы веществ под номерами 2) и 6).
- Запишите формулу уксусной кислоты, опишите ее физические свойства и применение в быту и промышленности.
- Подсчитайте молекулярную массу белковой молекулы молока, химическая формула которого C 1864 H 3021 O 576 N 468 S 21
Ответы и критерии оценивания контрольной работы
Максимальное количество баллов – 17
Б – 1(этан), 6(гексан), 7(метан)
6) СН 3 ‒СН 2 ‒СН 2 ‒СН 2 ‒СН 2 ‒СН 3
Максимальное количество баллов – 23
1. Уксусная кислота:
Формула : СН 3 -СООН
Физические свойства : представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями
Применение в быту : применяется в бытовой кулинарии, а также в консервировании и для избавления от накип, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния
Применение в промышленности : в пищевой промышленности (пищевая добавка E260), для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
2. Мr(C 1864 H 3021 O 576 N 468 S 21 )= 12*1864+1*3021+16*576+14*468+32*21=22368+3021+9216+6552+672= 41829
Покрытие оксидными плёнками как способ защиты от коррозии металлов
Тема моей исследовательской работы « Покрытие оксидными плёнками как способ зашиты от коррозии металлов».
Всем нам хорошо известен символ Франции – Эйфелева башня. Но в настоящее время башня неизлечимо больна. Как вы думаете, что это за болезнь?
Оказывается, башня изготовлена из обычной стали и неотвратимо ржавеет, разрушается, и только постоянная химиотермия (лечение химическими веществами) помогает бороться с этим смертельным недугом: Эйфелеву башню красили уже 18раз, отчего ее масса увеличилась на 70 тонн. Ржавеют и многие другие изделия из железа: автомобили,морские судна, цистерны, трубопроводы.
Коррозия металлов наносит большой экономический вред. Приводит к уменьшению надежности работы оборудования, к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия так же приводит к загрязнению продукции, и к снижению ее качества.
Основная цель исследования – исследовать действие факторов окружающей среды на степень ржавления металлов и способность защитить их при помощи оксидной антикоррозийной плёнки.
Исходя из цели исследования, были поставлены следующие задачи:
1. Изучить сущность коррозии, её виды, способы защиты от коррозии.
2. Исследовать зависимость скорости коррозии от присутствия кислорода.
3. Исследовать влияние электролитов на процесс коррозии.
5. Исследовать покрытые изделия оксидной плёнкой на устойчивость к коррозии.
Для выполнения этих задач потребовалось следующее оборудование:
· слесарный инструмент, изготовленный в школьной мастерской;
· заранее поставленные опыты по коррозии.
Проблема защиты металлов от коррозии, знакомой человечеству с древних времён по сей день, остается чрезвычайно актуальной. Ежегодные потери из-за коррозии составляет от 20 до 30 млн. тонн металла. Прямой экономический ущерб от неё исчисляется сотнями миллиардов долларов в год.
Коррозия наносит не только прямой ущерб (ежегодно от коррозии теряется около трети мирового годового производства металла), но и косвенный, ведь разрушаются конструкции, на которые был затрачен труд, ржавеют машины, крыши, памятники, мосты, тратятся огромные средства на борьбу с коррозией.
В связи с этим исследование механизма коррозии и разработка методов защиты от неё имеют большое значение.
Коррозии подвергаются различные металлы и сплавы, но наиболее часто приходится сталкиваться с коррозией самого распространенного металла - железа и его различных сплавов. Поэтому мы решили рассмотреть коррозию железа подробнее, исследовать покрытые оксидной плёнкой изделия на устойчивость к коррозии.
Гипотеза : если покрыть железо защитной оксидной пленкой , то скорость коррозии уменьшится.
Объект исследования – защитная антикоррозийная плёнка.
Предмет исследования – стальной слесарный инструмент.
Основной метод исследования – проблемно-поисковый, данная деятельность направлена на решение проблемы, которую следует сформулировать, выяснить пути ее решения, проверить возникшие гипотезы, провести эксперимент, собрать необходимые данные, интерпретировать их и в итоге сделать выводы и обобщения.
Актуальность данной работы в том, что изучая сущность коррозии, её виды и способы защиты от коррозии, экспериментальным путём пришли к выводу, что можно покрыть защитной антикоррозийной пленкой изготовленный своими руками в учебной мастерской слесарный инструмент, при этом используя вторичное сырьё - отработанное машинное моторное масло. Полученные результаты расширили мои знания в технологии защиты металла от коррозии, применении знаний на практике.
ГЛАВА 1. Коррозия металлов и её виды
Коррозия - это разрушение металла под действием внешней среды, окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идет процесс окисления).
В роли окислителя, как правило, выступают
Коррозия в переводе с «латинского» - разъедать.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Химическая коррозия - это разрушение металлов в результате взаимодействия их с сухими газами или жидкостями, не проводящими электрический ток (в газах, нефти), при высоких температурах, когда невозможна конденсация водяного пара. Ей подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин, аппаратура химической отрасли промышленности.
При химической коррозии электроны переходят от металла к окислителю непосредственно.
Электрохимическая коррозия - это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Ей подвергаются подводные части судов в морской и пресной воде, паровые котлы, металлические сооружения и конструкции под водой и в атмосфере, проложенные в грунте трубопроводы и др.
При электрохимической коррозии окислительно-восстановительная реакция разбивается на полу реакции окисления и восстановления и электроны переходят по металлу от восстановителя к окислителю, наряду с химическим процессом идет электрический - перенос электрона, то есть возникает электрический ток.
Коррозия железа, находящегося в контакте с медью и раствором слабой кислоты. Этот вид коррозии приносит наибольший вред!
ГЛАВА 2. Виды и способы оксидирования металлов
Оксидирование – процесс формирования оксидных пленок на поверхности металла.[3] Оксидирование применяется для нанесения оксидных слоев, как в целях защиты, так и для придания металлическому изделию декоративных свойств.
Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например, концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре З00. 450°С в присутствии древесного угля и минерального масла, или в нашем случае отработанного моторного масла.
Оксидирование металла можно проводить несколькими способами:
- анодное оксидирование (электрохимическое);
- пламенные методы (микродуговое оксидирование и др.).
Мы выбрали термическое оксидирование стали , которое позволяют произвести условия нашей мастерской, известное под названием «воронение». В силу ряда преимуществ оно придает поверхности антикоррозийные свойства, красивый внешний вид, применяется для покрытия мелких деталей (в частности для покрытия инструмента).
Термический способ заключается в смазывании изделия тонким слоем минерального масла, раствора масляного или битумного лака в бензине и нагреве до температуры 300—450°С. [3]
Термическое оксидирование – процесс образования оксидной пленки на металле при повышенных температурах и в кислородсодержащих (может быть водяной пар) атмосферах. Термическое оксидирование проводят в нагревательных печах. При термическом оксидировании низколегированных сталей либо железа (операция называется воронение) температуру поднимают до 300 – 450°С (синий цвет побежалости ) . Для легированных сталей термическое оксидирование проводится при более высоких температурах (до 700°С). Продолжительность процесса – около 60 минут. Очень часто термическое оксидирование применяют для создания оксидного слоя на поверхности изделий из кремния. Такой процесс проводится при высоких температурах (800 – 1200°С). Применяются оксидированные кремниевые изделия в электронике.
Оксидирование стали , называемое иначе воронением, относится к одному из многих способов защиты железа от коррозии. Получаемая пленка имеет незначительную толщину (0,6—0,8 мк) и требует последующего промасливания для создания дополнительной защиты. [3 ]
При воронении толщина ее может достигать 10 мк и более, благодаря присутствию магнитной окиси железа пленка имеет черный цвет. Нержавеющие стали оксидированию не поддаются. [4]
Оксидирование стали можно производить термическим, термохимическим, химическим и электрохимическим способами . В зависимости от толщины и цвета получаемой пленки различают операции синения и воронения. [4]
Оксидирование стали (воронение). Пленка считается качественной, если при нанесении капли 2-процентного раствора медного купороса в течение 20 секунд на поверхности не образуются точки красной контактной меди. [2]
ГЛАВА 3. Термическая обработка металлов
Термической обработкой называется совокупность операций нагрева, выдержки и охлаждения твердых металлических сплавов с целью получения заданных свойств за счет изменения внутреннего строения и структуры. Термическая обработка используется либо в качестве промежуточной операции для улучшения обрабатываемости давлением, резанием, либо как в нашем случае окончательная операция технологического процесса, обеспечивающая заданный уровень свойств детали.
Зака́лка - вид термической обработки материалов, заключающийся в их нагреве выше критической температуры, с последующим быстрым охлаждением.[4] Закалка в одном охладителе или двух средах — нагретую до определённых температур 727°С — 768°С ( таблица цвета каления) деталь погружают в закалочную жидкость, где она остаётся до полного охлаждения. Этот способ применяется при закалке несложных деталей из углеродистых и легированных сталей .
Затем выполняется воронение, заключающееся в смазывании изделия тонким слоем минерального масла, раствора масляного или битумного лака в бензине и нагреве до температуры 300 — 450°С.
Термическое оксидирование – процесс образования оксидной пленки на металле при повышенных температурах и в кислородсодержащих атмосферах. Термическое оксидирование провели в нагревательной муфельной печи. При термическом оксидировании низколегированных сталей либо железа температуру поднимают до 300 – 450 °С (синий цвет побежалости , таблица побежалости).
ГЛАВА 4. Экспериментальный этап
В три пробирки налили воды. В одной из них воду прокипятили. Поместили в три пробирки по очищенному наждачной бумагой железному гвоздю и в три пробирки по оксидированному железному. Плотно закрыли пробирки резиновыми пробками, чтобы предотвратить новое растворение кислорода в прокипяченной воде. Наблюдаем, в какой из пробирок быстрее происходит коррозия железа, в какой нет.
При использовании металлических материалов очень важен вопрос о скорости их коррозии, от чего зависит скорость коррозии? Эксперимент поможет нам в этом разобраться. Демонстрируем слайды презентации.
1. Эксперимент №1. Роль кислорода в процессе коррозии железа.
· пробирка 1-ж. гвоздь + вода наполовину
· пробирка 2-ж. гвоздь + полностью
· пробирка 3-ж. гвоздь + вода + масло
Больше ржавчины образуется в пробирке 1- железо соприкасается и с водой и с кислородом. В пробирке 2 ржавчины меньше, т. к. железо соприкасается только с водой. В пробирке 3 гвоздь почти не проржавел, кислород не смог пройти через слой масла, а без кислорода коррозия не развивается. Железо покрыто защитной плёнкой, в трёх пробирках не корродирует, даже в сильно коррозионной среде – растворе хлорида натрия, остается защищенным до тех пор, пока не нарушить плёнку. Коррозия железа в данном случае практически отсутствует, потому что плёнка защищает от проникновения кислорода и хлорид натрия.
2. Эксперимент №2. Влияние электролитов на процесс коррозии железа.
· стакан 1-ж. гвоздь + вода
· стакан 2-ж. гвоздь + раствор NaCl
· стакан 3-ж. гвоздь + медь + раствор NaCl
· стакан 4-ж. гвоздь + алюминий + раствор NaCl
Рассмотрим результаты эксперимента. В стакане 1 мало ржавчины, в чистой воде коррозия идет медленно, т. к. вода слабый электролит. В данном случае мы наблюдаем химическую коррозию. В стакане 2 ржавчины больше, следовательно, хлорид ионы увеличивают скорость коррозии. В стакане 3 скорость коррозии очень велика, образовалось много ржавчины. Следовательно, хлорид натрий - это сильно коррозионная среда для железа, особенно в случае контакта с менее активным металлом - медью. В стакане 4 тоже наблюдаем коррозию, но не железа, а алюминия, т. к железо в контакте с более активным металлом в сильно коррозионной среде -NaCl- не корродирует до тех пор, пока не прокорродирует весь алюминий. В стаканах 3 и 4 - электрохимическая коррозия.
По результатам экспериментов можно сделать выводы:
1. Коррозия железа резко усиливается в присутствии кислорода.
2. Коррозия усиливается, если железо соприкасается с более активным металлом.
3. Скорость коррозии зависит от состава омывающей металл среды, хлорид ионы усиливают коррозию железа.
Великий Гёте сказал: «Просто знать - еще не всё, знания нужно уметь использовать!»
Наука пошла несколькими путями, разработав способы защиты металлов от коррозии.
1. Применение защитных покрытий.
а) Металлические изделия покрывают лаками, красками, эмалями, стеклом, кристаллическими покрытиями.
б) металлические изделия покрывают другими металлами. В качестве металлов для покрытия применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель цинк, олово и другие.
2. Приготовление сплавов стойких к коррозии части машин, инструменты и предметы быта изготовляют из нержавеющей стали и других сплавов, стойких к коррозии. В сплав вводят хром, никель, кремлей, кобальт, алюминий.
3. Электрохимические методы защиты.
а) применение заклепок изготовленных из более активных металлов.
б) Прикрепление пластинок из более активного металла для защиты основного металлического изделия. Например, в паре Zn-Fe (оцинкованное железо)защищено железо, в паре Sn-Cu защищена медь и т. д.
К днищам кораблей прикрепляют протекторы - слитки более активного металла, чем обшивка днища корабля - это протекторная защита с помощью цинка (анодная защита) Катодная защита - защита менее активным металлом (лужёное железо, кузов автомобиля, банки для консервов). Особые требования - не допускать разрушения целостности покрытия.
4. Нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в противоположном направлении. Так обычно защищают трубы нефтепровода, газопровода. Ни в коем случае нельзя перепутать полюсы тока, ошибки должны быть исключены.
В ходе работы, изучая сущность коррозии, её виды и способы защиты от коррозии, экпериментальным путём пришли к выводу, что можно покрыть защитной антикоррозийной пленкой изготовленный своими руками в учебной мастерской слесарный инструмент. Благодаря тому, что на поверхности образуется тонкий защитный слой, предохраняющий расположенный под ним метал от дальнейшей коррозии, антикоррозийный слой разрушается не так быстро, как железо, и при этом было использовано вторичное сырьё - отработанное машинное моторное масло. Полученные результаты расширили мои знания в технологии защиты металла от коррозии, применении знаний на практике.
Теперь мы можем понять широко используемые на практике способы предупреждения и борьбы с коррозией. Однако они полностью не защищают металлы от разрушения, поэтому учёные заняты поиском новых, более перспективных способов защиты. Коррозия металлов осуществляется в соответствие с законами природы, и поэтому её нельзя полностью устранить, её можно лишь замедлить.
Выдвинутая гипотеза подтвердилась : коррозия железа , покрытого оксидной плёнкой , уменьшается .
Список используемой литературы:
1. Бельницкая, Е. А. Любознательным о тайнах вещества. Пособие для учащихся. / Е. А. Бельницкая, Н. В. Манкевич, Г. С. Романовец. – Минск: Адукацыя і выхаванне, 2014
2. Карабанов, И. А. Справочник по техническому труду. / И. А. Карабанов, А. А. Деркачев, В. А. Юдицкий; под ред. И. А. Карабанова. – Москва: Просвещение, 1992
3. Русин, В.Н. Коррозия и защита металлов. / В.Н. Русин – М.: Издательство МГОУ, 1996.
4. Семенова, И.В. Коррозия и защита от коррозии. / И. В. Семенова, Г. М. Флорианович, А. В. Хорошилов; под ред. И. В. Семеновой. – М.: Физматлит, 2002.
Читайте также:
