Наиболее сильно металл коррозирует в растворе хлорида натрия
Обновлено: 05.07.2024
Аннотация научной статьи по химическим технологиям, автор научной работы — Сазонова Елена Алексеевна
В статье рассматривается особенности коррозионных процессов при перевозке технической соли на железнодорожном транспорте . Показано, что в процессе перевозки технической соли (каменной соли) и галита наибольшую коррозионную опасность представляют локальные виды коррозии .
Похожие темы научных работ по химическим технологиям , автор научной работы — Сазонова Елена Алексеевна
Анализ влияния экстремальных климатических условий на лакокрасочные покрытия и коррозионное поведение металлов
Питтинговая коррозия металлов и многослойных систем (исследование, моделирование, прогнозирование, мониторинг)
Текст научной работы на тему «Атмосферная коррозия стали и коррозия стали в растворах хлорида натрия. Некоторые особенности коррозии на железнодорожном транспорте»
АТМОСФЕРНАЯ КОРРОЗИЯ СТАЛИ И КОРРОЗИЯ СТАЛИ В РАСТВОРАХ ХЛОРИДА НАТРИЯ. НЕКОТОРЫЕ ОСОБЕННОСТИ КОРРОЗИИ НА ЖЕЛЕЗНОДОРОЖНОМ ТРАНСПОРТЕ
Сазонова Елена Алексеевна, Пермский институт железнодорожного
транспорта, г. Пермь
Аннотация. В статье рассматривается особенности коррозионных процессов при перевозке технической соли на железнодорожном транспорте. Показано, что в процессе перевозки технической соли (каменной соли) и галита наибольшую коррозионную опасность представляют локальные виды коррозии.
Ключевые слова: коррозия, электрохимический механизм, скорость коррозии, железнодорожный транспорт.
Коррозия стали в водных растворах и атмосферная коррозия стали (при относительной влажности воздуха свыше 60%) протекают по электрохимическому механизму. При относительной влажности воздуха 60-70% начинается конденсация влаги и на поверхности металла появляется адсорбционная пленка воды [1]. При относительной влажности воздуха 100% или непосредственном увлажнении металла (дождь, туман) на поверхности металла происходит образование видимых фазовых слоев воды. Коррозионный процесс, протекающий по электрохимическому механизму) состоит из анодной реакции:
Бе® Бе + 2е (анодное растворение железа) (1),
и катодной реакции (в нейтральных средах и в условиях атмосферной коррозии это реакция восстановления кислорода):
02 + 2е + 2Н20 ® 4 ОН- (2).
Данный коррозионный процесс протекает с кислородной деполяризацией.
Образовавшиеся ионы двухвалентного железа впоследствии окисляются кислородом до трехвалентного состояния и образуют труднорастворимые оксидные и гидроксидные соединения железа.
Состав пленки продуктов коррозии определяется тем, что в средах, близких
к нейтральным (рН > 6), протекают сложные процессы гидролиза ионов Бе2+ и Бе3+, приводящие к образованию полимерных продуктов, их старению, гелеобразованию, дегидратации и осаждению гидроксидов, состав и строение которых изменяются в широких пределах в зависимости от условий [2].
Скорость коррозионного процесса будет определяться концентрацией растворенного кислорода, поскольку доставка растворенного в воде кислорода к корродирующей поверхности металла является замедленной стадией процесса. С ростом концентрации растворенного кислорода скорость коррозии увеличивается. Следует отметить, что при достаточно больших концентрациях растворенного кислорода >12-15 мл/л (эта концентрация превышает растворимость кислорода в воде при нормальных условиях — 6 мл/л) скорость коррозии снижается [3].
Коррозия в растворах хлорида натрия и атмосферная коррозия в присутствие хлорида натрия также протекает с кислородной деполяризацией. Влияние концентрации хлорида натрия на коррозию железа в аэрируемой воде (т.е. на воздухе) при комнатной температуре показано на рис.1. С возрастанием концентрации скорость коррозии вначале увеличивается, затем снижается и в насыщенном растворе №С1 (26%) становится меньше, чем в дистиллированной воде [3]. Максимальная скорость коррозии наблюдается в 3% растворе №С1. По мере повышения концентрации хлорида натрия в воде постепенно уменьшается растворимость кислорода - этим объясняется снижение скорости коррозии при высоких концентрациях. Первоначальное возрастание скорости коррозии связано с изменением защитных свойств пленки ржавчины (при меньшей концентрации №С1 пленка продуктов коррозии на железе более плотная), образующейся на корродирующем железе и повышением электропроводности раствора.
Коррозионные повреждения объектов железнодорожного транспорта возникают и развиваются вследствие разнородности состава и структуры металла, повышенной влажности и агрессивности окружающей атмосферы, увлажнения поверхности металла и ее загрязнения перевозимыми грузами повышенной коррозионной агрессивности (солью, минеральными удобрениями и др.) [4, 5].
По характеру воздействия коррозионной среды на металлоконструкции железнодорожного транспорта, подвергающиеся электрохимической и химической коррозии, можно, в частности, отметить следующие виды коррозии:
- коррозия при трении (нижние листы и крышки выгрузочных люков бункерных вагонов и полувагонов, используемых при перевозке сыпучих грузов)
- коррозия при неполном и переменном погружении в растворы (по раме полувагонов) [5].
Рис. 1 Влияние концентрации хлорида натрия на коррозию железа
Скорость коррозии металла различных элементов рамы и кузова полувагонов находится в пределах 0,1-0,2 мм/год. Коррозия металла таких Ф элементов рамы как двутавр хребтовой балки, диафрагмы и вертикальные листы поперечных балок, наблюдается в основном в местах концентрации влаги и остатков грузов [5].
Усиленная коррозия в щелях, местах соединения стоек, нижней обвязки и поперечных балок приводит к распиранию сварного шва. При этом глубина коррозионных повреждений достигает 5-8 мм. В связи с высокой загруженностью этого узла коррозия в щелях и зазорах зачастую приводит к образованию трещин в местах приварки стоек к нижней обвязке [6].
Следует также отметить, что стали для рельсов и рельсовых креплений не являются коррозионностойкими. Обычно элементы рельсовых скреплений не имеют специальных противокоррозионных покрытий. В этих условиях металлические конструкции верхнего строения пути подвержены разрушению, в первую очередь под влиянием атмосферных условий и засорителей (руда, уголь, соли, удобрения и т.п.) [5].
сыпучими материалами вызывает, как правило, Обычно питтинговой коррозии с последующим неравномерную коррозию подвергаются стали различного химического состава в среде гранилированных или кристаллических минеральных удобрений, а коррозионная активность этих продуктов наиболее полно может быть оценена двумя показателями: потерей массы и глубиной повреждения.
При разрушении поверхности металла, взаимодействующего с сыпучими материалами, следует учитывать состояние поверхности самого металла и
Контакт с твердыми локальную коррозию [7]. переходом в сплошную
условия воздействия среды:
- коррозионную агрессивность, температуру и влажность среды;
- наличие и состав водорастворимых соединений;
- абразивное воздействие среды на металл и нарушение сплошности защитных пленок;
- физические и физико-химические свойства среды.
Скорость и механизм процесса коррозии существенным образом зависят от температуры окружающей среды. При нормальной температуре коррозионные процессы в твердых средах без участия жидкой фазы не протекают, а агрессивность этих сред обуславливается количеством и составом, содержащихся в них растворимых веществ и условиями увлажнения. Постоянный доступ кислорода к поверхности металла и высокая концентрация электролита создают весьма агрессивную коррозионную среду.
Влажность среды существенным образом влияет на скорость коррозии, воздействуя как на анодный (процесс растворения ионов металла), так и на катодный процесс (процесс восстановления кислорода), на изменение омического сопротивления. Структурная неоднородность коррозионной среды вызывает появление микро- и макрокоррозионных элементов на поверхности металла.
Недостаток влаги для протекания анодного процесса - одна из характерных причин, тормозящих анодное растворение металла в сыпучих средах.
Для каждого типа частиц существует критическая влажность воздуха, ниже которой коррозия отсутствует, выше этого значения наблюдается резкое увеличение скорости коррозии.
Особенности коррозионных процессов, протекающих в сыпучих продуктах (в отличие от жидких электролитов) обусловлены свойствами твердых дисперсных сред:
- различные формы связи воды с частицами среды, которые в значительной мере определяют свойства образующегося сложного электролита, в частности, значение электропроводности;
- гетерогенность (неоднородность) строения и свойств среды в микромасштабе (наличие отдельных составляющих частиц среды, влаги, газовых пустот), так и в макромасштабе (чередование участков среды с различными физико-механическими свойствами: влажностью, степенью, уплотнения, составом и структурой) ограниченные возможности для перемещения жидкой и газообразной фаз.
Скорость коррозии металлов при контакте с сыпучими материалами будет определяться следующим:
Для достаточно влажных сред будет превалировать катодный контроль (медленной стадией процесса будет процесс восстановления кислорода)
Для сухих сред со значительной кислородной проницаемостью из-за недостатка влаги для гидратации ионов металла (они образуются в ходе анодной реакции) превалирующим будет анодный контроль (медленной стадией процесса будет анодное растворение металла).
Таким образом, основываясь на имеющиеся литературные данные можно предположить, что при контакте низколегированных сталей 09Г2Д и 10ХНДП (это марки сталей из которых изготовлены элементы конструкций полувагонов) с технической солью (хлоридом натрия) будет иметь место локальная коррозия. Скорость коррозионного процесса будет возрастать с увеличением влажности технической соли.
1. Семенова И.В., Флорианович Г.М., Хорошилов А.В. Коррозия и защита от коррозии. М.: ФИЗМАТЛИТ, 2002, С.158.
2. Сухотин А.М. Физическая химия пассивирующих пленок на железе. Л.: Химия, 1989.
3. Улиг Г.Г., Реви Р.У Коррозия и борьба с ней. Л.: Химия, 1989. 456 с.
4. Великанов А.В., Веденкин С.Г. Защита транспортных конструкций и подвижного состава от коррозии и снижение потерь металла// Вестник ВНИИ ж. -д. транспорта.1983.№3.С.26-30.
5. Герасименко А.А., Александров Я.И., Андреев И.Н. и др. Защита от коррозии, старения, и биоповреждений машин, оборудования и сооружений: Справочник. В 2 Т. М.: Машиностроение, 1987.Т.2. 784 С.
6. Костров В.Б. Анализ фактического срока службы полувагонов// Вестник ВНИИ ж.-д. транспорта. 1983.№2.С.33-35.
7. Герасименко А. А., Александров Я.И., Андреев И.Н. и др. Защита от коррозии, старения, и биоповреждений машин, оборудования и сооружений: Справочник. В 2 Т. М.: Машиностроение, 1987. Т.1. 688 С.
Коррозия металлов.Сплавы

При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.
Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.
Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
5. Вещества, введение которых уменьшает агрессивность среды, называют
А) катализаторы коррозии
Б) активаторы коррозии
В) ингибиторы коррозии
Ответы: 1Г; 2А; 3Б; 4Г; 5В
Просмотр содержимого документа
«Коррозия металлов.Сплавы»
Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.


По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
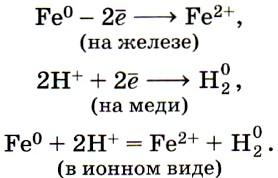
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
Презентация по химии на тему "Коррозия металлов"
1группа – определение понятия и значение
2группа –виды коррозии
3 группа –механизмы коррозии (объяснение
опыта)
4 группа –виды повреждений
5 группа – способы защиты
6 группа – использование современных
материалов
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией
Коррозия металлов
Виды коррозии
химическая
электрохимическая
происходит в газах без участия воды
протекает во влажных средах
Одним из наиболее широко распространенных коррозионных процессов является ржавление железа.
Его можно описать суммарным уравнением:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3
Коррозия металлов
1. Нанесение защитных покрытий:
- неметаллическими материалами
- металлами
2. Использование нержавеющих сталей
3. Введение в среду ингибиторов
4. Применение протектора
С п о с о б ы з а щ и т ы
Защита поверхности металла металлическими покрытиями
хромирование
золочение
никелирование
Защита поверхности металлов неметаллическими покрытиями
Защиты от коррозии: изготовление изделий из нержавеющих сталей, катодная защита
С п о с о б ы з а щ и т ы
С п о с о б ы з а щ и т ы
Тест «Коррозия металлов» вариант -1
Часть А (задания с выбором одного правильного ответа)
А1. Коррозию металлов и сплавов вызывает
1) вода и кислород
2) оксиды углерода и серы
3) растворы солей
4) все перечисленные компоненты
А2. Вещества, введение которых уменьшает агрессивность среды, называют
1) катализаторы коррозии
2) активаторы коррозии
3) ингибиторы коррозии
4) протектор
А3. Для защиты стальных корпусов морских судов обычно используют
1) Na
2) Zn
3) Cu
4) Fe
А4. При контакте железа с медью в водной среде на железе протекает процесс
1) 2H+ + 2e → H2
2) Fe0 – 2e → Fe2+
3) Fe2+ + 2e → Fe0
4) Cu2+ + 2e → Cu0
Тест «Коррозия металлов» вариант -2
Часть А (задания с выбором одного правильного ответа)
А1. Наиболее сильно металл корродирует
1) в растворе хлорида натрия
2) в кипяченой дистиллированной воде
3) в сухом воздухе
4) в дистиллированной воде
А2. Более активный металл, предотвращающий коррозию менее активного металла, называется
1) катализатор коррозии
2) активатор коррозии
3) ингибитор коррозии
4) протектор
А3. Покрытие луженого железа
1) Mg
2) Zn
3) Sn
4) Cu
А4. При контакте железа с медью в водной среде на меди протекает процесс
1) 2H+ + 2e → H2
2) Fe0 – 2e → Fe2+
3) Fe2+ + 2e → Fe0
4) Cu2+ + 2e → Cu0
Вариант №1 – 4,3,2,2
Вариант №2 – 1,4,3,1
Вариант №3 – 3,4,2,2
Вариант №4 - 3,2,1,1
Критерии оценивания:
Правильно 4 ответа – 5 баллов
Правильно 3 ответа - 4 балла
Правильно 2 ответа - 3 балла
Домашнее задание
1. параграф 10 + конспект
2. составить синквейн
3. По желанию: УПР №1,2
АРТИСТИЧЕСКАЯ (констатируются факты по проблеме, без их обсуждения);
ПОЛОЖИТЕЛЬНАЯ (высказываются положительные моменты);
НЕГАТИВНАЯ (констатируются отрицательные моменты по изучаемой проблеме);
ЭМОЦИОНАЛЬНАЯ (группа формулирует свои эмоции, которые они испытывали при работе с материалом)
ТВОРЧЕСКАЯ
(можно высказывать самые “бредовые идеи и предположения”);
АНАЛИТИЧЕСКАЯ (проводится анализ, группа отвечает на вопросы: почему? зачем? связи?);
"ш е с т ь ш л я п"
Р Ж А Е С Т Ж Е Л Е З О
Краткое описание документа:
Презентация по химии "Коррозия металлов"является дополнением к методической разработке урока "Коррозия металлов" по программе О.С.Габриеляна, 9 класс, базовый уровень. Данная презентация выстроена по технологии развития критического мышления через чтение и письмо.
Слайды презентации содержат информацию о понятии "коррозия", ее видах, диаграмму об ущербе от коррозии, уравнение химической реакции коррозии железа в водной среде, а также материал о способах защиты от коррозии, включая современные материалы, например ризолин .
В презентации имеется текст проверочного теста, ответы на вопросы и критерии оценивания для организации самопроверки.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Разработка открытого урока по химии: "Коррозия металлов" 9 класс
Тема: Коррозия металлов. Способы защиты металлов от коррозии. .
изучить сущность процесса коррозии металлов и способы защиты от коррозии; научить использовать приобретённые знания для объяснения явлений окружающей среды;
развивать умения наблюдать, сравнивать, обобщать, делать самостоятельные выводы, работать с учебником; развивать познавательный интерес к предмету, используя межпредметные связи;
Деятельность учителя
Деятельность обучающихся
наглядности
I. Организационный момент . Приветствует учеников, проверяет готовность к уроку, желает успеха.
Ученики осмысливают поставленную цель.
II. Проверка домашней работы.
Решите цепочку превращений:
1. Наружный слой металлов имеет электронов: а)1-3, б) 7, в) 4-7, г) 0.
2. Металлы имеют связь: а) ковалентную, б) водородную, в) металлическую, г) ионную.
3. Металлические свойства в группах с увеличением порядкового номера: а) сначала >, затем
4. s , р - металлы не встречаются в свободном виде, так как: а) их мало, б) очень активны, в) гигроскопичны, г) получают электролизом.
5. Металлы нельзя получить: а) А l -термией, б) Из оксида с помощью С и СО, в) взаимодействием кислоты с металлом, г) восстановление из оксида Н2.
6. Металлы не выделяют водород из: а) HCl , б) H 3 PO 4 , в) H 2 SO 4 , г) HNO 3
7. Металлы имеют разную пластичность, так как: а) образуют ионы металлов, б) свободные частицы, в) разная упаковка в кристаллической решетке, г) им это не присуще.
8. Металлы V - V ΙΙ групп хрупкие, так как: а) много свободных электронов, б) нетипичные металлы, в) нет блеска, г) отличаются строением.
9. Переходные металлы: а) Na , K ; б) Al , Zn ; в) Mg , Ca ; г) нет таких.
10. Разложение электролитов током – это: а) гидролиз, б) электролиз, в) гидратация, г) нет такого процесса.
1а2в3в4б5в6г7в8а9б10б
Ученики отвечают на разноуровневые вопросы.
Подготовка учащихся к активному восприятию нового материала
Задания для групп:
1. Изучите теоретический материал по своему направлению
2. Подготовьте спикера
3. Оформите постеры для ответа.
Учитель: Для того, чтобы продуктивно дать отпор «Рыжему дьяволу» мы должны немного отдохнуть.
6. Физминутка
7. Выступления групп с защитой постеров.
Виды коррозии
· По характеру разрушения металла различают коррозию сплошную, язвенную и точечную (демонстрация фотографий коррозии металлов).
· химическая (газовая) коррозия – происходит в сухих газах, при полном отсутствии влаги.
вос-ль С u 0 – 2 e → Cu 2+ /2/ окисление
ок-ль O 2 0 +4 e →2 O 2- /1/ восстановление
Вывод: кислород оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов.
· электрохимическая коррозия – происходит в среде электролита с возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (процесс окисления), происходят электрические (перенос электронов от одного участка изделия к другому).
Учитель вспоминает еще раз о разрушении Эйфелевой башни, она ржавеет и разрушается. Это сложный процесс, который включает несколько стадий. Суммарно оно выглядит следующим образом:
4 Fe + 6 H 2 O (влага) + 3 O 2(воздух) → 4 Fe ( OH )3 (учащиеся самостоятельно рассматривают окислительно – восстановительые процессы, делают выводы).

Однако химически чистое железо почти не корродирует. Техническое железо, содержащее различные примеси, например, в чугунах и сталях, ржавеет. Если на контакт двух металлов (железо и медь) попадает раствор электролита, например, соляная кислота, то образуется гальванический элемент, и начинается окислительно-восстановительная реакция. В результате реакции более активный металл (железо) окисляется и переходит в раствор, а ионы водорода восстанавливаются на менее активном металле (меди):
в-ль Fe 0 – 2 e → Fe 2+ (ок-ие)
ок-ль 2H + + 2e → H2 (вос-ие)
Способы защиты металлов от коррозии.
Далее учитель рассказывает о том, что еще в Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было рассмотрено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро.
1.Защитные поверхностные покрытия:
а) металлическое (цинк, олово, никель, свинец)
б) неметаллические (лаки, краски, эмали…)
2.Создание сплавов с антикоррозионными свойствами – легирование
металлов (никель, кобальт, хром, вольфрам…)
3. Введение ингибиторов
4. Протекторная защита

IV. Закрепление урока.
Обобщим наш материал, 1.Я задаю первый вопрос, кто на него ответит, задает свой любому ученику класса. (3 минуты),
2. Игра « учитель всегда прав», в этой игре учитель в своих утверждениях делает ошибки и учащиеся должны найти и аргументировать эту ошибку.
3. Тест – пятиминутка:
1. Коррозию металлов и сплавов вызывает
2. Наиболее сильно металл коррозирует
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
5. Вещества, введение которых уменьшает агрессивность среды, называют
Ученики отвечают на вопросы учителя аргументируют свои ответы.
Ученики отвечают на вопросы тестов
V. Итог урока . Этап рефлексии:
Рефлексия: «Три М».
Учащимся предлагается назвать три момента, которые у них получились хорошо в процессе урока, и предложить одно действие, которое улучшит их работу на следующем уроке.
Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше. Многие армянские сказки заканчиваются фразой: «… первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял». Я уверена, что сегодня с урока вы уходите с яблоками, хотя и виртуальным. Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов!
Подведение итогов урока.
Учащиеся называют три момента, которые у них получились хорошо в процессе урока, и предложить одно действие
VI. Домашнее задание. Объясняет особенности выполнения домашней работы.
Конспект урока+презентация+видео по теме "Коррозия металлов"(9 класс)
Тема урока: «Коррозия металлов» (9 класс, УМК О.С. Габриеляна).
Автор: Черногорова Лариса Викторовна, учитель химии МБОУ СШ № 31 г. Липецка
Цель урока: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
Задачи урока:
Образовательные: изучить сущность коррозии металлов с химической точки зрения, выяснить способы защиты металлов от коррозии.
Развивающие :
1.Развить умение проведения химического эксперимента с соблюдением правил техники безопасности.
2.Строить логические цепочки и выводы из наблюдений.
3.Прогнозировать решение некоторых проблем.
Воспитательные :
1.Совершенствовать коммуникативные умения в ходе коллективного обсуждения.
2.Продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Тип урока: открытие новых знаний на основе системно-деятельностного подхода
Методы и приемы обучения : метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Форма работы : индивидуально - групповая (класс разбит на 4 группы).
Ожидаемые результаты: Учащиеся будут знать понятие коррозия, её виды, будут объяснять механизм этого процесса, будут объяснять значение коррозии для жизнедеятельности человека, будут отстаивать свою точку зрения и делать выводы, находя решение проблемы.
Оборудование: раздаточный материал на столах учащихся; презентация Power Point , видеофрагмент "Коррозия металлов"; ноутбук, проектор, интерактивная доска;
За неделю до урока закладываются опыты по изучению факторов, влияющих на коррозию:
опыт №1 - железный гвоздь помещен в дистиллированную воду
опыт №2 - железный гвоздь помещён в водопроводную воду
опыт №3 - железный гвоздь помещён в раствор хлорида натрия
опыт №4 - в раствор хлорида натрия помещен гвоздь с прикрепленной медной проволочкой
опыт №5 - в раствор хлорида натрия помещен гвоздь и с прикреплённой магниевой проволочкой
опыт №6 - железный гвоздь помещен в слабощелочной раствор хлорида натрия
опыт №7 - железный гвоздь помещён в подкисленный раствор хлорида натрия
Этапы урока
Деятельность ученика
1. Организационный
Учитель начинает урок с приветствия и позитивного настроя, желает плодотворной работы и отличных оценок.
Учащиеся сидят за столами в составе 4-х рабочих групп
2. Формулирование темы
Учитель: Сегодня у нас необычный урок, тему которого мы попытаемся сформулировать вместе. Для этого нам предстоит ознакомиться с некоторой информацией, которая имеется у каждой группы на столе.
(Просит представителя от каждой группы зачитать вслух информацию). Слайды 1-6
Учитель: Ребята, в чём проблема? Кто является виновником в данных ситуациях.
Учитель: Да, действительно, причиной масштабного разрушения металлов и изделий из них является коррозия. Коррозии подвергаются камни, пластмассы и другие полимерные материалы, древесина, но чаще всего она является врагом для металлов.
Итак, какова будет тема сегодняшнего урока?
Учитель: Совершенно правильно -"Коррозия металлов". Слайд 7
Один человек от каждой группы встаёт и зачитывает информацию со своего стола (приложение №1 к уроку).
Учащиеся высказывают предположения, указывают на коррозию
Учащиеся предлагают формулировки.
Учащиеся записывают тему в тетрадь.
3. Формулирование цели и задач урока
Учитель демонстрирует видеофрагмент, в основе которого лежит стихотворение:
Мы видим мрачную картину,
Вот ржавый гвоздь и ржавая труба,
И даже новую машину
За год буквально съела ржа.
Ползет она как змей ужасный
И вглубь, и вширь, и поперек.
Корабль, краскою блиставший,
С дырой в боку ко дну идет.
Ржавеет все – тросы, лебедка,
Опоры зданий и мостов,
И даже руль подводной лодки
Всегда к ржавлению готов.
И где же выход из проблемы,
И в чем причина бедствий тех?
Найдем ответ мы непременно.
Учитель: Что же нам надо будет выяснить сегодня на уроке о коррозии, чтобы найти выход из проблемы, касающейся разрушения металлов?
Учитель обобщает: Чтобы бороться с врагом, его надо знать в лицо. Таким образом, нам надо будет ответить на следующие вопросы:
1. В чём состоит сущность коррозии?
2. Какие виды коррозии встречаются в природе?
3. Какие факторы оказывают влияние на коррозию?
4. Можно ли противостоять коррозии? Слайд 8
Эпиграфом к сегодняшнему уроку будет являться следующая фраза: «Знать – значит победить!» (А.Н. Несмеянов)
Учащиеся высказывают свои предположения
4. Открытие новых знаний
Учитель: Для того, чтобы найти ответы на поставленные вопросы, мы проведём небольшую групповую работу по заданиям, которые вы сейчас получите (раздаёт дидактический материал, приложение №2 к уроку). Время на выполнение - 5-7 минут, затем каждая группа предоставляет отчёт о проделанной работе.
Выполняют задания по инструкциям
5. Контроль и коррекция полученных знаний.
Учитель просит представителя от 1 группы зачитать задание, предложенный текст и вариант ответа.
По ходу ответа учитель открывает информацию на слайде презентации. Слайды 9-11.
Учитель: Одним из замечательных памятников старого Дели в Индии является минарет Кутуб-Минар, построенный в 1200 г. Во дворе минарета уже более тысячи лет стоит известная Делийская железная колонна. Эта колонна знаменита тем, что она не подверглась разрушающему действию коррозии. О Делийской колонне рассказывают много легенд, касающихся ее исключительной коррозийной стойкости.
Чем же объясняют исключительную коррозийную устойчивость металла, из которого сделана эта колонна? Есть разные версии её антикоррозийной устойчивости, но, скорее всего, высокую коррозийную стойкость колонны можно объяснить условиями, в которых она находится. Дело в том, что климат Дели, в особенности там, где находится колонна, очень сухой: относительная влажность в течение года не превышает 50-60%, а обычная – в пределах 30- 40%. Слайд 12.
А какие ещё факторы оказывают влияние на скорость протекания коррозии? Об этом нам расскажет группа №2. Слайд s 13-14
Учитель : Если вы спросите 100 разных людей, что у них ассоциируется с Парижем, то, скорее всего, услышите - Эйфелева башня. Слайд 15
Эта железная леди является самой узнаваемой, самой посещаемой и самой фотографируемой туристической достопримечательностью мира.
Больше 200 миллионов людей посетили Эйфелеву башню с тех пор, как ее построили в 1889 году, ведь именно с вершины этой башни можно увидеть весь Париж. Но вся беда в том, что башня серьёзно больна, коррозия очень сильно разрушает её конструкции. Чтобы защитить башню от коррозии её покрывают 60 тоннами краски каждые 7 лет. Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и прежде всего легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (V в. до н. э.) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить.
О том, как это можно сделать нам расскажет группа №3.
По ходу выступления учитель демонстрирует информацию на слайде. Слайд 16-17
Учитель: Как вы уже, наверное, поняли - коррозия - самый опасный враг металлов. Но любого врага всегда можно не только укротить, но и приручить. Можно ли коррозию использовать во благо для металлов? Об этом нам расскажет группа №4.
Учащиеся класса оформляют записи в тетрадях.
Выступление учащегося (зачитывает задание и предлагает вариант ответа).
Учащиеся оформляют записи в тетрадях.
6. Первичное закрепление правильности усвоения материала.
Учитель: Ребята, мы нашли с вами ответы на все вопросы, поставленные в начале урока. А сейчас проверим, как вы поняли и усвоили новый материал. Для этого я каждой группе задам отдельный вопрос.
На слайде демонстрируются вопросы для каждой группы. Слайд 18
Вопрос 1. Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа?
Вопрос 2. Медная гайка навернута на болт, изготовленный из железа. Какая из этих деталей будет разрушаться при коррозии во влажном воздухе
Вопрос 3. Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
Вопрос 4 . Можно ли ставить на зуб стальную коронку, если на соседнем поставлена золотая?
Учащиеся отвечают на вопросы
7. Проверка правильности усвоения знаний
Учитель: А теперь небольшая проверочная работа на оценку. Проводится тест - пятиминутка по индивидуальным заданиям (приложение №3)
Выполняют тест на отдельных листках
§10, №№1,2 Слайд 1 9
Записывают в дневники
9. Рефлексия: «Три М».
Учащиеся совещаются, затем озвучивают свою версию для всех
10. Подведение итогов урока
Учитель: Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше".
Многие армянские сказки заканчиваются фразой: «… первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял».
Я уверена, что сегодня с урока вы уходите с яблоками, хотя и виртуальным.
Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов! Слайд 2 0
Учащиеся покидают кабинет
Приложение №1.
Информация 1 . В III столетии до нашей эры на острове Родос был построен маяк в виде огромной статуи бога Солнца Гелиоса. Статуя была изготовлена из глины, основой служил железный каркас, а сверху статуя была покрыта листами из бронзы ( сплав меди с оловом). Колосс Родосский считался одним из 7 чудес света однако просуществовал всего 66 лет и рухнул во время землетрясения.
В начале прошлого столетия по заказу одного американского миллионера, была построена роскошная яхта «Зов моря». Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из стали. Когда яхту спустили на воду, оказалось, что она не пригодна к использованию. И ещё до выхода в открытое море была полностью выведена из строя.
Информация 2.
31 января 1951 года во время сильного мороза обрушился железный мост в Квебеке (Канада), введенный в эксплуатацию в 1947 году.
В 1964 году рухнуло одно из самых высотных сооружений в мире – 400 метровая антенная мачта в Гренландии.
В 1967 году, в Западной Вирджинии был разрушен Серебряный мост. Стальной висячий мост рухнул меньше, чем за минуту. В результате погибли 46 людей, которые в то время находились на мосту.
В 1983 году в США, во время смерча из-за ослабших болтов был разрушен самый высокий мост Кинзу.
Информация 3. Подсчеты, которые были сделаны в начале 20-х годов ХХ века, показали, что за время с 1860 по 1920 года, то есть за 60 лет, было выплавлено чугуна во всем мире 1860 млн. тонн, из них 660 млн. тонн было безвозвратно потеряно, что составило около 33% от всего выплавленного металла.
Сейчас считают, что примерно около 10% всей ежегодно выплавляемой стали идет на покрытие безвозвратных потерь металлов. Наша страна ежегодно теряет 5-6 млн. тонн металла. Иначе говоря, буквально в пыль превращается годовая продукция крупного металлургического комбината. Каждая шестая доменная печь работает впустую.
Информация 4. За 1997-1999 годы в ОАО "Самаранефтегаз" произошло 4594 прорыва нефтепроводов и 5883 прорыва водоводов.
По оценкам специалистов, от 5 до10 процентов транспортных строительных конструкций, зданий и сооружений ежегодно выходит из строя или требует ремонта из-за повреждений. Наиболее повреждаемыми инженерными сооружениями на транспорте являются железобетонные фундаменты, опоры контактной сети и линий электропередачи, мосты, виадуки и путепроводы, подземные пешеходные переходы, коллекторы сточных вод, сети водоснабжения.
Ежегодно в различные трубопроводы закачивается около 70000 млрд. литров воды, каждый третий из которых не доходит до потребителя. В деньгах это примерно 600 млрд. рублей убытка, не считая моральных и материальных издержек от аварий.
Приложение №2.
Текст №1. Коррозия металлов. Основные виды коррозии.
Коррозия (от латинского “corrodere” – разъедать, разрушать) – это процесс самопроизвольного разрушения металлов и сплавов при их взаимодействии с окружающей средой.
В основе коррозийных процессов лежат окислительно-восстановительные реакции, сопровождающиеся переходом металлов в более устойчивое, естественное состояние.
Естественное состояние металла в природе – это его окисленное состояние. Металлы входят в состав минералов самого разнообразного состава. Круг металлов, которые можно встретить в природе в свободном состоянии, весьма ограничен (примером могут служить золотые самородки). Человечество тратит огромное количество энергии на выделение металлов из его соединений, а коррозия возвращает их обратно.
Таким образом, коррозию можно рассматривать как процесс перехода металла в то естественное, природное состояние, в котором мы встречаем его в земной коре.
Коррозию часто отождествляют с термином "ржавчина". На самом деле это не одно и тоже. К оррозия — это процесс, а ржавчина - один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. Ржавчина — это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии.
По механизму протекания коррозионных процессов выделяют два вида коррозии - химическую и электрохимическую.
Химическая коррозия представляет собой самопроизвольное разрушение металла в результате окислительно - восстановительной реакции с веществами - окислителями из окружающей среды. Она может протекать в любых средах и не сопровождается возникновением электрического тока.
Окислителями (корродирующими агентами) могут быть сухие газы (О2, СО2, SО2, HC1, оксиды азота и др.), перегретый водяной пар, жидкости, не являющиеся электролитами (нефть, смазочные масла, керосин и др.), а также расплавы органических и неорганических веществ, в том числе металлов.
В зависимости от этого химическая коррозия бывает газовая или жидкостная.
Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают при контакте двух металлов с разной химической активностью.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
На аноде происходит окисление атомов металла Роль анода выполняет более активный металл.
На катоде происходит принятие электронов, которые поступают с анода, каким-либо окислителем (ионы, молекулы, которые содержатся в растворе электролита и способны восстанавливаться).
В кислотах в качестве окислителя преимущественно выступают ионы водорода, тогда на катоде протекает следующий процесс: В нейтральной среде в качестве окислителя преимущественно выступает растворенный кислород, тогда на катоде протекает следующий процесс:Роль катода выполняет менее активный металл или примесные включения.
Читайте также:
