Наиболее сильно металл коррозирует в
Обновлено: 18.05.2024
Тема урока: «Коррозия металлов» (9 класс, УМК О.С. Габриеляна).
Автор: Черногорова Лариса Викторовна, учитель химии МБОУ СШ № 31 г. Липецка
Цель урока: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора).
Задачи урока:
Образовательные: изучить сущность коррозии металлов с химической точки зрения, выяснить способы защиты металлов от коррозии.
Развивающие :
1.Развить умение проведения химического эксперимента с соблюдением правил техники безопасности.
2.Строить логические цепочки и выводы из наблюдений.
3.Прогнозировать решение некоторых проблем.
Воспитательные :
1.Совершенствовать коммуникативные умения в ходе коллективного обсуждения.
2.Продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
Тип урока: открытие новых знаний на основе системно-деятельностного подхода
Методы и приемы обучения : метод проблемного изложения материала, метод поисковой беседы, исследовательский метод и сопровождение лабораторного проблемного эксперимента.
Форма работы : индивидуально - групповая (класс разбит на 4 группы).
Ожидаемые результаты: Учащиеся будут знать понятие коррозия, её виды, будут объяснять механизм этого процесса, будут объяснять значение коррозии для жизнедеятельности человека, будут отстаивать свою точку зрения и делать выводы, находя решение проблемы.
Оборудование: раздаточный материал на столах учащихся; презентация Power Point , видеофрагмент "Коррозия металлов"; ноутбук, проектор, интерактивная доска;
За неделю до урока закладываются опыты по изучению факторов, влияющих на коррозию:
опыт №1 - железный гвоздь помещен в дистиллированную воду
опыт №2 - железный гвоздь помещён в водопроводную воду
опыт №3 - железный гвоздь помещён в раствор хлорида натрия
опыт №4 - в раствор хлорида натрия помещен гвоздь с прикрепленной медной проволочкой
опыт №5 - в раствор хлорида натрия помещен гвоздь и с прикреплённой магниевой проволочкой
опыт №6 - железный гвоздь помещен в слабощелочной раствор хлорида натрия
опыт №7 - железный гвоздь помещён в подкисленный раствор хлорида натрия
Этапы урока
Деятельность учителя
Деятельность ученика
1. Организационный
Учитель начинает урок с приветствия и позитивного настроя, желает плодотворной работы и отличных оценок.
Учащиеся сидят за столами в составе 4-х рабочих групп
2. Формулирование темы
Учитель: Сегодня у нас необычный урок, тему которого мы попытаемся сформулировать вместе. Для этого нам предстоит ознакомиться с некоторой информацией, которая имеется у каждой группы на столе.
(Просит представителя от каждой группы зачитать вслух информацию). Слайды 1-6
Учитель: Ребята, в чём проблема? Кто является виновником в данных ситуациях.
Учитель: Да, действительно, причиной масштабного разрушения металлов и изделий из них является коррозия. Коррозии подвергаются камни, пластмассы и другие полимерные материалы, древесина, но чаще всего она является врагом для металлов.
Итак, какова будет тема сегодняшнего урока?
Учитель: Совершенно правильно -"Коррозия металлов". Слайд 7
Один человек от каждой группы встаёт и зачитывает информацию со своего стола (приложение №1 к уроку).
Учащиеся высказывают предположения, указывают на коррозию
Учащиеся предлагают формулировки.
Учащиеся записывают тему в тетрадь.
3. Формулирование цели и задач урока
Учитель демонстрирует видеофрагмент, в основе которого лежит стихотворение:
Мы видим мрачную картину,
Вот ржавый гвоздь и ржавая труба,
И даже новую машину
За год буквально съела ржа.
Ползет она как змей ужасный
И вглубь, и вширь, и поперек.
Корабль, краскою блиставший,
С дырой в боку ко дну идет.
Ржавеет все – тросы, лебедка,
Опоры зданий и мостов,
И даже руль подводной лодки
Всегда к ржавлению готов.
И где же выход из проблемы,
И в чем причина бедствий тех?
Найдем ответ мы непременно.
Учитель: Что же нам надо будет выяснить сегодня на уроке о коррозии, чтобы найти выход из проблемы, касающейся разрушения металлов?
Учитель обобщает: Чтобы бороться с врагом, его надо знать в лицо. Таким образом, нам надо будет ответить на следующие вопросы:
1. В чём состоит сущность коррозии?
2. Какие виды коррозии встречаются в природе?
3. Какие факторы оказывают влияние на коррозию?
4. Можно ли противостоять коррозии? Слайд 8
Эпиграфом к сегодняшнему уроку будет являться следующая фраза: «Знать – значит победить!» (А.Н. Несмеянов)
Учащиеся высказывают свои предположения
4. Открытие новых знаний
Учитель: Для того, чтобы найти ответы на поставленные вопросы, мы проведём небольшую групповую работу по заданиям, которые вы сейчас получите (раздаёт дидактический материал, приложение №2 к уроку). Время на выполнение - 5-7 минут, затем каждая группа предоставляет отчёт о проделанной работе.
Выполняют задания по инструкциям
5. Контроль и коррекция полученных знаний.
Учитель просит представителя от 1 группы зачитать задание, предложенный текст и вариант ответа.
По ходу ответа учитель открывает информацию на слайде презентации. Слайды 9-11.
Учитель: Одним из замечательных памятников старого Дели в Индии является минарет Кутуб-Минар, построенный в 1200 г. Во дворе минарета уже более тысячи лет стоит известная Делийская железная колонна. Эта колонна знаменита тем, что она не подверглась разрушающему действию коррозии. О Делийской колонне рассказывают много легенд, касающихся ее исключительной коррозийной стойкости.
Чем же объясняют исключительную коррозийную устойчивость металла, из которого сделана эта колонна? Есть разные версии её антикоррозийной устойчивости, но, скорее всего, высокую коррозийную стойкость колонны можно объяснить условиями, в которых она находится. Дело в том, что климат Дели, в особенности там, где находится колонна, очень сухой: относительная влажность в течение года не превышает 50-60%, а обычная – в пределах 30- 40%. Слайд 12.
А какие ещё факторы оказывают влияние на скорость протекания коррозии? Об этом нам расскажет группа №2. Слайд s 13-14
Учитель : Если вы спросите 100 разных людей, что у них ассоциируется с Парижем, то, скорее всего, услышите - Эйфелева башня. Слайд 15
Эта железная леди является самой узнаваемой, самой посещаемой и самой фотографируемой туристической достопримечательностью мира.
Больше 200 миллионов людей посетили Эйфелеву башню с тех пор, как ее построили в 1889 году, ведь именно с вершины этой башни можно увидеть весь Париж. Но вся беда в том, что башня серьёзно больна, коррозия очень сильно разрушает её конструкции. Чтобы защитить башню от коррозии её покрывают 60 тоннами краски каждые 7 лет. Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и прежде всего легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (V в. до н. э.) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить.
О том, как это можно сделать нам расскажет группа №3.
По ходу выступления учитель демонстрирует информацию на слайде. Слайд 16-17
Учитель: Как вы уже, наверное, поняли - коррозия - самый опасный враг металлов. Но любого врага всегда можно не только укротить, но и приручить. Можно ли коррозию использовать во благо для металлов? Об этом нам расскажет группа №4.
Учащиеся класса оформляют записи в тетрадях.
Выступление учащегося (зачитывает задание и предлагает вариант ответа).
Учащиеся оформляют записи в тетрадях.
6. Первичное закрепление правильности усвоения материала.
Учитель: Ребята, мы нашли с вами ответы на все вопросы, поставленные в начале урока. А сейчас проверим, как вы поняли и усвоили новый материал. Для этого я каждой группе задам отдельный вопрос.
На слайде демонстрируются вопросы для каждой группы. Слайд 18
Вопрос 1. Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа?
Вопрос 2. Медная гайка навернута на болт, изготовленный из железа. Какая из этих деталей будет разрушаться при коррозии во влажном воздухе
Вопрос 3. Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
Вопрос 4 . Можно ли ставить на зуб стальную коронку, если на соседнем поставлена золотая?
Учащиеся отвечают на вопросы
7. Проверка правильности усвоения знаний
Учитель: А теперь небольшая проверочная работа на оценку. Проводится тест - пятиминутка по индивидуальным заданиям (приложение №3)
Выполняют тест на отдельных листках
§10, №№1,2 Слайд 1 9
Записывают в дневники
9. Рефлексия: «Три М».
Учащимся предлагается назвать три момента, которые у них получились хорошо в процессе урока, и предложить одно действие, которое улучшит их работу на следующем уроке.
Учащиеся совещаются, затем озвучивают свою версию для всех
10. Подведение итогов урока
Учитель: Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше".
Многие армянские сказки заканчиваются фразой: «… первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял».
Я уверена, что сегодня с урока вы уходите с яблоками, хотя и виртуальным.
Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов! Слайд 2 0
Учащиеся покидают кабинет
Приложение №1.
Информация 1 . В III столетии до нашей эры на острове Родос был построен маяк в виде огромной статуи бога Солнца Гелиоса. Статуя была изготовлена из глины, основой служил железный каркас, а сверху статуя была покрыта листами из бронзы ( сплав меди с оловом). Колосс Родосский считался одним из 7 чудес света однако просуществовал всего 66 лет и рухнул во время землетрясения.
В начале прошлого столетия по заказу одного американского миллионера, была построена роскошная яхта «Зов моря». Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из стали. Когда яхту спустили на воду, оказалось, что она не пригодна к использованию. И ещё до выхода в открытое море была полностью выведена из строя.
Информация 2.
31 января 1951 года во время сильного мороза обрушился железный мост в Квебеке (Канада), введенный в эксплуатацию в 1947 году.
В 1964 году рухнуло одно из самых высотных сооружений в мире – 400 метровая антенная мачта в Гренландии.
В 1967 году, в Западной Вирджинии был разрушен Серебряный мост. Стальной висячий мост рухнул меньше, чем за минуту. В результате погибли 46 людей, которые в то время находились на мосту.
В 1983 году в США, во время смерча из-за ослабших болтов был разрушен самый высокий мост Кинзу.
Информация 3. Подсчеты, которые были сделаны в начале 20-х годов ХХ века, показали, что за время с 1860 по 1920 года, то есть за 60 лет, было выплавлено чугуна во всем мире 1860 млн. тонн, из них 660 млн. тонн было безвозвратно потеряно, что составило около 33% от всего выплавленного металла.
Сейчас считают, что примерно около 10% всей ежегодно выплавляемой стали идет на покрытие безвозвратных потерь металлов. Наша страна ежегодно теряет 5-6 млн. тонн металла. Иначе говоря, буквально в пыль превращается годовая продукция крупного металлургического комбината. Каждая шестая доменная печь работает впустую.
Информация 4. За 1997-1999 годы в ОАО "Самаранефтегаз" произошло 4594 прорыва нефтепроводов и 5883 прорыва водоводов.
По оценкам специалистов, от 5 до10 процентов транспортных строительных конструкций, зданий и сооружений ежегодно выходит из строя или требует ремонта из-за повреждений. Наиболее повреждаемыми инженерными сооружениями на транспорте являются железобетонные фундаменты, опоры контактной сети и линий электропередачи, мосты, виадуки и путепроводы, подземные пешеходные переходы, коллекторы сточных вод, сети водоснабжения.
Ежегодно в различные трубопроводы закачивается около 70000 млрд. литров воды, каждый третий из которых не доходит до потребителя. В деньгах это примерно 600 млрд. рублей убытка, не считая моральных и материальных издержек от аварий.
Приложение №2.
Текст №1. Коррозия металлов. Основные виды коррозии.
Коррозия (от латинского “corrodere” – разъедать, разрушать) – это процесс самопроизвольного разрушения металлов и сплавов при их взаимодействии с окружающей средой.
В основе коррозийных процессов лежат окислительно-восстановительные реакции, сопровождающиеся переходом металлов в более устойчивое, естественное состояние.
Естественное состояние металла в природе – это его окисленное состояние. Металлы входят в состав минералов самого разнообразного состава. Круг металлов, которые можно встретить в природе в свободном состоянии, весьма ограничен (примером могут служить золотые самородки). Человечество тратит огромное количество энергии на выделение металлов из его соединений, а коррозия возвращает их обратно.
Таким образом, коррозию можно рассматривать как процесс перехода металла в то естественное, природное состояние, в котором мы встречаем его в земной коре.
Коррозию часто отождествляют с термином "ржавчина". На самом деле это не одно и тоже. К оррозия — это процесс, а ржавчина - один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. Ржавчина — это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии.
По механизму протекания коррозионных процессов выделяют два вида коррозии - химическую и электрохимическую.
Химическая коррозия представляет собой самопроизвольное разрушение металла в результате окислительно - восстановительной реакции с веществами - окислителями из окружающей среды. Она может протекать в любых средах и не сопровождается возникновением электрического тока.
Окислителями (корродирующими агентами) могут быть сухие газы (О2, СО2, SО2, HC1, оксиды азота и др.), перегретый водяной пар, жидкости, не являющиеся электролитами (нефть, смазочные масла, керосин и др.), а также расплавы органических и неорганических веществ, в том числе металлов.
В зависимости от этого химическая коррозия бывает газовая или жидкостная.
Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Примером коррозионных процессов электрохимического характера является разрушение деталей машин и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, во влажной атмосфере, в технических растворах, под действием смазочно-охлаждающих жидкостей, применяемых при механической обработке металлов и т.д.
Причиной электрохимической коррозии является образование на поверхности металла большого количества микрогальванических пар, которые возникают при контакте двух металлов с разной химической активностью.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
На аноде происходит окисление атомов металла Роль анода выполняет более активный металл.
На катоде происходит принятие электронов, которые поступают с анода, каким-либо окислителем (ионы, молекулы, которые содержатся в растворе электролита и способны восстанавливаться).
В кислотах в качестве окислителя преимущественно выступают ионы водорода, тогда на катоде протекает следующий процесс: В нейтральной среде в качестве окислителя преимущественно выступает растворенный кислород, тогда на катоде протекает следующий процесс:Роль катода выполняет менее активный металл или примесные включения.
Коррозия металлов.Сплавы

При плавлении металлы обычно смешиваются, образуя сплавы. Ещё в глубокой древности люди заметили, что в большинстве случаев сплавы обладают другими, нередко более полезными для человека свойствами, чем составляющие их чистые металлы.
Компонентами сплавов могут быть и неметаллы, и соединения.
По состоянию компонентов сплавы могут быть однородными, когда при сплавлении образуется как бы раствор одного металла в другом, например сплавы меди и олова, золота и серебра, и неоднородными, например чугун, представляющий собой механическую смесь железа и углерода.
Сплавы классифицируют по-разному, в зависимости от того, какой признак взят за основу. Чаще всего сплавы подразделяют по составу. Например, выделяют медные, алюминиевые, никелевые, титановые и другие сплавы.
Есть группы сплавов, носящие общие названия: бронзы, латуни и др. Иногда в названии сплава отмечают особо ценные компоненты: бериллиевые бронзы, вольфрамовая сталь и др.
В металлургии железо и все его сплавы выделяют в одну группу под названием чёрные металлы; остальные металлы и их сплавы имеют техническое название цветные металлы.
Подавляющее большинство железных (или чёрных) сплавов содержит углерод. Их разделяют на чугуны и стали. См. учебник
Коррозия металлов
Ржавчина, которая появляется на поверхности стальных и чугунных изделий – это яркий пример коррозии.
Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк.
Задания на закрепление материала:
1. Коррозию металлов и сплавов вызывает
А) вода и кислород
Б) оксиды углерода и серы
В) растворы солей
Г) все перечисленные компоненты
2. Наиболее сильно металл коррозирует
А) в растворе хлорида натрия
Б) в кипяченой дистиллированной воде
В) в сухом воздухе
Г) в дистиллированной воде
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
А) катализатор коррозии
Б) активатор коррозии
В) ингибитор коррозии
5. Вещества, введение которых уменьшает агрессивность среды, называют
А) катализаторы коррозии
Б) активаторы коррозии
В) ингибиторы коррозии
Ответы: 1Г; 2А; 3Б; 4Г; 5В
Просмотр содержимого документа
«Коррозия металлов.Сплавы»
Конспект урока по химии в 9 классе
Тема урока: «Сплавы. Коррозия металлов.


По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы – происходит химическая коррозия. Рис.43
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Рассм. рис. 44, а затем написать:
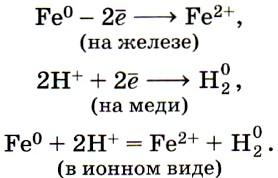
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
Коррозия металлов. Защита от коррозии.
Внимание! Все тесты в этом разделе разработаны пользователями сайта для собственного использования. Администрация сайта не проверяет возможные ошибки, которые могут встретиться в тестах.
Металлы под действием определенных факторов среды подвергаются разрушению. Это нежелательный процесс. Как защитить металлы от коррозии? На эти вопросы дайте верные ответы, выполнив тестовые задания разной сложности.
Список вопросов теста
Вопрос 1
Наиболее активно корродирует:
- химически чистое железо
- железо в отсутствии влаги
- техническое железо в растворе электролита
Вопрос 2
Для получения металлических покрытий железа используются металлы, которые по сравнению с железом :
- более активны
- и более активные, и менее активные
- менее активные
- металлы не используются, только покрывают краской
Вопрос 3
В основе коррозии металлов лежат реакции:
- соединения
- замещения
- окислительно-восстановительные
- горения
- разложения
- обмена
Вопрос 4
Вещества каких классов могут образоваться в результате коррозии?
- соли
- кислоты
- оксиды
- гидроксиды
Вопрос 5
Что происходит с металлом при коррозии?
- восстанавливается
- окисляется
- испаряется
- не изменяется
Вопрос 6
Что такое коррозионная среда?
- среда, окружающая металл
- кислая среда, в которой находится металл
- щелочная среда, в которой находится металл
- любые активные вещества, оказывающие воздействие на металл
Вопрос 7
Что такое патина?
- оксид меди (II)
- гидроксид меди (II)
- карбонат меди (II)
- дигидроксокарбонат меди(II)
Вопрос 8
Какая коррозия происходит в отсутствии влаги?
- грунтовая
- газовая
- атмосферная
- контактная
Вопрос 9
Если поверхность металла покрыта оловом, то такой способ защиты называется:
- никелированием
- оцинкованием
- лужением
- хромированием
- легированием
- воронением
Вопрос 10
- вещества, ускоряющие процесс коррозии
- вещества, замедляющие процесс разрушения металла
- вещества, позволяющие обнаружить коррозию
Вопрос 11
Чаще всего подвергается коррозии:
- свинец
- серебро
- олово
- железо
- медь
- чугун
Вопрос 12
Какие условия сильно ускоряют процесс коррозии?
- повышенная влажность
- наличие примесей в металле
- высокие температуры
- электрический ток
Вопрос 13
Что придаёт стали нержавеющие свойства?
- серебро, кремний
- хром, никель,
- олово, марганец
- цинк, олово
Вопрос 14
- специальное введение в сплав элементов, замедляющих процесс коррозии;
- покрытие железного листа слоем олова
- создание контакта с более активным металлом
- покрытие металла краской.
- покрытие металла защитным слоем эмали
Вопрос 15
Присоединение к защищаемому металлу другого, более активного металла называется:
- металлопокрытие
- контактная защита
- легирование
- протекторная защита
Вопрос 16
Из какого материала изготовлена консервная банка?
- луженой жести
- легированной стали
- алюминия
Вопрос 17
Какие из нижеперечисленных металлов выполняют для свинца роль анодного покрытия: ,
Разработка открытого урока по химии: "Коррозия металлов" 9 класс
Тема: Коррозия металлов. Способы защиты металлов от коррозии. .
изучить сущность процесса коррозии металлов и способы защиты от коррозии; научить использовать приобретённые знания для объяснения явлений окружающей среды;
развивать умения наблюдать, сравнивать, обобщать, делать самостоятельные выводы, работать с учебником; развивать познавательный интерес к предмету, используя межпредметные связи;
Деятельность обучающихся
наглядности
I. Организационный момент . Приветствует учеников, проверяет готовность к уроку, желает успеха.
Ученики осмысливают поставленную цель.
II. Проверка домашней работы.
Решите цепочку превращений:
1. Наружный слой металлов имеет электронов: а)1-3, б) 7, в) 4-7, г) 0.
2. Металлы имеют связь: а) ковалентную, б) водородную, в) металлическую, г) ионную.
3. Металлические свойства в группах с увеличением порядкового номера: а) сначала >, затем
4. s , р - металлы не встречаются в свободном виде, так как: а) их мало, б) очень активны, в) гигроскопичны, г) получают электролизом.
5. Металлы нельзя получить: а) А l -термией, б) Из оксида с помощью С и СО, в) взаимодействием кислоты с металлом, г) восстановление из оксида Н2.
6. Металлы не выделяют водород из: а) HCl , б) H 3 PO 4 , в) H 2 SO 4 , г) HNO 3
7. Металлы имеют разную пластичность, так как: а) образуют ионы металлов, б) свободные частицы, в) разная упаковка в кристаллической решетке, г) им это не присуще.
8. Металлы V - V ΙΙ групп хрупкие, так как: а) много свободных электронов, б) нетипичные металлы, в) нет блеска, г) отличаются строением.
9. Переходные металлы: а) Na , K ; б) Al , Zn ; в) Mg , Ca ; г) нет таких.
10. Разложение электролитов током – это: а) гидролиз, б) электролиз, в) гидратация, г) нет такого процесса.
1а2в3в4б5в6г7в8а9б10б
Ученики отвечают на разноуровневые вопросы.
Подготовка учащихся к активному восприятию нового материала
Задания для групп:
1. Изучите теоретический материал по своему направлению
2. Подготовьте спикера
3. Оформите постеры для ответа.
Учитель: Для того, чтобы продуктивно дать отпор «Рыжему дьяволу» мы должны немного отдохнуть.
6. Физминутка
7. Выступления групп с защитой постеров.
Виды коррозии
· По характеру разрушения металла различают коррозию сплошную, язвенную и точечную (демонстрация фотографий коррозии металлов).
· химическая (газовая) коррозия – происходит в сухих газах, при полном отсутствии влаги.
вос-ль С u 0 – 2 e → Cu 2+ /2/ окисление
ок-ль O 2 0 +4 e →2 O 2- /1/ восстановление
Вывод: кислород оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов.
· электрохимическая коррозия – происходит в среде электролита с возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (процесс окисления), происходят электрические (перенос электронов от одного участка изделия к другому).
Учитель вспоминает еще раз о разрушении Эйфелевой башни, она ржавеет и разрушается. Это сложный процесс, который включает несколько стадий. Суммарно оно выглядит следующим образом:
4 Fe + 6 H 2 O (влага) + 3 O 2(воздух) → 4 Fe ( OH )3 (учащиеся самостоятельно рассматривают окислительно – восстановительые процессы, делают выводы).

Однако химически чистое железо почти не корродирует. Техническое железо, содержащее различные примеси, например, в чугунах и сталях, ржавеет. Если на контакт двух металлов (железо и медь) попадает раствор электролита, например, соляная кислота, то образуется гальванический элемент, и начинается окислительно-восстановительная реакция. В результате реакции более активный металл (железо) окисляется и переходит в раствор, а ионы водорода восстанавливаются на менее активном металле (меди):
в-ль Fe 0 – 2 e → Fe 2+ (ок-ие)
ок-ль 2H + + 2e → H2 (вос-ие)
Способы защиты металлов от коррозии.
Далее учитель рассказывает о том, что еще в Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было рассмотрено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро.
1.Защитные поверхностные покрытия:
а) металлическое (цинк, олово, никель, свинец)
б) неметаллические (лаки, краски, эмали…)
2.Создание сплавов с антикоррозионными свойствами – легирование
металлов (никель, кобальт, хром, вольфрам…)
3. Введение ингибиторов
4. Протекторная защита

IV. Закрепление урока.
Обобщим наш материал, 1.Я задаю первый вопрос, кто на него ответит, задает свой любому ученику класса. (3 минуты),
2. Игра « учитель всегда прав», в этой игре учитель в своих утверждениях делает ошибки и учащиеся должны найти и аргументировать эту ошибку.
3. Тест – пятиминутка:
1. Коррозию металлов и сплавов вызывает
2. Наиболее сильно металл коррозирует
3. Для защиты стальных корпусов морских судов обычно используют
4.Более активный металл, предотвращающий коррозию менее активного металла, называется
5. Вещества, введение которых уменьшает агрессивность среды, называют
Ученики отвечают на вопросы учителя аргументируют свои ответы.
Ученики отвечают на вопросы тестов
V. Итог урока . Этап рефлексии:
Рефлексия: «Три М».
Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше. Многие армянские сказки заканчиваются фразой: «… первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял». Я уверена, что сегодня с урока вы уходите с яблоками, хотя и виртуальным. Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов!
Подведение итогов урока.
Учащиеся называют три момента, которые у них получились хорошо в процессе урока, и предложить одно действие
VI. Домашнее задание. Объясняет особенности выполнения домашней работы.
Коррозия металлов. Виды коррозии металлов
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная

Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Читайте также:
