Назовите отличие металлической связи от ионной
Обновлено: 04.10.2024
Все вещества во Вселенной имеют свою структуру строения, а следовательно — и свои свойства. Об особой связи частиц веществ впервые написал Уильям Хиггинс в XVIII веке. Тогда в своем научном труде ученый описал «особую соединительную силу», которая стала основой для возникновения теории о валентности, а позже — теории о химических связях.
Современная химия описывает существование нескольких типов химических связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Атомы металлов между собой объединяются в вещества с появлением новых свойств. При этом связь между атомами-металлами отличается свойствами от ковалентной и ионной связей.
Металлическая связь — особый вид химической связи, возникающий между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов. Металлическая связь встречается в простых веществах металлах и их сплавах.
Металлическая связь формируется за счет частиц двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Вещества с металлической связью чаще всего представляют собой чистые соединения и сплавы различных металлов, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Атомы металлов имеют ряд особенностей:
- небольшое количество электронов на внешнем электронном уровне;
- большие радиусы.
Благодаря данным характеристикам соединения металлов легко отдают внешние электроны, что позволяет им становиться ионами с положительным зарядом.
По природе происхождения металлическая связь близка к ковалентной, а также к ионным соединениям, но в силу ряда отличий представляет собой отдельный тип химических связей.
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема— объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
Виды, особенности образования, как происходит, схема
Металлическая связь не может существовать между отдельными соединенными между собой атомами. Она появляется только в веществах.
При этом связи в этих веществах не отличаются постоянством. Электроны, отделившиеся от атомов металлов, превращаются в «электронный газ», благодаря чему они могут спокойно путешествовать по кристаллической решетке.
Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Характерные кристаллические решетки
Кристаллическая решетка в веществах с металлической связью является основой, неким каркасом кристалла, в узлах которой находятся ионы металла, а между ними в виде «электронного газа» перемещаются отрицательно заряженные электроны, периодически присоединяющиеся к ионам металлов, превращая их в атомы.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелочноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдрическую решетку.
Физические свойства металлов
Почти все металлы и их сплавы имеют сходные физические свойства:
Ионная и металлическая связь
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Виды металлических связей и как они образуются
Назовите отличие металлической связи от ионной
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
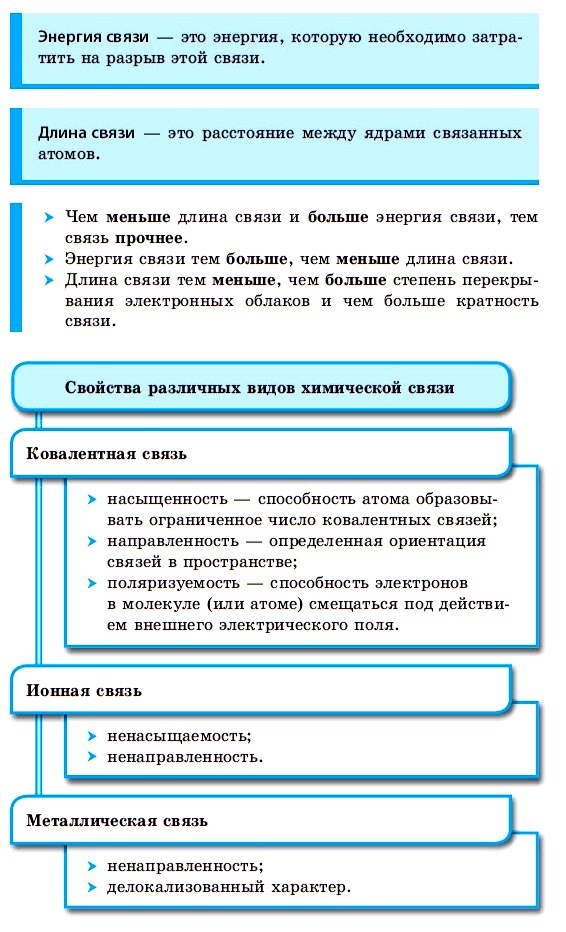
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.

Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.

При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:

В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.

В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой: В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.

Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов: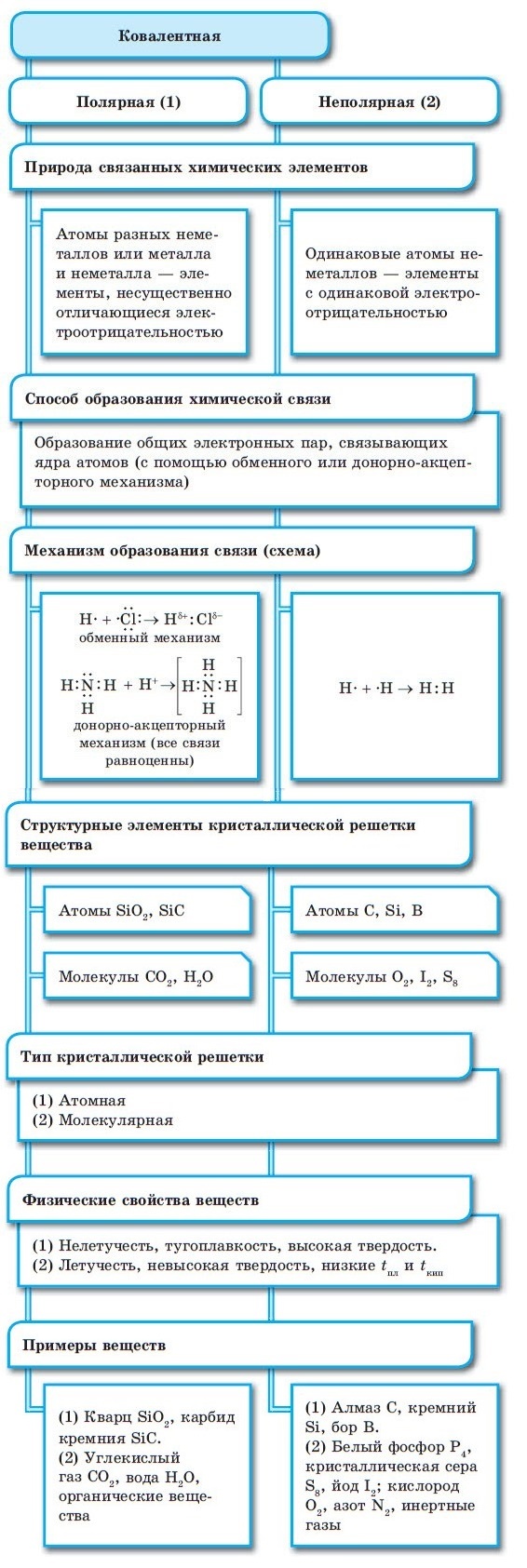
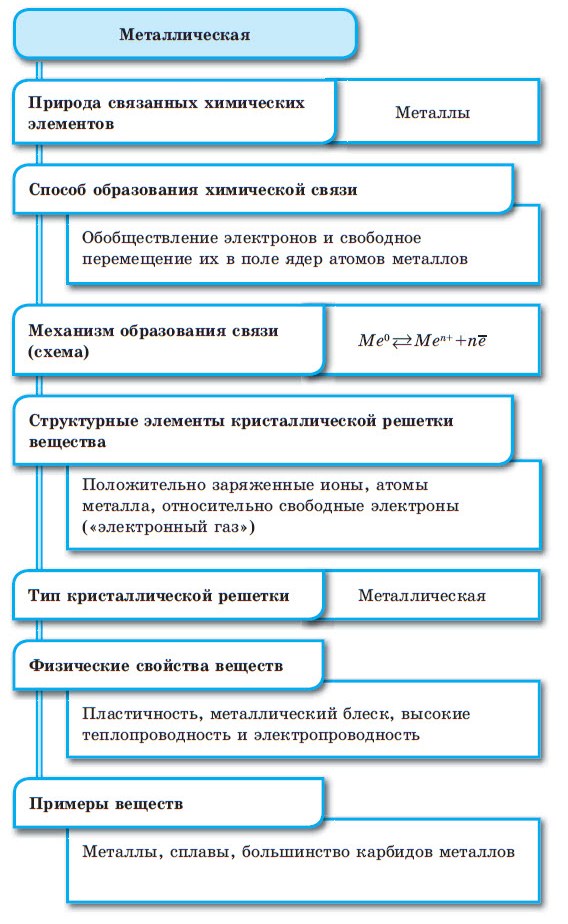

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Читайте также:
