Образование металлов в природе
Обновлено: 16.05.2024
Цели: познакомить учащихся с распространением металлических элементов и их соединений в природе; охарактеризовать основные способы получение металлов; продолжить у учащихся умение составлять уравнения УВР.
I. Организационный момент
Приветствие, настрой на активную работу.
II. Проверка д/з. Актуализация опорных знаний.
Проходит в виде беседы.
1. Какие вещества называются металлами?
2. Раскройте особенности строения атомов металла и природу химической связи между ними в соединении.
3. Почему металлы имеют такие свойства, как ковкость и пластичность?
III. Изучение нового материала
1. Нахождение металлов в природе
В земной коре содержатся такие металлы: Al – 8,2%, Fe – 4,1%, Ca – 4,1%, Na – 2,3%, Mg - 2,3%, K – 2,1%, Ti – 0,56%.
В морской воде содержится большое количество Na (1,05%) и Mg (0,12%).
В природе встречаются металлы, как в свободном виде, так и в связанном.
- в свободном виде: золото, серебро, платина, медь, ртуть.
- в виде оксидов: магнетит - Fe 3 O 4, гематит - Fe 2 O 3
- в виде смешанных оксидов: каомин Al 2 O 3 *2 SiO 2 *2 H 2 O
- в виде разных солей: сильвин - KCl , сильвинит - KCl * NaCl , барит - BaSO 4 , мрамор - CaCO 3, апатит - Ca 3 ( PO 4)2
2. Общие способы получения металлов
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для их получения в виде простого вещества, необходимо провести процесс восстановления.
Но прежде, чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для восстановления. Например, оксидную форму.
На этом основан пирометаллургический способ.
Пирометаллургический способ – это восстановление металлов из их руд при высоких температурах.
1) Водородотермия – получение меди с оксида с помощью водорода:
2) Алюмотермия – получение железа с оксида при помощи алюминия:
Гидрометаллургический способ основан на растворении природного вещества с целью получения соли этого металла и вытеснения этого металла более активным. Этим способом получают серебро, золото, цинк и др.
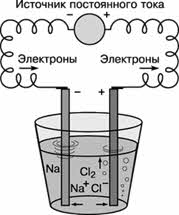
Электрометаллургический способ – это способ получения металлов с помощью электрического тока (электролиз). Этим способом получают алюминий, щелочные и щелочноземельные металлы.
K(-): Na + +1ē →Na 0 │2
A(+): 2Cl - 2ē → Cl 0 2 │1
Общее уравнение: 2 NaCl = 2 Na + Cl 2
IV. Закрепление полученных знаний
1. Расставьте коэффициенты методом электронного баланса
2. В раствор хлорида меди (11) поместили цинковую пластинку. В реакцию вступил цинк массой 26 г. Вычислите, сколько грамм меди осело на пластинку.
V. Домашнее задание
VI. Подведение итогов урока. Рефлексия.
Учитель предлагает учащимся внимательно прочитать слова, приготовленные на доске (раздражительность, злость, безразличие, удовольствие, вдохновение, скука, тревожность, спокойствие, уверенность, наслаждение), и выбрать из них три слова, которые более точно передают их состояние на этом уроке.
Как возникли залежи металлических руд? Попробуем разобраться…
Земля, как известно, образовалась более 4,5 миллиардов лет назад из частиц пыли и газа, оставшихся после формирования Солнца. Значит, теоретически в новорожденной Земле все составляющие ее химические элементы должны были распределиться равномерно (ну разве что более тяжелые из них стремились занять место поближе к центру). Но ведь сегодня металлы выплавляют из руды — горной породы, в которой этих металлов содержится больше, чем в прочих минералах, а руда, в свою очередь, встречается в природных скоплениях, называемых месторождениями. Получается, что от первоначальной равномерности не осталось и следа!

В самом деле, представь, что никаких месторождений нет и все элементы таблицы Менделеева рассеяны по земной коре. В этом случае в одной тонне горной породы содержалось бы примерно 80 кг алюминия и 50 кг железа, а такого незаменимого для человека металла, как медь, нашлось бы всего 50 граммов. Олова и того меньше — около двух граммов. Про драгоценные металлы и говорить не стоит — в тонне породы мы смогли бы найти лишь их сотые и тысячные доли грамма. Представляешь, насколько сложно было бы добывать металлы из такой породы? А самое главное, вряд ли наши предки вообще догадались о существовании металлов, и значит, мы так бы и жили в каменном веке!
Какие же процессы вызывают концентрацию металлов в определенных местах земной коры? Их довольно много, и тем не менее, их можно разделить на две большие группы: одни обусловлены подземным теплом, другие — солнечным излучением.
Благодаря подземному жару в недрах Земли существует расплавленная магма и происходит нагрев глубинных вод. Но оказавшись у поверхности, они, разумеется, начинают остывать. В результате застывания магмы образуются так называемые магматические породы — из них и состоит большая часть земной коры. Однако для образования месторождения необходимо, чтобы минерал с высоким содержанием того или иного металла отделился от остальной породы. Это может произойти, если температура плавления этого минерала выше, чем температура плавления основной породы. В этом случае он кристаллизуется раньше, чем застынет остальная магма, и «потонет», погружаясь на дно магматической камеры. Так часто образуются месторождения хромовых руд и платины. Или, наоборот, если рудообразующий минерал более легкоплавкий, то он будет застывать, когда вся остальная магма уже затвердела, и заполнит трещины между массивами основной породы. Этот способ характерен, например для образования месторождений титановых руд. Наконец, в некоторых случаях жидкая магма может разделяться на две несмешивающиеся составляющие (подобно тому, как молоко разделяется на сливки и обезжиренную сыворотку), которые затем кристаллизуются по отдельности. Такой тип концентрации руды встречается редко, но по нему образовались некоторые очень крупные месторождения медно-никелевых руд, например в Норильске.
Теперь поговорим о роли воды. Образовавшаяся вблизи поверхности, она, под действием силы тяжести, постепенно просачивается по трещинам в горных породах всё глубже и глубже. А так как чем ближе к центру Земли, тем выше температура, вода начинает постепенно нагреваться. При этом в процессе своего путешествия по глубинам земли вода растворяет много разнообразных веществ.
Из-за того, что горячая вода имеет меньшую плотность, чем холодная, в определенный момент глубинные воды начинают подниматься обратно к поверхности — и, соответственно, остывать.
С потерей температуры падает и растворимость минералов в воде, и они начинают осаждаться, то есть скапливаться в виде твердых частиц. Казалось бы — ну сколько нужных минералов способна накопить просочившаяся в глубь Земли вода? Однако образованные таким способом месторождения, называемые гидротермальными, широко распространены. Так появилось большинство месторождений свинцово-цинковых, ртутных, урановых руд, а также почти все золотоносные жилы.
Ну а если порода уже оказалась вблизи поверхности Земли и на подземное тепло рассчитывать не приходится? В таком случае месторождения могут сформироваться благодаря различным механическим и химическим процессам, источником энергии для которых является солнечный свет. Выделяют четыре вида таких процессов.
Во-первых, вода, просачиваясь от поверхности под землю, растворяет различные вещества, которые могут выпасть в осадок при резком изменении физических или химических условий. Так образовались многие месторождения руд урана, меди и серебра.
Во-вторых, месторождения могут образовываться и за счет того, что вода выносит из приповерхностных слоев хорошо растворимые соединения, которые постепенно накапливаются: таким способом появились все самые крупные месторождения алюминиевых руд.
В-третьих, накоплению определенных минералов могут способствовать не только подземные, но и поверхностные воды. В местах, где скорость течения воды резко падает, например при уменьшении уклона реки, наиболее тяжелые фракции транспортируемых ею частиц откладываются на дно. Так образовались, например золотые россыпи, послужившие причиной золотой лихорадки в Калифорнии, на Аляске, в Сибири.
В-четвертых, образование месторождений может происходить в результате накопления осадка в водоемах.
Например миллиарды лет назад в атмосфере Земли почти не было кислорода, но зато в водах океана содержалось много растворенного железа. Потом, в результате деятельности появившихся сине-зеленых водорослей, атмосфера начала насыщаться кислородом, который растворялся в воде и вступал в химическую реакцию с находящимся там железом. Затем продукт этой реакции опускался на дно и накапливался там — именно так и произошли крупнейшие месторождения железных руд.
МЕТАЛЛОЛОМ И ЭКОЛОГИЯ
Как видишь, появление на Земле залежей полезных руд происходило разными способами, за миллионы лет. А вот иссякают месторождения гораздо быстрее — современные методы добычи опустошают рудник за десятки лет, а то и за годы. Если ничего не изменится, запасы металлических руд на Земле быстро закончатся. Поэтому сейчас важным источником металлов становится вторичное сырье. Из металлолома производится более трети стали и алюминия, более 20% меди. Кроме экономии металла, переработка металлолома позволяет уменьшить использование энергии и серьезно сократить экологическую нагрузку на окружающую среду.
Как образуются металлы

У вас есть кольцо на пальце? Из чего оно сделано: золота, серебра, платины или какого-либо другого металла? Тогда задумайтесь вот над чем: металл, из которого сделано кольцо на вашем пальце, старше планеты, где вы живёте.
Что такое «металл»?
С научной точки зрения, металлы представляют собой природные химические элементы, которые обычно являются твёрдыми и блестящими; кроме того, их считают хорошими проводниками тепла и электричества. К ним относятся железо, золото, серебро, медь, цинк, никель и прочее, а также элементы, которые мы не привыкли относить к металлам. В качестве примера можно привести натрий – металл, который мы регулярно употребляем в пищу. Натрий – это мягкий, серебристо-белый металл, который обычно соединяется с элементом хлор, образуя хлорид натрия, или, попросту говоря, поваренную соль.
Другой пример – астат, который был искусственно создан в лабораторных условиях в 1940 году. В природе его обнаружили лишь спустя три года. Астат является высокорадиоактивным. Как полагают, на Земле существует всего около 30 грамм этого металла. Из 118 химических элементов, известных нам, 88 являются металлами.
Настоящая алхимия
Итак, как же появились все эти металлы? Вот очень упрощённое объяснение:
Все элементы, включая металлы, сделаны из одного и того же: атомного материала – электронов, нейтронов и протонов. Атомы различных элементов можно отличить друг от друга по количеству протонов, которые они содержат. (Количество нейтронов и электронов может варьироваться даже среди атомов одного и того же элемента.) Например, атом водорода содержит всего один протон, атом железа – 79. Это также является верным для каждого из бесчисленных атомов водорода и золота во Вселенной.
Если бы вы нашли способ превратить 79 атомов водорода в один, вы бы получили атом с 79 протонами, то есть атом золота. Именно это и происходит… правда, не на Земле, а внутри звёзд.
Золото в звёздах
Примерно 13,7 миллиарда лет назад впервые появилась материя в виде атомов двух самых лёгких элементов: водорода с одним протоном и гелия с двумя. Они, безусловно, остаются самыми распространёнными элементами во Вселенной.
Спустя много миллионов лет те первые атомы водорода и гелия образовали облака пыли и газов, причём настолько большие, что их можно было бы измерить в световых годах (1 световой год = 9,5 триллионов километров). Облака в итоге поддались собственной огромной гравитации и рассеялись, образовав первые звёзды. Звёзды стали разрушителями атомов – достаточно горячими, чтобы разбить атомы водорода и гелия на мелкие частички и впоследствии образовать из них крупные атомы более тяжёлых элементов.
Например, если вы соедините два атома водорода, вы получите атом с двумя протонами – или гелий. Соедините три атома водорода вместе – и вы получите атом с тремя протонами – литий, первый и самый лёгкий металл. Соедините три атома гелия – и у вас получится атом с шестью протонами – углерод. Это тот процесс, который происходит во всех звёздах, которые вы видите в небе ночью. В массивных звёздах процесс может привести к образованию более тяжёлых элементов, включая такие металлы, как титан (22 протона) и железо (26 протонов). Если звёзды являются сверхмассивными, они способны образовывать самые тяжёлые металлы, такие как золото (79 протонов) и уран (92 протона). Это одна из функций, которые выполняют звёзды, и объяснение того, как образуются в природе все элементы, включая блестящие металлы.
А теперь давайте рассмотрим, каким образом они оказались на Земле.
В первые несколько миллиардов лет после Большого Взрыва родились миллионы звёзд – в результате процесса, который мы только что описали. Некоторые из них были сверхмассивными – в сотни раз больше Солнца. Массивные звёзды живут относительно мало – всего несколько миллионов лет (маленькие звёзды способны жить миллиарды лет) в лучшем случае – после чего умирают в результате взрыва и становятся сверхновыми.
Когда эти массивные звёзды взрывались миллиарды лет назад, они выбрасывали в космос тяжёлые элементы, которые им удалось образовать. Они, скажем так, «усеяли» Вселенную элементами, включая металлы, в непостижимом количестве – триллионы, триллионы и триллионы мегатонн. Это означает, что когда позднее образовывались новые звёзды, они уже были «усеяны» металлами, оставленными сверхновыми.
Одной из таких более поздних звёзд, богатых металлами, было наше Солнце. Давайте вкратце рассмотрим историю его возникновения:
Примерно 4,5 миллиардов лет назад массивное космическое облако пыли и газа, усеянное множеством тяжёлых элементов, рассеялось, запустив процесс формирования новой звезды.
Большая часть водорода и гелия в облаке превратилась в звезду. Оставшееся количество пыли и газа, включая металлы, накопилось в раскалённой массе, вращающейся вокруг новой звезды. Вращающееся движение расплющило массу (как тесто для пиццы), превратив её в раскалённый вращающийся диск.
В течение миллионов лет диск постепенно охлаждался, и его части слипались между собой то тут, то там, образуя комки. Эти комки впоследствии стали планетами нашей солнечной системы. А что случилось с металлами в пыли? Они стали всеми теми металлами, обнаруженными на всех планетах, включая нашу.
На Земле есть много металла. Почти треть массы нашей планеты составляет элемент железо, наибольшая его часть сосредоточена в ядре. Другие 14 процентов – это магний, 1,5 процента – никель и 1,4 процента – алюминий. Это 49 процентов планеты. Остальные металлы Земли, включая «драгоценные», такие как золото, серебро, платина и палладий, существуют в незначительных количествах. Остальная часть (не металлы) – это около 30 процентов кислорода и 15 процентов кремния, наряду с другими неметаллическими элементами.
Смотри, как блестит!
На протяжении, по меньшей мере, нескольких миллионов лет люди и их предки использовали инструменты, созданные из таких материалов, как дерево, кость и камень, чтобы облегчить себе жизнь. Однако им это не особо удавалось: Homo sapiens оставались относительно примитивными кочевыми охотниками и собирателями практически всё своё существование. Затем, около 10 тысяч лет назад, они начали работать с «новым» материалом: металлом.
Первые металлы, которые начали использовать люди, были те, с которыми было легче всего работать. Это самородные металлы – металлы, которые встречаются в природе в чистом виде или были естественным путём смешаны с другими элементам, сохранив при этом все свои свойства. Они включают медь, олово, свинец, серебро и золото.
Люди, возможно, находили самородки этих металлов в ручье или среди корней выкопанного дерева. Затем они придавали им форму при помощи каменных молотков. Это привело к появлению ювелирных изделий и украшений, а также металлических инструментов и оружия вроде топоров, ножей и мечей (это была усовершенствованная замена старым каменным инструментам). Всё это, в конечном счёте, привело к тому, что люди стали активно искать металлы, создавать шахты, вести торговлю между разными народами и развивать металлообрабатывающую промышленность.
Металлургия
Примерно 8000 лет назад люди начали понимать, что они могут изменять металлы. Возможно, они обнаружили это случайным образом, а, возможно, это был порыв творчества – или и то, и другое. В любом случае, были разработаны новые процессы с целью создания новых металлов, которых не существовало в природе вообще. В течение последующих нескольких тысяч лет добыча и обработка металлов стали неотъемлемой частью большинства культур на Земле, а металл превратился в одно из веществ, изменивших историю человечества. Каждый из этих новых процессов включал огонь, и вполне возможно, что эксперименты с ним непосредственно привели к следующим важнейшим достижениям:
1) Отжиг. Это процесс нагрева металла до тех пор, пока он не станет вишнёво-красного цвета. Он позволяет вернуть старому хрупкому металлу первоначальное податливое состояние, а также переработать его и продлить срок службы. Отжиг может производиться при относительно низких температурах (медь можно обжечь на костре). Этот процесс впервые был использован примерно в 6000 году до нашей эры где-то на Ближнем Востоке и, возможно, приблизительно в то же время в Европе и Индии.
2) Плавка. В ходе этого процесса металлы переходят в жидкое состояние, что предоставляет возможность придавать им различные формы. Впервые металлы подверглись плавке примерно в 5000 году до нашей эры, после появления передовых керамических печей, которые могли давать более высокие температуры, чем открытый огонь.
3) Производство сплавов. Это процесс смешивания различных металлов, пока они пребывают в расплавленном состоянии. Он появился примерно в 3300 году до нашей эры (начало бронзового века). Первым сплавом была бронза – смесь меди и олова, которая гораздо прочнее, чем её компоненты, взятые по отдельности.
4) Извлечение металла из руд. С дальнейшим усовершенствованием обжиговых печей и способов достижения более высоких температур были разработаны методы, позволявшие извлекать металлы из руды. Впервые это было сделано с железом на Ближнем Востоке примерно в 1500 году до нашей эры, что стало началом железного века.
5) Плавка, производство сплавов и извлечение металла из руд практиковались древними людьми в Европе, Азии, Южной Америке и Мексике, однако в Австралии и остальной части Северной Америки они стали доступными лишь после прихода европейцев. Эти простые процессы по-прежнему являются основой того, что, пожалуй, стало крупнейшей и наиболее успешной индустрией в истории человечества: металлообрабатывающей промышленностью.

Железо – это самый распространённый металл на Земле. Но, как и в случае большинства металлов, его добыча является сложным процессом, поскольку в природе он очень редко встречается в чистом виде. Как правило, его получают из железной руды, которую очищают от кислорода и примесей. Вот наиболее распространённый процесс, используемый сегодня:
Подготовка: после добычи железная руда измельчается в порошок. Для того чтобы отделить руду, богатую железом, используются огромные магнитные барабаны. (Богатая железом руда прилипает к барабанам; остальное отваливается.) Богатый железом порошок смешивается с глиной и превращается в небольшие шарики, которые затем подвергаются термической закалке. Это позволяет намного эффективнее протекать следующему процессу – плавке.
Плавка: шарики плавятся в печи вместе с коксом – углём, который был переработан в почти в чистый углерод – и известняком. Интенсивный нагрев разрушает железо-кислородные связи в руде, высвобождая кислород, который соединяется с углеродом, образующимся в результате сгорания кокса, и превращается в СО2 (углекислый газ). СО2 выходит из верхней части печи, а железо, которое теперь свободно от кислорода, плавится (при температуре, равной примерно 1540 градусам Цельсия) и собирается на дне печи. Известняк также плавится и соединяется с примесями, образуя отходы, известные как шлак. Шлак легче железа, и его постоянно удаляют из верхней части печи.
Результат: продуктом данного процесса является чугун. Он имеет относительно высокое содержание углерода – около 5 процентов, что делает его очень хрупким и, следовательно, почти бесполезным, за исключением того, что его можно использовать для производства других сплавов железа, в особенности стали.

Сегодня около 98 процентов чугуна, произведённого во всём мире, идёт на производство стали, наиболее широко используемого металла или сплава металла в истории. Процесс начинается с заливки расплавленного чугуна в сталеплавильные печи, где он обрабатывается для удаления оставшихся примесей и снижения уровня содержания углерода до 0,1-0,2 процента. Это одна из главных характеристик стали, которая помогает снизить хрупкость, увеличивая прочность и твёрдость. В зависимости от типа производимой стали, в смесь могут добавляться различные элементы. Рассмотрим два примера:
1) Марганцевая сталь, или сталь Гадфильда, содержит около 13 процентов марганца, благодаря чему она обладает чрезвычайной прочностью. Её используют при производстве горнодобывающих инструментов, оборудования для дробления пород и защиты военной техники.
2) Нержавеющая сталь. На самом деле это название для широкого спектра сталей, однако все они имеют один общий элемент в составе: хром (от 10 до 30 процентов, в зависимости от типа). Хром на поверхности нержавеющей стали соединяется с кислородом в воздухе и формирует слой оксида хрома, который придаёт нержавеющей стали блестящий вид и делает её устойчивой к коррозии. И если она каким-то образом повредится или поцарапается, хром повторно соединится с кислородом и сформирует новый слой, то есть получается, что нержавеющая сталь является самовосстанавливающейся.
Нержавеющая сталь используется при производстве широкого спектра продуктов, начиная от кухонной утвари и заканчивая хирургическим оборудованием и уличными скульптурами. (Она также является на 100% пригодной для переработки.)

Наиболее распространённой рудой, используемой для производства алюминия, является боксит, вещество, которое содержит около 50 процентов окиси алюминия. Как и в случае с железом, чтобы получить алюминий, нужно отделить руду от кислорода и минералов. Этот процесс гораздо сложнее, чем добыча железа, и он был разработан лишь в конце 1800-х годов. (Алюминий был признан уникальным элементом лишь в 1808 году.) Первая часть системы, наиболее часто используемой сегодня, называется процессом Байера, названным в честь австрийского химика Карла Байера, который изобрёл его в 1877 году.
Процесс Байера: боксит добывают и измельчают, после чего смешивают с водой и щёлоком и нагревают в резервуарах. Нагрев и щёлок предназначены для того, чтобы растворить алюминий из руды в воде. Между тем, сами примеси опускаются на дно. Вода, обогащённая алюминием, впоследствии откачивается и фильтруется с целью удаления оставшихся примесей. После этого её закачивают в огромные отстойники. Белый кристаллический порошок, получаемый после отстаивания, состоит из 99 процентов окиси алюминия. Кристаллы промывают и дают им высохнуть.
Следующий шаг известен как процесс Холла-Эру, названный в честь двух химиков, которые разработали его – независимо друг от друга – в 1886 году. В ходе этого процесса кристаллы окиси алюминия (наряду с минералами, способствующими распаду окиси алюминия) плавятся при температуре, равной 960 градусам, в стальных чанах. Однако этого недостаточно для того, чтобы разрушить алюминиево-кислородные связи в окиси алюминия; они гораздо сильнее железо-кислородных связей. Таким образом, мощный электрический ток пропускается через расплавленный материал – и это приводит к разрыву связей. Кислород высвобождается и притягивается к углеродным стержням, подвешенным над расплавленной смесью. Он соединяется с углеродом и образует CO2. Освободившийся алюминий плавится и собирается на дне чана. Это на 99,8 процента чистый алюминий.
Алюминий используется как в чистой форме (алюминиевая фольга сделана практически из чистого алюминия), так и в различных сплавах с кремнием, медью и цинком. Некоторые из них прочнее и легче стали. Из алюминия производят кухонную посуду, консервные банки и блок цилиндров (двигателя).

Платина представляет собой блестящий серебристо-белый металл, который является очень редким и обладает уникальными свойствами: это один из самых плотных металлов, однако он является очень ковким и устойчивым к коррозии (температура, ржавчина, кислоты). Он имеет температуру плавления, равную 1779 градусам Цельсия (золото плавится при температуре 1064 градуса Цельсия, а железо – при 1535 градусах Цельсия). Платина существует в чистом виде в природе, однако чаще всего она встречается в смеси с другими элементами, включая кислород, медь и никель. Более 90 процентов платины сегодня добывается всего в четырёх местах: три из них находятся в России, и одно – в Южной Африке.
Производство довольно сложное.
Чтобы получить одну унцию (28,3 грамма) платины, нужно добыть и переработать десять тонн руды. Процесс производства платины выглядит следующим образом:
Руду добывают, измельчают в порошок и смешивают с водой и химикатами. Затем смесь продувают воздухом, образующим пузыри – к ним впоследствии прилипают крошечные платиновые частицы. Пузыри поднимаются на поверхность резервуара, создавая пену. Эту пену собирают, высушивают и плавят при температуре 1482 градуса Цельсия. Более тяжёлые частицы – металлы – опускаются на дно печи. Более лёгкие примеси собираются на поверхности расплавленного металла и удаляются. Впоследствии используются сложные химические процессы, в результате которых платина отделяется от меди, никеля и прочих металлов до тех пор, пока она не станет абсолютно чистой.
Интересные факты, связанные с металлами и металлообрабатывающей промышленностью
• Железную руду переплавляют в доменной печи: нагретый до температуры 1204 градуса Цельсия воздух «вдувается» в печь, заставляя её гореть ещё сильнее, чем обычно. Типичная доменная печь на сталелитейном заводе работает 24 часа в сутки, 365 дней в году. Срок её службы при таких условиях составляет 20 лет.
• Чистая сталь подвержена коррозии. Оцинкованная сталь – это сталь, покрытая цинком, который обладает устойчивостью к коррозии.
• Основной химический элемент в рубинах, изумрудах и сапфирах – алюминий.
• Для чего в основном используется чрезвычайно редкий металл платина? Для производства каталитических преобразователей – устройств на автомобилях, которые используются для очистки выхлопных газов. Платина – исключительно хороший катализатор: она помогает преобразовывать токсичные газы, такие как окись углерода, в нетоксичные.
• Это миф, что коренные индейцы не занимались металлообработкой. На самом деле у многих племён имелись давние традиции по обработке меди, особенно у тех, которые жили вблизи Великих озёр, где металл был в изобилии.
• Платина, добытая за всю историю существования человечества, могла бы уместиться в подвале обычного дома.
Copyright Muz4in.Net © - Данная новость принадлежит Muz4in.Net, и являются интеллектуальной собственностью блога, охраняется законом об авторском праве и не может быть использована где-либо без активной ссылки на источник. Подробнее читать - "об Авторстве"
Вам понравилась статья? Просто перейди по рекламе после статьи. Там ты найдешь то, что ты искал, а нам бонус.
"Металлы в природе. Общие способы получения металлов"

Презентация предназначена для учащихся 9 класса, ее можно использовать при изучение темы "Металлы", а так же при подготовке к ОГЭ. В презентации рассматривается вопрос о нахождении металлов в природе и общих способах получения металлов - прирометаллургии, гидрометаллургии, электрометаллургии и микробиологической способе.
Содержимое разработки

Металлы в природе.
Общие способы получения металлов.
Презентация к уроку. 9 класс .Химия. Антонова Ирина Павловна . Учитель химии и биологии МБОУ СОШ№8

ЦЕЛЬ УРОКА :
- Познакомиться с природными соединениями металлов и с самородными металлами; получить понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов, продемонстрировать лабораторные способы получения металлов и ознакомиться с промышленным производством металлов.
РАСПРОСТРАНЕННОСТЬ МЕТАЛЛОВ В ПРИРОДЕ
Процентное содержание металлов в морской воде:
В ПРИРОДЕ МЕТАЛЛЫ МОГУТ ВСТРЕЧАТЬСЯ
Железный метеорит




KCl • MgCl 2 • 6H 2 O


СУЛЬФАТЫ, ФОСФАТЫ, КАРБОНАТЫ

Черная- получение
железа и его
сплавов (сталь, чугун)
Цветная- получение
остальных металлов
и их сплавов

- Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO 3 = CuO + CO 2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО 2 = 2ZnО + 2SО 2

Пирометаллургия
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO 2
Водородотермия:
Cr 2 O 3 + H 2 → Cr + H 2 O
Металлотермия:
Fe 2 O 3 + Al → Fe + Al 2 O 3

- Получение металлов израстворових солей.
- Перевод нерастворимого соединения в раствор:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuSO 4 + Fe = FeSO 4 + Cu.
2NaCl → 2Na + Cl 2
MgBr 2 → Mg + Br 2
- Микробиологические методы получения металлов.

-82%
Металлы в природе. Способы получения металлов
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы в природе. Способы получения металлов"
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».

За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.

Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑

Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Читайте также:
