Образование оксидной пленки на металлах
Обновлено: 25.04.2024
Газовой коррозией называется процесс разрушения материалов в газовых средах при высоких температурах в отсутствии влаги. Газовая коррозия материалов — наиболее распространенный случай химической коррозии. Газовой коррозии подвергаются металлические конструкции, работающие в условиях воздействия агрессивных газов при высоких температурах (арматура печей, детали двигателей внутреннего сгорания, детали газовых турбин и др.). Такие технологические процессы обработки металлов как горячая прокатка, ковка и штамповка, термическая обработка, связанные с нагревом до высоких температур, также вызывают газовую коррозию.
3.1.1 Образование оксидных соединений на поверхности металла
Самой распространенной газовой средой является воздух, окисляющим компонентом которого является кислород. Кинетика образования оксидных соединений на поверхности металла показана на рисунке 9.
Рисунок 9 — Схема газовой коррозии
В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для дальнейшего продолжения коррозии необходимо, чтобы либо ионы металла, либо кислород среды, или они одновременно диффундировали через образовавшуюся оксидную пленку.
Из металлической фазы в оксид переходят ионы металла Ме n + и электроны е - . С поверхности раздела оксид—газ в глубь пленки перемещаются атомы кислорода, которые в пленке ионизируются
(O+2e →O 2- ) и, встречаясь с ионами металла, образуют оксиды:
Me 2+ + 1/2O2 2- ↔ MeO
Судить о стойкости металла по отношению к газовой коррозии можно визуально по появлению оксидной пленки, цветов побежалости или окалины, учитывая продолжительность коррозии и температуру.
Термодинамическая возможность процесса газовой коррозии с образованием окисной пленки определяется величиной изменения свободной энергии системы. Существует удобная форма определения термодинамической возможности протекания коррозии за счет окисления металла, которая сводится к сравнению упругости диссоциации полученного продукта реакции окисления с парциальным давлением кислорода в газовой фазе.
Если парциальное давление кислорода Ро2 и упругость диссоциации окисла Рмео равны, то реакция будет находиться в равновесии. Если Ро2 > Рмео, то реакция протекает в сторону образования окисла. Если Ро2 < Рмео, то окисел самопроизвольно диссоциирует на кислород и металл. Поэтому сравнение упругости диссоциации данного окисла при данной температуре, например, с парциальным давлением кислорода воздуха позволяет найти границу термодинамической вероятности процесса окисления металла на воздухе.
3.1.2 Условия образования, защитных оксидных пленок
Защитными свойствами могут обладать только оксидные пленки, покрывающие сплошным слоем всю поверхность металла. Условия образования сплошной оксидной пленки были открыты и сформулированы Пиллингом и Бедвортсом. Они зависят от соотношения между объемами продуктов коррозии VОК и металла VМ, из которого они образовались: при VОК/VМ >1 образуется сплошная пленка; при VОК/VМ1 пленка не сплошная.
В таблице 3 приведены значения соотношений объемов оксида и металла для некоторых элементов.
Оксиды щелочных и щелочно-земельных металлов, имеют пористую пленку и не обладают защитными свойствами. Установлено, что достаточно хорошими защитными свойствами обладают пленки на металлах при соблюдении условия: 2,5>VОК/VМ >1.
Образование сплошной оксидной пленки на поверхности металла является необходимым, но не достаточным условием защиты металла от последующей коррозии. Прежде всего пленка должна быть беспористой, не должна разрушаться в агрессивной среде, должна иметь хорошее сцепление с металлом и коэффициенты теплового расширения пленки и металла должны быть достаточно близки. Важным условием является и необходимость ориентационного соответствия образующейся пленки к металлу, т.е. максимальное сходство кристаллических решеток металла и окисла.
Таблица 3 — Соотношения объемов оксида и металла
На сохранность защитных пленок на металлах влияет целый ряд взаимосвязанных факторов, важнейшими из которых являются:
1. Внутренние напряжения, возникающие при росте защитной пленки. Вследствие того, что VОК>VМ возникают силы, сжимающие пленку параллельно поверхности металла, и одновременно — силы, стремящиеся оторвать пленку от металла. Чем толще пленка, тем больше будет величина внутренних напряжений. При определенных значениях напряжения в пленке появляются трещины и происходит отслаивание пленки от металла.
2. Силы сцепления пленки с металлом (адгезия). Чем больше будут силы сцепления между защитной пленкой и металлом, тем труднее будет внутренним напряжением оторвать пленку от металла и тем меньше вероятность отслаивания пленки.
3. Механические свойства пленки. Наиболее важными механическими характеристиками являются прочность и пластичность пленки при заданной температуре.
4. Разность в коэффициентах термического расширении (КТР) металла и защитной пленки. Чем больше скорость изменения температуры (нагрев или охлаждение) и чем больше разница в КТР металла и защитной пленки, тем больше внутренние напряжения, которые могут привести к разрушению пленки.
На рисунке 10 показаны основные виды разрушения пленки: а — образование пузырей в случаях, когда прочность пленки на разрыв велика, а силы сцепления пленки с металлом малы; б — образование пузырей с разрывом при недостаточной прочности пленки (что делает пленку газопроницаемой), под пузырем образуется новая оксидная пленка; в—микропузыри в пленке без ее разрывов не представляют опасности, поскольку поры замкнуты; г — разрушение пленки с отслаиванием, вызванным температурными напряжениями; д — растрескивание со сдвигом характерно для пленок, обладающих хорошим сцеплением с металлом и сравнительно малой прочностью; е — растрескивание на углах и крутых изгибах как результат концентрации напряжений.
Наибольшей сохранностью и высокими защитными свойствами обладает сплошная, устойчивая в агрессивной среде, прочная и эластичная пленка, имеющая хорошее сцепление с металлом и одинаковый с металлом КТР.

Рисунок 10 — Основные виды разрушения пленки
При этом пленка должна иметь некоторую оптимальную толщину, чтобы быть прочной и в достаточной степени тормозить встречную диффузию молекул агрессивного агента среды и ионов металла.
Пленки на металлах
У большинства металлов при взаимодействии с окислителями поверхность покрывается пленкой окислов.
Адсорбция окислителя на металле
Когда металл попадает в коррозионную среду, начальной стадией их взаимодействия является адсорбция окислителей (CO2, H2O, O2, Cl2, SO2) на поверхности металла. Между атомами металла и окислителем сразу возникает сильная ионная связь – атом металла передает атому кислорода два электрона. Атом кислорода находится под воздействием поля, которое создают атомы металла. На поверхности металла адсорбируется окислитель, при этом внутренняя поверхность образовавшейся адсорбционной пленки заряжена положительно, а внешняя – отрицательно.
Распределение атомов окислителя на поверхности металла очень сильно зависит от расположения на поверхности атомов металла.
Поверхность металла заполняется хемосорбированным окислителем почти мгновенно и образуется тонкий слой окисляющего вещества. При пониженных температурах после хемосорбированного окислителя за счет ванн-дер-ваальсовых сил может возникнуть и физическая адсорбция молекул окислителя.
Образование продуктов коррозии
Если между металлом и окислителем есть химическое сродство (окисел термодинамически стабильный), то пленка, состоящая с хемосорбированного окислителя, превращается в окисную пленку. Металл и окислитель в окисной пленке поддерживают ионную связь.
Продукты коррозии – химические соединения, которые образовались в результате химического взаимодействия металла и некоторых компонентов окружающей среды. Продукты коррозии формируют на поверхности металла пленку, которая может обладать защитными свойствами, затрудняя подход окислителей. Данный процесс протекает с самоторможением во времени.
Пленки продуктов коррозии очень сильно влияют на жаростойкость металлов, поэтому необходимо изучить их свойства, закономерности роста и влияние на них различных внешних и внутренних факторов.
Классификация по толщине пленок на металлах
По толщине оксидной пленки на металлах их принято разделять на три группы: толстые, тонкие, средние.
Тонкие оксидные пленки невидимы для человека невооруженным глазом. Их толщина составляет до 400 Å.
Средние оксидные пленки в толщину достигают от 400 до 5000 Å и дают цвета побежалости.
Толстые оксидные пленки хорошо видны на поверхности металла. Их толщина составляет свыше 5000 Å. Иногда они могут быть достаточно толстыми, как, например, окалина на поверхности стали.
От защитных свойств оксидных пленок зависит жаростойкость металла, законы роста толщины пленки во времени и многое другое.
При образовании окисной пленки устанавливается скорость окисления металла, которая может изменяться во времени. По этому судят о защитных свойствах окисных слоев. Также защитные свойства оксидной пленки определяют в лабораторных условиях капельным методом. На ее поверхность наносят подходящий для данного случая реагент и определяют время его проникновения к основному металлу.
Оксидирование
Оксидирование – процесс формирования оксидных пленок на поверхности металла. Оксидирование применяется для нанесения оксидных слоев, как в целях защиты, так и для придания металлическому изделию декоративных свойств.
Оксидирование металла можно проводить несколькими способами:
- анодное оксидирование (электрохимическое);
- пламенные методы (микродуговое оксидирование и др.).
Химическое оксидирование
Химическое оксидирование осуществляют обработкой изделия в растворах (расплавах) окислителей (хроматы, нитраты и др.). С помощью данного метода поверхность изделия пассивируют либо нанося защитные и декоративные слои. Для черных металлов химическое оксидирование проводится при температуре от 30 до 100 °С в щелочных либо кислотных составах. Для кислотного оксидирования используют, в основном, смесь нескольких кислот, например, азотная (или ортофосфорная) и соляная кислоты с некоторыми добавками (Ca(NO3)2, соединения Mn). Щелочное оксидирование проводится при температурах немного выше, около 30 – 180 °С. В состав вводят окислители. После нанесения оксидного слоя металлические изделия хорошо промываются и сушатся. Иногда готовое покрытие промасливают или дополнительно обрабатывают в окислительных растворах.
Защитные слои, полученные с применением химического оксидирования, обладают менее защитными свойствами, чем пленки, полученные анодированием.
Термическое оксидирование
Термическое оксидирование – процесс образования оксидной пленки на металле при повышенных температурах и в кислородсодержащих (может быть водяной пар) атмосферах. Термическое оксидирование проводят в нагревательных печах. При термическом оксидировании низколегированных сталей либо железа (операция называется воронение) температуру поднимают до 300 – 350 °С. Для легированных сталей термическое оксидирование проводится при более высоких температурах ( до 700 °С). Продолжительность процесса – около 60 минут. Очень часто термическое оксидирование применяют для создания оксидного слоя на поверхности изделий из кремния. Такой процесс проводится при высоких температурах (800 – 1200 °С). Применяются оксидированные кремниевые изделия в электронике.
Анодирование (электрохимическое или анодное оксидирование)
Анодирование - один из способов получения оксидной пленки. Анодирование проводят в жидких либо твердых электролитах. При анодировании поверхность металла, который окисляется, имеет положительный потенциал. Анодирование применяют для получения защитных и декоративных слоев на поверхностях различных металлов и сплавов.
Анодирование наиболее часто применяют для получения покрытия на алюминии и его сплавах. На алюминии получают слои с защитными, изоляционными, износостойкими, декоративными свойствами.
Плазменные методы нанесения оксидных слоев
Плазменное оксидирование проводят при низких температурах в плазме, которая содержит кислород. Плазма для данного вида оксидирования образуется при помощи разрядов постоянного тока, СВЧ, ВЧ разрядов.
Плазменное оксидирование применяют для получения оксидных слоев на различных полупроводниковых соединениях, поверхности кремния. Плазменным оксидированием можно повысить светочувствительность секребряно-цезиевых фотокатодов.
Микродуговое оксидирование
Микродуговое оксидирование (МДО) – метод получения многофункциональных оксидных слоев. Микродуговое оксидирование – походная от анодирования. Позволяет наносить слои с высокими защитными, коррозионными, теплостойкими, изоляционными, декоративными свойствами. По внешнему виду покрытие, полученное микродуговым способом, очень напоминает керамику.
Сейчас это один из самых перспективных и востребованных способов нанесения оксидных слоев, т.к. позволяет наносить сверхпрочные покрытия с уникальными характеристиками.
Процесс микродугового оксидирования ведется, в большинстве случаев, в слабощелочных электролитах при подаче импульсного либо переменного тока. Перед нанесением покрытия не требуется особой подготовки поверхности. Особенностью процесса является то. Что используется энергия от электрических микроразрядов, которые хаотично передвигаются по обрабатываемой поверхности. Эти микроразряды оказывают на покрытие и электролит плазмохимическое и термическое воздействие. Оксидный слой приблизительно на 70 % формируется вглубь основного металла. Только 30 % покрытия находится полностью снаружи изделия.
Толщина покрытий, полученных микродуговым способом, составляет около 200 – 250 мкм (достаточно толстое). Температура электролита может колебаться от 15 до 400 °С, и это не оказывает на процесс особого влияния.
Применяемые электролиты не оказывают вредного влияния на окружающую среду и их срок службы очень долгий. Оборудование – компактное, не занимает много места и просто в эксплуатации.
Рассеивающая способность используемых электролитов высока, что позволяет получать покрытия даже на сложнорельефных деталях.
Микродуговое оксидирование применяется для формирования покрытий в основном на магниевых и алюминиевых сплавах.
Оксидирование алюминия и алюминиевых сплавов
Для эффективной защиты алюминия от коррозии наилучшим способом является создание на его поверхности оксидных слоев. Для этого применяют химическое, электрохимическое либо микродуговое оксидирование.
Анодирование (анодное оксидирование) алюминия
Покрытие может применяться как самостоятельная защита от атмосферной коррозии алюминия и его сплавов, или же, как основа под покраску. Оксидная пленка легок растворима в щелочах, но обладает достаточно высокой стойкостью в некоторым минеральным кислотам и воде.
Состав защитного слоя на алюминии: аморфный оксид алюминия, кристаллическая γ-модификация Al2O3.
Твердость оксидного слоя: на техническом алюминии - порядка 5000 – 6000 МПа, на сплавах алюминиевых от 2000 до 5000 МПа.
Слои, полученные методом оксидировании, отличаются хорошими электроизоляционными свойствами. Удельное электросопротивление составляет 1014 – 1015 Ом·м.
Анодированием можно получать на алюминии слои с различными заранее заданными свойствами. Можно получать твердые и мягкие защитные слои, безпористые, пористые, эластичные, хрупкие. Различные свойства получают при варьировании составом электролита и режимами электролиза.
При оксидировании алюминия в нейтральных или кислых электролитах (в большинстве растворов) поверхность алюминия почти моментально покрывается толстым слоем оксидов.
При электрохимическом оксидировании сначала образуется тонкий слой окислов, а потом кислород, проникает сквозь этот слой, упрочняя и утолщая его. Окисный слой достигает толщины около 0,01 – 0,1 мкм и прекращает свой рост. Этот слой называется барьерным. Для продолжения роста окислов необходимо увеличить напряжение на ванне.
Некоторые электролиты способны растворять оксид алюминия. Если электролит не растворяет оксидную пленку – она достигает толщины, отвечающей заданному напряжению. Это около 1 - 2 мкм. Такие пленки используются при производстве электрических конденсаторов, т.к. они не имеют пор, обладают хорошими электроизоляционными свойствами.
При использовании электролитов, способных растворять оксидный слой, утолщение пленки зависит от двух процессов, которые протекают на аноде:
- растворения пленки под воздействием электролита;
- электрохимического окисления металла у основания пор.
Если скорость окисления алюминия выше скорости растворения окислов, то происходит утолщение окисного слоя. В начале процесса оксидирования скорость окисления больше, скорости растворения, но с течением процесса увеличивается скорость растворения оксидов. Рост пленки прекращается, когда эти две скорости уравниваются.
Толщина оксидной пленки, полученной при анодировании алюминия, зависит от растворяющей способности электролита. А она, в свою очередь, определяется концентрацией кислоты, температурой и другими факторами.
Толщина оксидного покрытия зависит также от состава алюминия и его сплавов. Химически чистый алюминий легче анодировать, чем его сплавы. С увеличение в составе сплава различных добавок труднее получить пленки с хорошими характеристиками. На алюминиевых сплавах, содержащих марганец, медь, железо, магний, покрытие получается шероховатым, неровным. Это объясняется высокой скоростью растворения интерметаллических соединений, в виде которых эти металлы присутствуют в алюминиевом сплаве.
Оксидные пленки на алюминии, полученные методом анодирования, состоят из двух слоев: первый слой, на границе с металлом, беспористый барьерный в толщину от 0,01 до 0,1 мкм; второй слой пористый и достаточно толстый (от 1 мкм до нескольких сотен мкм.). Рост окисного слоя происходит за счет утолщения внешнего слоя.
Химическое оксидирование алюминия
Химическое оксидирование алюминия – самый доступный, дешевый и простой способ получить оксидные пленки на алюминии и его сплавах. Метод химического оксидирования не требует подвода электрического тока. Процесс проводится в растворах хроматов и позволяет оксидировать большое количество деталей одновременно. По качеству полученные пленки уступают слоям, полученным методами, с использованием тока. Толщина оксидных слоев – около 2 – 3 мкм.
В связи с невысокими защитными свойствами окисных слоев, полученных химическим оксидированием, метод не нашел широкого применения (используется довольно редко).
Очень важно при химическом оксидировании алюминия и его сплавов постоянно контролировать температуру и состав электролита. При уменьшении концентрации щелочи в растворе для химического оксидирования – пленки получаются тонкие, а при увеличении и высокой температуре раствора - имеют рыхлую структуру.
Конечная обработка анодно-окисных слоев
Очень часто полученные защитные оксидные пленки подвергаются дополнительной обработке: окрашивание, уплотнение.
Уплотнение анодно-оксидных пленок на алюминии применяют для придания окисным слоям светостойкости, высокой коррозионной стойкости и повышения диэлектрических свойств. Процесс уплотнения основан на способности оксидных слоев впитывать влагу. Во время уплотнения часть оксидов превращается в гидроксиды, которые заполняют полые поры, тем самым уплотняя пленку. На производствах очень часто применяют для уплотнения горячую воду (температура порядка 100 °С). Качество уплотненных окисных слоев зависит от продолжительности обработки, температуры, характеристик самой пленки. Для того чтоб ускорить процесс, в воду добавляют ПАВ и соли. Полученная пленка может быть от светло-серого до темно-серого цвета.
Еще один способ уплотнения оксидных слоев на алюминии – обработка в растворе бихромата калия (около 40 г/л) при температуре 90 – 95 °С. Продолжительность – 20 – 25 минут. На вид пленка зеленого цвета (светлый или с желтоватым отливом).
Защитные свойства оксидных слоев, уплотненных различными способами, примерно одинаковы.
Окрашивание анодно-оксидных пленок на алюминии проводят для придания изделию декоративных свойств.
Окрашивание проводится в различного типа красителях. Оксиды алюминия очень хорошо впитывают и удерживают органические и неорганические красители.
Перед окрашиванием пленку необходимо тщательно промыть от остатков электролита. Процесс пигментации проводят методом окунания в ванну с красящими веществами. Интенсивность и насыщенность цвета зависит от пористости и толщины оксидного слоя.
При использовании органических красителей можно получить большую гамму цветов, но их светостойкость низкая. Чтобы повысить светостойкость уже окрашенные слои дополнительно обрабатывают в уксуснокислых растворах никеля, кобальта и борной кислоты.
При окрашивании с использованием органических красителей процесс ведет в два этапа. Алюминиевое изделие с готовой оксидной пленкой поочередно погружают в раствор одной, а потом другой соли. Между погружениями следует промывка. Процесс ведется при комнатной температуре. В каждом растворе обработка длится 5 – 10 минут.
Если окрашенная пленка должна эксплуатироваться в агрессивной коррозионной среде – ее дополнительно пропитывают парафином либо бесцветным лаком.
Газовая коррозия
Газовая коррозия – химический процесс окисления металлов при высоких температурах в отсутствии жидкой воды, когда конденсация влаги на поверхности нвозможна. Газы, которые могут вызывать коррозию: водяной пар (Н2О), кислород, диоксиды серы, углерода монооксид углерода, оксиды азота, галогены, водород и сероводород. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин, металлы в процессе термической обработки и пр. В результате газовой коррозии на поверхности металла могут образоваться оксиды, сульфиды и др. соли. Газовая коррозия зависит от многих факторов: свойств окислителей и скорости движения газа, их концентрации, температуры (или перепадов температур). В случае коррозии сплавов имеет значение тип сплава (твердый раствор, интерметаллическое соединение или сплав эвтектического состава).
В основе коррозионных процессов как при любом окислении лежит хемосорбция кислорода (если среда – воздух). Если на металле образуется тончайший слой оксида, имеющий толщины порядка десятков ангстрем, оксидная пленка начинает защищать металл от дальнейшего окисления. Способность металлов сопротивляться коррозионному воздействию газов при высоких температурах называется жаростойкостью, а сохранять в этих условиях механические свойства – жаропрочностью. Металл может быть жаропрочен, но не жаростоек и наоборот. Например: алюминиевые сплавы жаростойки, но не жаропрочны уже при 400-450°С; вольфрамовая сталь – при 600-700°С жаропрочна, ноне жаростойка. Эффективное сочетание жаростойкости и жаропрочности достигается в сплавах никель-хром-алюминий.
Образование оксидной пленки на металлах
Первой стадией взаимодействия является хемосорбция атомов кислорода на поверхности металла. Приставка «хемо» показывает, что протекает процесс сопровождается химическим взаимодействием атомов металла и кислорода. Связь – ионная, но отличается от химической связи кислорода с металлом в оксиде, она значительно прочнее, т.к. атом кислорода испытывает действие поля, создаваемого нижележащими атомами металла. Насыщение поверхности металла хемосорбированным кислородом происходит практически мгновенно. Затем при низких температурах может иметь место физический процесс адсорбции кислорода за счет ван-дер-ваальсовых сил поверх хемосорбированного слоя. В случае термодинамической стабильности оксида хемосорбированный слой быстро переходит в состояние оксидной пленки, перестройки атомов металла и кислорода, соответствующей их пространственному распределению в оксиде.
Образующиеся оксидная пленка может обладать защитными свойствами, т.е. затрудняет проникновение реагентов – металла и кислорода – к друг другу. Защитные свойства пленки оцениваются по скорости окисления металла и характеру изменения этой скорости во времени. Кроме того, защитными свойствами обладают пленки, покрывающие поверхность металла сплошным слоем. Возможность образования такой пленки определяется следующим условием: молекулярный объем оксида на поверхности металла Vокс должен быть больше объема металла Vме, израсходованного на образование молекулы оксида. В противном случае образующегося соединения не хватает. Чтобы покрыть сплошным слоем поверхность металла, в результате чего пленка получается пористой, рыхлой. Таким образом, если Vокс/ Vме 1, то пленка не может быть сплошной; если Vокс/ Vме1, то может образоваться сплошная пленка. Пористая оксидная пленка, с низкой адгезией по отношению к металлу, защитными свойствами не обладает (щелочные, щелочно-земельные металлы и железо).
Рассмотрим примеры уравнений реакций газовой коррозии при высоких температурах, например в кислородной атмосфере:
При повышенных температурах металлы более активны по отношению к кислороду, чем при низких. При нагревании оксида металла до некоторой критической температуры происходит его термическое разложение, т.е. указанные процессы идут справа налево. Мерой устойчивости оксида следует считать давление газообразного кислорода над этим оксидом (в закрытом сосуде) – это называется давлением диссоциации. Оксид начинает образовываться на поверхности металла только при такой температуре, при которой давление диссоциации меньше, чем давление кислорода в газовой смеси (в воздухе, дыме), с которой контактирует металл. Для серебра давление диссоциации уже при 400 о С превосходит давление кислорода в воздухе, поэтому при температурах, превышающих это значение, коррозии серебра не происходит. Некоторые металлы образуют летучие оксиды, которые обнажают поверхность металла (молибден, вольфрам, ниобий, рений). В случае оксида железа, давление диссоциации которого очень мало, окисление железа происходит как при низких, так и при высоких температурах – порядка 2000 о С. Также ведут себя никель, медь, алюминий. Таким образом, стабильность оксида является необходимым условием начала процесса коррозии.
Дальнейшее окисление также зависит от свойств оксида. Если на поверхности образуется сплошная хорошо пристающая к поверхности металла пленка (обладает высокой адгезией), то доступ кислорода к ней затрудняется, коррозия замедляется, а затем и прекращается (цинк, никель, алюминий). Такие металлы достаточно коррозионно стойкие, толщина их оксидных пленок может быть от 5-10 до нескольких тысяч ангстрем. Однако в реальных условиях температура нагрева постоянно изменяется. Металл нагревается и охлаждается, что приводит к возникновению механических напряжений в слое металл-оксид. Оксидная пленка, обычно не обладая достаточной упругостью и пластичностью, отслаивается от металла; участки поверхности оказываются не защищенными, и вновь окисляются даже у металлов прочной оксидной пленкой.
Процессы газовой коррозии существенно ускоряются, если в составе газовой атмосферы присутствуют диоксид углерода, соединения серы. Образующиеся карбонаты, сульфиды и сульфаты термически разлагаются, обнажая поверхность металла, а вновь образовавшаяся оксидная пленка более пористая, чем та, которая образуется в чисто кислородной атмосфере.
Действие водорода под высоким давлением на сталь сводится к тому, что он растворяется в железе, что приводит с одной стороны к увеличению его жесткости и хрупкости, с другой – водород взаимодействует с карбидом железа (цементитом) с образованием метана. Все это приводит к потере прочности и упругости стальных изделий: Fe3C + 2H2 = 3Fe + CH4
В качестве примера газовой химической коррозии, которая идет в жидких неэлектролитах (органических средах), можно привести коррозионную активность нефти и нефтепродуктов, которые содержат сероводород, серу и меркаптаны (органические производные серы типа R-SH, R-S-SH) и вызывают коррозию железа, меди, свинца, олова, кобальта, никеля, кадмия, серебра с образованием сульфидов.
2.2.1. Особенности образования и структура оксидных пленок.
В атмосферных условиях поверхности металлов покрыты оксидами. При комнатной температуре окисление металла сначала идет достаточно быстро, но при достижении определенной толщины оксидной пленки процесс окисления резко замедляется. Так, при окислении меди после двухчасовой выдержки толщина оксидной пленки достигает 24Ǻ и затем почти не изменяется (1Ǻ=10 -10 м).
Процесс окисления при низких температурах начинается с физической адсорбциикислорода, переходящей в стадиюхемосорбциии окисления. Если выделяемая при физической адсорбции энергия мала и имеет порядок единиц килокалорий на моль (ккал/моль), то энергия хемосорбции и образования стабильных оксидов составляет десятки и сотни килокалорий на моль (таблица 1).
В таблице приведены значения энергий хемосорбции и энергии образования некоторых оксидов металлов. В скобках указана энергия связи, приходящаяся на каждый атом кислорода в оксиде и хемосорбированном слое.
Отметим, что для большого числа металлов энергия связи, приходящаяся на каждый хемосорбированный атом кислорода, близка к энергии связи, приходящейся на каждый атом в оксиде. Следовательно, хемосорбция кислорода является начальной стадией окисления металлов(образование первого слоя, рис. 10).


Рисунок 10. Схема последовательности образования (а) и строения слоя хемисорбированного кислорода на металле (в) и строения оксида (с)
1 – адсорбированные молекулы кислорода; 2 – хемосорбированные атомы кислорода; 3 – атомы металла.
Результатом взаимодействия кислорода с металлами является образование оксидной пленки, которая снижает их химическую активность. При окислении металлам свойственна тенденция к сохранению в окисных пленках своей собственной атомной структуры. Чем меньше толщина оксидной пленки, тем больше ориентационное воздействие металла на ее структуру. С увеличением толщины пленки в ее структуре происходят превращения, в результате которых образуются оксиды с присущими им типом и параметрами кристаллической решетки и плотностью.
В зависимости от толщины, оксидные пленки принято подразделять на:
тонкие (невидимые) толщиной от мономолекулярного слоя до 40 нм (400Ǻ);
средние (видимые как цвета побежалости), имеющие толщину 40-500 нм (400-5000Ǻ);
толстые (видимые), толщиной свыше 500 нм (>5000Ǻ), например окалина на стали.
После образования на поверхности металла первичной пленки дальнейший рост ее толщины определяется диффузией через нее металла и кислорода (рис. 11).
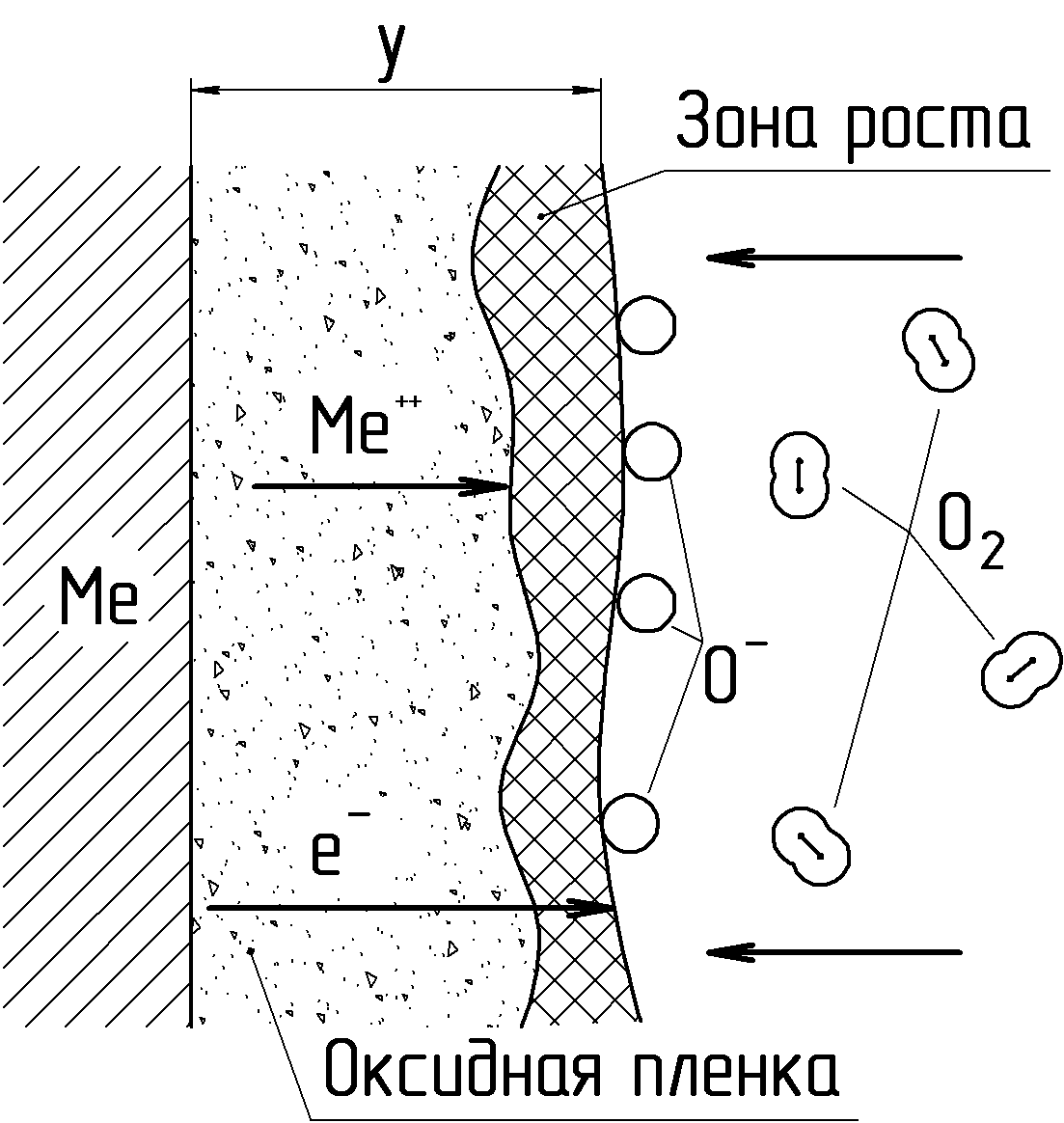
Рисунок 11. Схема механизма роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют ионную кристаллическую структуру, обладающую ионной и электронной проводимостью, то в диффузионных процессах через пленку участвуют не атомы, а ионы металла и свободные электроны (рис. 11). Возможно также образование ионов кислорода на внешней поверхности пленки за счет ионизации проходящими со стороны металла электронами. Образующиеся ионы кислорода диффундируют в сторону металла. В силу того, что радиусы ионов металла значительно меньше радиуса иона кислорода, скорость диффузии первых несколько выше. Поэтому образование оксида, а, следовательно, и рост толщины пленки, происходит в зоне близкой к ее внешней поверхности. При этом изменяется соотношение компонентов, участвующих в образовании оксида, что, как следствие, может приводить к образованию на поверхности металлов «сложных» пленок, состоящих из нескольких оксидов (рис. 12).


Рисунок 12. Микроструктура сечения оксида, образовавшегося: а – после 100-ч окисления кобальта в атмосфере воздуха при 800°С; б – после 24-ч окисления железа в атмосфере воздуха при 620°С.
Кинетика роста толщины оксидных пленок определяется их структурой и, в частности, сплошностью. Условие сплошности состоит в том, что молекулярный объем оксида должен быть больше объема металла, ушедшего на его образование, чтобы покрыть поверхность металла сплошным слоем. Следовательно, обозначив молекулярный объем оксида VОК, а объем металла, из которого он образуется –VМе, можно записать:

при – образуется сплошная оксидная пленка;

при – оксидная пленка не получается сплошной.
Указанные соотношения для некоторых металлов таковы: MgO– 0,85;CaO– 0,63;Al2O3– 1,31;CuO– 1,71;CoO– 1,78;FeO– 1,71,Fe3O4– 2,09;Fe2O3– 2,14;Cr2O3– 2,02;WO– 3,36;MoO3– 3,45.

В тех случаях, когда могут возникать такие напряжения, которые приводят к вспучиванию и отслаиванию оксидной пленки, что приводит к снижению ее защитных свойств.

Наиболее плотные и прочно сцепленные с поверхностью оксидные пленки образуются при соотношении .
Для несплошных оксидных пленок скорость роста их толщины определяется кинетикой химического взаимодействия (кинетический режим) и подчиняется линейному закону:

(4)
где y– толщина пленки;
t– время окисления;
k– константа, зависящая от парциального давления окислительного компонента и температуры.
После интегрирования получим: y=kt+A, гдеА– постоянная интегрирования, характеризующая начальную толщину оксидной пленки. На рисунке 13 приведена зависимость, характеризующая процесс окисления магния в кислороде.

Рис. 13 Линейный закон роста оксидной пленки при окислении магния в кислороде при различных температурах
Для сплошных оксидных пленок, с ростом ее толщины, процесс диффузионного переноса будет замедляться (диффузионный режим) и скорость роста оксидной пленки будет подчиняться параболическому закону: y 2 =kt+А(рисунок 14). Для некоторых металлов и условий окисления скорость роста оксидной пленки может описываться более сложной параболической:y n =kt+А (медь при Т>300ºC, железо при Т>500ºC, никель), или логарифмической зависимостями:y=ln(kt)(алюминий при Т

Рисунок 14. Параболические кривые роста окисной пленки при окислении железа (при Т>500ºC)

Рис. 15 Логарифмические кривые роста оксидной пленки при окислении железа (при Т<500ºC)
Следует отметить, что указанные закономерности действительны только для чистых металлов. Наличие легирующих компонентов в сплавах или даже примесей в металлах может существенно изменять свойства поверхности и характер взаимодействия с кислородом.
В процессах пайки металлов большое значение имеют не только толщина, но и свойства оксидных пленок. Сплошные, прочно связанные с металлами оксидные пленки труднее удалять с паяемой поверхности, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом, тем меньше ее устойчивость при нагреве, тем меньше трудностей с ее удалением при пайке.
На поверхности металлов, кроме оксидов, могут находиться и другие вещества с неметаллической связью, препятствующие образованию физического контакта припоя с паяемым материалом, например, масла, жиры, пыль, краски, охлаждающие жидкости и адсорбированные газы. Подобные загрязнения удаляются с паяемых поверхностей в процессе подготовки путем общего или местного обезжиривания в различных растворителях.
Удаление оксидных пленок и других продуктов химического взаимодействия поверхностного слоя металла с внешней средой и предотвращение их образования может быть произведено механическими, физическими, химическими и физико-химическими методами.
Читайте также:
