Образование простых веществ металлов
Обновлено: 20.09.2024
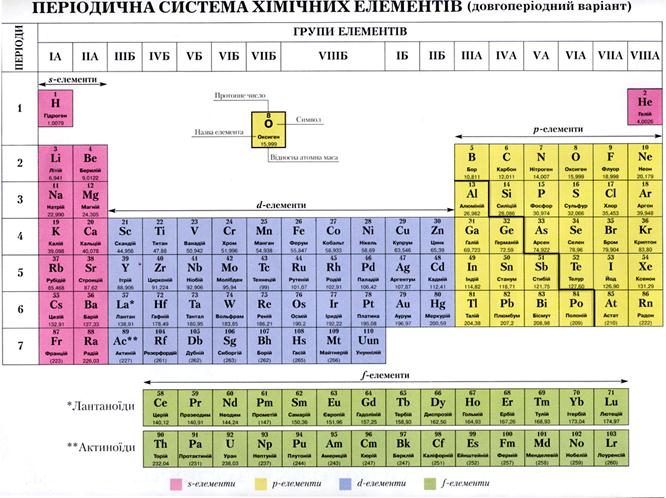
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39металлы легкоплавкие (менее 100 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см 3 ) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см 3 ).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества - металлы всегда являются восстановителями.
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | |||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 и конц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al 3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
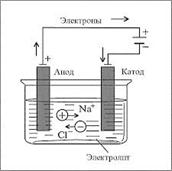
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Образование простых веществ металлов
Металлы, как и все химические элементы, имеют три формы существования: атомы, простые и сложные вещества. Из 118 элементов периодической системы к металлам относят 96.
Общие физические свойства металлов.
Физические свойства металлов обусловлены металлической кристаллической решёткой и металлической химической связью. Напомним, что для металлов характерны металлический блеск, пластичность, высокая электро- и теплопроводность, рост электрического сопротивления при повышении температуры, а кроме того, такие практически значимые свойства, как ковкость, твёрдость, магнитные свойства.
Металлы — твёрдые при обычных условиях вещества (кроме ртути, которая становится твёрдой и ковкой при низких температурах).
Металлы пластичны и тягучи, кроме хрупких висмута и марганца. Из меди, алюминия, олова, а также золота изготавливают тончайшие листы — фольгу. Золотая фольга может иметь толщину около 100 нм! Такую фольгу используют для золочения предметов интерьера, стен и потолков, изделий из гипса, дерева, металла, стекла и пластика.
Все металлы имеют металлический блеск, большинство из них серебристо-белого или серого цвета. Из-за того, что стронций, золото и медь поглощают в большей степени близкие к фиолетовому цвету короткие волны и отражают длинные волны светового спектра, эти металлы окрашены в светло-жёлтый и медный цвет. Очень тонкие листки серебра и золота имеют совершенно необычный вид — они представляют собой голубовато-зелёную фольгу, а мелкие порошки металлов кажутся тёмно–серыми и даже чёрными. И только порошки магния и алюминия сохраняют серебристо-белый цвет.
В технике металлы принято классифицировать по различным физическим свойствам:
Металлы принято делить на чёрные (железо и его сплавы) и цветные (остальные металлы и сплавы). Соответственно называются и отрасли металлургической промышленности: чёрная и цветная металлургия.
Важнейшими продуктами цветной металлургии являются титан, вольфрам, молибден и другие металлы, которые могут использоваться в качестве специальных легирующих добавок для производства сверхтвёрдых, тугоплавких, устойчивых к коррозии сплавов, широко применяемых в машино– и станкостроении, в оборонно–космической отрасли.
Современные композиционные материалы, выполненные на основе керамики или полимеров, становятся сверхпрочными, если укреплены металлическими нитями из молибдена, вольфрама, титана, специальных сталей и т. д.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.

- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:
Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид 3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2) , Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn 0 + 2H + = Zn 2+ + H2 0
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO – + Zn 2+ + Н2 0
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn 0 + Сu 2+ = Zn 2+ + Сu 0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)

Конспект урока по химии в 11 классе «Металлы». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
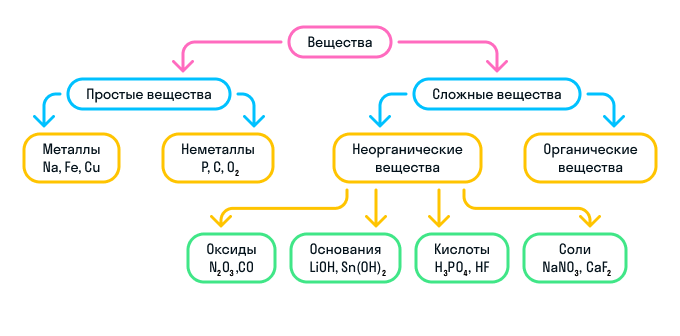
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
О чем эта статья:
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
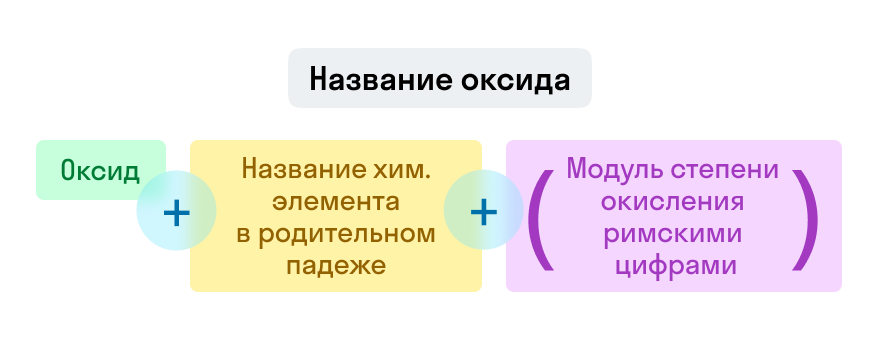
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
