Общая формула гидридов щелочных металлов
Обновлено: 20.09.2024
ГИДРИДЫ
ГИДРИДЫ, соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к гидридам относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, гидриды, комплексные (см., напр., Алюмогидриды, Борогидриды металлов)и гидриды интерметаллич. соединений. Для большинства переходных металлов известны также комплексные соед., содержащие атом Н наряду с др. лигандами в координац. сфере металла-комплексообразователя.
Простые гидриды. Известны для всех элементов, кроме благородных газов, платиновых металлов (исключение -Pd), Ag, Au, Cd, Hg, In, Tl. В зависимости от природы связи элемента (Э) с водородом подразделяются на ковалентные, ионные (солеобразные) и металлоподобные (металлические), однако эта классификация условна, т. к. между разл. типами простых гидридов резких границ нет.
К ковалентным относят гидриды неметаллов, Al, Be, Sn, Sb. Гидриды SiH4, GeH4, SnH4, PH3, AsH3, SbH3, H2S, H2Se, H2Te (см. табл. 1) и низшие бороводороды-газы. Ковалентные гидриды обладают высокой реакц. способностью. Эффективный положит. заряд атома Э в молекуле возрастает в пределах одной группы периодич. системы с увеличением его порядкового номера. Элементы Si и Ge образуют высшие гидриды общей ф-лы ЭnН2n + 2 (п 2 и Н2. Все эти гидриды раств. в неполярных или малополярных орг. р-рителях. Ковалентные гидриды-сильные восстановители. Легко вступают в обменные р-ции, напр. с галогенидами металлов. При 100-300 °С (H2S ок. 400 °С) разлагаются практически необратимо до Э и Н2.
Гидриды подгруппы фосфора получают р-цией ЭС13 с Li[AlH4] в эфире при 25 °С; SiH4 и GeH4-взаимод. Мg2Э с водой или с В2Н6 в жидком NH3; H2S, H2Se и Н2Те-кислотным гидролизом сульфидов, селенидов или теллуридов металлов (H2S-также взаимод. Н, и S). Все упомянутые гидриды, особенно AsH3 и РН3, высокотоксичны. Гидриды Ge, Si, As используют для получения полупроводниковых материалов. См. также Мышьяка гидрид, Сероводород, Силаны, Фосфины.
К ионным относят гидриды щелочных и щел.-зем. металлов (кроме Mg). Эти соед.-структурные аналоги соответствующих галогенидов. Представляют собой кристаллы, к-рые в расплавл. состоянии проводят электрич. ток, причем Н2 выделяется на аноде. Не раств. в орг. р-рителях, хорошо раств. в расплавах галогенидов щелочных металлов. Обладают высокой хим. активностью, бурно реагируют с О2 и влагой воздуха. Взаимод. с водой (напр., МН + Н2О -> МОН + Н2) сопровождается выделением тепла. В эфире, диглиме, ТГФ легко (особенно LiH и NaH) реагируют с галогенидами или гидридами В и А1, образуя соотв. борогидриды М[ВН4]n и алюмогидриды М[А1Н4]n. При 700-800°С восстанавливают оксиды до металлов. С СО2 дают соли муравьиной к-ты. Взаимод. с N2, напр. 3СаН2 + + N2->Ca3N2 + ЗН2.
Получают ионные гидриды обычно взаимод. Н2 с расплавом соответствующего металла под давлением. Их используют в кач-ве сильных восстановителей (напр., для получения металлов из их оксидов или галогенидов, удаления окалины с пов-стей изделий из стали и тугоплавких металлов). Многие гидриды-источники Н2, перспективное ракетное топливо. Дейтериды и тритиегидриды - возможное горючее для ядерных реакторов. См. также Лития гидрид.
Гидрид Mg по св-вам и природе хим. связи занимает промежут. положение между ковалентными и ионными гидридами; кристаллы с решеткой типа ТiO2; при высоких давлениях ( ~ 7 МПа) претерпевает полиморфные превращения. С водой и водными р-рами к-т и щелочей MgH2 взаимод. с выделением Н2, однако менее энергично, чем гидриды щелочных и др. щел.-зем. металлов. М. б. получен взаимод. Mg с Н2 при 200-250 °С и давлении 10 МПа (скорость р-ции мала) либо обменной р-цией MgHal2 с МН или М [А1Н4], где М—Li, Na, в среде орг. р-рителя. Легко образуется при гидрировании сплавов Mg, содержащих небольшие добавки РЗЭ и переходных металлов, при 150-180°С и 1-5 МПа, причем р-ция обратима. В связи с этим такие сплавы-перспективные хим. аккумуляторы Н2 для нужд малой энергетики, металлургии и хим. технологии.
К металлоподобным относят гидриды переходных металлов и РЗЭ. Формально такие соед. могут рассматриваться как фазы внедрения водорода в металл. Их образованию всегда предшествует адсорбция Н2 на пов-сти металла.
Адсорбированная молекула диссоциирует на атомы Н, в результате диффузии к-рых в кристаллич. решетку происходит образование т.н. 2 в , как правило, стехиометрич. состава (МН3 для металлов III гр., МН2 для IV гр. и ванадия). Взаимод. Н2 с указанными металлами (кроме Pd) всегда сопровождается перестройкой кристаллич. решетки. Для описания природы хим. связи водорода с металлич. матрицей используют представление о типе связи, промежуточном между ионной и металлической; электроны водорода в большей или меньшей степени участвуют в формировании зоны проводимости гидридов. По-видимому, вклад ионной составляющей связи М + —Н - Наиб. велик для EuH2, YbH2 и тригидридов лантаноидов и минимален для PdH0,6, а также для гидридов Mn, Fe, Co, Ni, существующих при высоких давлениях Н2 и содержащих менее одного атома Н на атом металла.
Металлоподобные гидриды (см. табл. 2)-светло- и темно-серые кристаллы с металлич. блеском, устойчивые на воздухе при комнатной т-ре. С О2, водой и водяным паром реагируют медленно. М.б. получены взаимод. металла с Н2 при обычной т-ре или при нагр.; напр., TiH2 и LaH3 синтезируют при 150-200 °С. Получение гидридов стехиометрич. состава в большинстве случаев сопряжено со значит. трудностями из-за высокой чувствительности гидрироваиия к наличию примесей в металле и особенно О2 и водяных паров в Н2. Металлоподобные гидриды ограниченно применяют в кач-ве источников Н2 высокой чистоты (используемых, напр., в топливных элементах) и для поглощения Н2 из газовых смесей. Гидриды Pd-катализаторы гидрирования, изомеризации, орто- и парапревращения Н2.
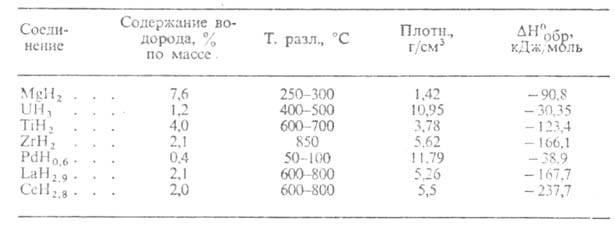
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ ГИДРИДОВ
Гидриды интерметаллических соединений. Содержат обычно атомы РЗЭ, Mg, Ca, Ti, Al, Fe, Co, Ni, Си. Легко образуются при взаимод. интерметаллидов даже с техн. Н2 (содержащим до 1-2% примесей О2 и водяного пара) при 25-200°С и давлениях Н2 0,1-1 МПа; скорость поглощения Н2 очень велика. Р-ции характеризуются малыми тепловыми эффектами (20-30 кДж на 1 моль Н2, для индивидуальных металлов-100-120 кДж) и не приводят к значит. изменениям в структуре исходной металлич. матрицы; в большинстве случаев происходит лишь увеличение ее объема на 10-30%. Для гидридов этого типа характерна высокая подвижность водорода и большая хим. активность (о св-вах см. также табл. 3).
Данная р-ция характерна для соед., образованных РЗЭ и Mg, а также РЗЭ и Fe, Ni или Со. Так, гидрид РЗЭ, образующийся при гидрогенолизе интерметаллида, содержащего Mg, катализирует как гидрирование Mg, так и дегидрирование MgH2 при 150-180°С: МН2 + nMg + (n + 0,5) Н2 МН3 + nMgH2
Благодаря высокому содержанию Н2, возможности значит. смещения равновесия в ту или др. сторону посредством небольших изменений т-ры и давления Н2, способности поглощать Н2 при низких т-рах и устойчивости к действию О2 и влаги воздуха, гидриды интерметаллич. соединений м.б. использованы как хим. аккумуляторы слабосвязанного водорода. Перспективно их применение как источников топлива для автономных энергосистем, напр. автомобильного транспорта (см. Водородная энергетика), а также для получения высокодисперсных металлич. порошков и катализаторов гетерог. гидрирования.

Табл. 3.-СВОЙСТВА ГИДРИДОВ ИНТЕРМЕТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
===
Исп. литература для статьи «ГИДРИДЫ» : Гидриды металлов, пер. с англ., М., 1973; Девятых ГГ., Зорин А. Д., Летучие неорганические гидриды особой чистоты, М., 1974; Антонова А. М., Морозова Р. А., Препаративная химия гидридов. К., 1976; Водород в металлах, пер. с англ., т. 2, М., 1981. К.Н. Семененко.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
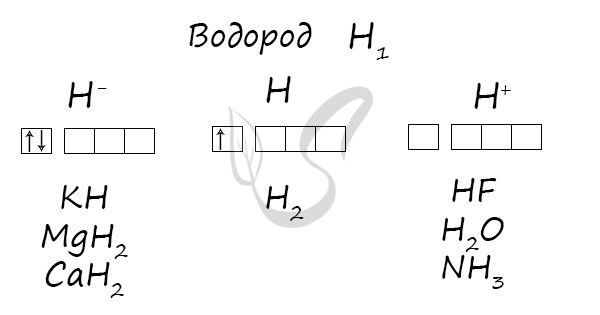
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) - самый легкий химический элемент, при обычных условиях - газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород - самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
- Конверсия с водяным паром при t = 1000 °C

- Вытеснением водорода из кислот
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)

Na + H2 → NaH (гидрид натрия)
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реагирует с основными оксидами - с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами - с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой - по аниону (Na2CO3).
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты - без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты - при нагревании)

Кристаллогидраты
Кристаллогидраты - кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди - белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Гидриды
Гидр и ды, соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа гидридов: ионные, металлические и ковалентные.
К ионным (солеобразным) гидридам относятся гидриды щелочных и щёлочноземельных металлов. Это белые кристаллические вещества, устойчивые в обычных условиях и лишь при нагревании разлагающиеся без плавления на металл и водород (кроме LiH, плавящегося при 680°С). Водой энергично разлагаются с выделением водорода. Получаются при взаимодействии металлов с водородом при 200—600°С. LiH и NaH применяются в органическом синтезе как восстановители и конденсирующие агенты. CaH2 — для высушивания и определения воды в органических растворителях, при получении порошков металлов из окислов, а также водорода. Раствором NaH в расплавленной щёлочи снимают окалину с металлических изделий. Ионное строение имеют и двойные гидриды — борогидриды МеВН4 и алюмогидриды MeA1H4 (см. Алюминия гидрид), широко используемые в органическом синтезе в качестве эффективных восстановителей.
Гидриды переходных металлов принадлежат к типу металлических, т.к. по характеру химических связи они сходны с металлами. Эти гидриды в большинстве случаев являются соединениями переменного состава, и приводимые ниже формулы дают лишь предельное содержание в них водорода. Многие металлы способны поглощать значительное количество водорода с образованием твёрдых растворов, сохраняющих кристаллическую структуру данного металла. Напротив, истинные гидриды имеют структуру иную, чем исходный металл. Для металлов III группы периодической системы (подгруппа Sc и лантаноиды) характерно образование двух типов гидридов — MeH2 и MeH3. Металлы IV группы (подгруппа Ti) образуют гидриды MeH2, а металлы V группы (подгруппа ванадия) — MeH. Гидриды металлов этих групп — хрупкие твёрдые вещества серого или чёрного цвета, получаются при действии водорода на мелкораздробленные металлы при повышенных температурах. Металлы VI, VII и VIII групп (кроме палладия) при поглощении водорода не дают определённых химических соединений.
Гидриды переходных металлов служат катализаторами различных химических реакций. Способность металлов образовывать гидриды используется в высоковакуумной технике для связывания водорода. В результате образования гидридов, например при действии паров воды на раскалённый металл и при электролитическом выделении металлов, ухудшается качество металлов (появляется т. н. водородная хрупкость).
Гидриды переходных металлов I и II групп периодической системы, а также гидриды III группы (подгруппа A1) не образуются при взаимодействии металла с водородом. Они получаются, например, при восстановлении соединений этих металлов алюмогидридом лития LiAlH в эфирном растворе. Все они при нагревании легко разлагаются на металл и водород.
Ковалентные гидриды образуются неметаллами IV, V, VI и VII групп периодической системы, а также бором. Кроме простейших соединений этого типа (метана CH4, силана SiH4 и т.п.), являющихся газами, известны гидриды с большим числом атомов элемента, соединённых друг с другом в виде цепей, например силаны SinH2n+2. Простейший гидрид бора ВН3 не существует, бороводороды имеют сложное строение. Гидриды элементов первых периодов очень стабильны, гидриды тяжёлых элементов крайне неустойчивы. Многие гидриды (B2H6, SiH4, PH3) легко воспламеняются на воздухе. B2H6 и SiH4 разлагаются водой с выделением водорода. Гидриды элементов V, VI и VII групп водой не разлагаются. Известны многочисленные производные ковалентных гидридов, в которых часть атомов водорода замещена на атомы галогена или металла, а также на алкильные и др. группы. Ковалентные гидриды получают непосредственным взаимодействием элементов, разложением металлических соединений водой или кислотами, восстановлением галогенидов и др. соединений гидридами, борогидридами и алюмогидридами щелочных металлов. Термическое разложение гидридов служит одним из методов получения особо чистых элементов (например, кремния, германия).
Лит.: Херд Д., Введение в химию гидридов, пер. с англ., М., 1955; Жигач А. Ф., Стасиневич Д. С., Химия гидридов, Л., 1969; Михеева В. И., Гидриды переходных металлов, М., 1960; Маккей К., Водородные соединения металлов, пер. с англ., М., 1968; Галактионова Н. А., Водород в металлах, 2 изд., М., 1967.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Читайте также:
