Общая характеристика металлов 9 класс
Обновлено: 28.09.2024
Девиз урока: “Единственный путь, ведущий к знанию,– это деятельность” (Б.Шоу).
Реактивы и оборудование: цинк, магний, медь, железо, вода, соляная кислота, раствор хлорида меди (II); спиртовка, спички, держатель, штатив с пробирками.
В данный модуль входят четыре учебных элемента (УЭ):
УЭ-1. Постановочная часть урока;
УЭ-2. Металлы – химические элементы;
УЭ-3. Металлы – простые вещества;
УЭ-4. Резюме. Самостоятельная работа.
УЭ-1.
Постановочная часть урока.
Цели: познакомить учащихся с содержанием модуля, поставить учебные цели и определить пути их достижения.
На доске написано название модуля – “Общие свойства металлов”.
Начинаем с актуализации знаний учащихся, постановки учебных целей (5 мин). Знакомим учащихся с содержанием модуля по карте самоконтроля и самооценки по данной теме и обращаем их внимание на то, что они должны знать и уметь.
Карта самоконтроля и самооценки
по теме “Общие свойства металлов”
| Содержание | Что нужно знать | Что нужно уметь | Контрольные вопросы и задания | Источник информации |
| Положение химических элементов металлов в периодической системе. Нахождение металлов в природе. | Положение металлов в периодической системе и особенности строения их атомов. | Давать сравнительную характеристику металлов по положению в периодической системе. | 1. Какова распространенность металлов в природе? |
2. В чем различие в строении атомов металлов и неметаллов? Приведите пример.
3. Как изменяется восстановительная способность металлов в периодах, в главных подгруппах? Почему?
Объясните окислительно-восстановительные процессы.
2. При взаимодействии 3,45 г щелочного металла с водой образовалось 5,6 л (н.у.) водорода. Назовите щелочной металл.
После этого предлагаем вспомнить, что учащиеся уже знают о металлах, заполняем на доске таблицу ЗХУ – “Знаем, хотим узнать” и ставим учебные цели.
Таблица ЗХУ
Затем следует “загадочная пауза”. Предлагаем учащимся загадки о металлах (3 мин).
- Он в теченье многих лет был причиной многих бед (Au).
- Был металл серебристо-белым, в соединении стал мелом (Ca).
- Красит пламя в желтый цвет, в воду кинь – его уж нет (Na).
- К восьмой группе отнесен, в честь России назван он (Ru).
- “Камнем” прозван он людьми, но попробуй-ка возьми (Li).
- Из него солдатик твой, не болеет он “чумой” (Sn).
На каждой парте лежит незаполненная схема-кластер “Общие свойства металлов”. Совместно с учащимися заполняем ее на основании таблицы ЗХУ.
Кластер по теме “Общие свойства металлов”
УЭ-2.
Металлы – химические элементы.
Цель: сформировать понятие о металлах как химических элементах.
Учащиеся в течение 10 мин работают с частью I опорного конспекта “Химия металлов” и делают краткие записи в тетрадях по плану.
- Положение химических элементов – металлов в периодической системе.
- Строение атомов металлов.
- Нахождение металлов в природе (использовать “Распространенность металлов в земной коре”).
Распространенность металлов в земной коре
После этого организуем обсуждение данных вопросов и сообщаем интересную информацию: металлы составляют 3% массы человека, например содержание кальция в организме – 2%, калия – 0,27%, натрия – 0,1%. Роль металлов в организме человека чрезвычайно велика.
УЭ-3.
Металлы – простые вещества.
Цели: сформировать понятие о металлах как простых веществах, повторить и закрепить знания о физических и химических свойствах металлов, их нахождении в природе, основных областях их применения.
На доске записаны слова: “Семь металлов создал свет по числу семи планет” – и прикреплены карточки знаков семи металлов:
| Au Солнце | Cu Венера | Ag Луна | Fe Марс | Sn Юпитер |
Сообщаем учащимся краткую историческую справку о металлах (3 мин).
Считается, что в древности и средние века были известны только семь металлов по числу известных тогда планет. Алхимики считали, что эти металлы рождаются в недрах Земли под влиянием лучей планет. В настоящее время множество металлов трудятся вокруг нас и для нас, где бы мы ни находились: дома или в школе, на улице или в транспорте. А было время, когда человек использовал всего несколько металлов.
Примерно 70 лет назад электрическая лампочка считалась чудом. Это и впрямь чудо, ведь при изготовлении обыкновенной лампочки используют девять металлов. Каждый из них обладает своими свойствами. Прежде чем поговорить о свойствах металлов, делаем “загадочную паузу”.
- Самый распространенный в земной коре металл (Al).
- Металл, обнаруженный в упавших метеоритах (Fe).
- Металл, обладающий бактерицидными свойствами (Ag).
- Металл, широко используемый в электротехнике (Cu).
В течение 7 мин учащиеся изучают самостоятельно физические свойства металлов по учебнику и опорному конспекту “Химия металлов”.
Опорный конспект “Химия металлов”
В процессе работы они составляют схему – “паучок” по теме “Физические свойства металлов”, зарисовывают схему металлической кристаллической решетки и отвечают на вопросы: каков вид химической связи в металлах? Чем обусловлены общие физические свойства металлов?
Схема – “паучок” по теме “Физические свойства металлов”
На изучение химических свойств металлов отводим 15 мин.
Учащиеся работают с учебником и опорным конспектом “Химия металлов”, зарисовывают в тетради схему “Химические свойства простых веществ – металлов” из этого конспекта. Обращаем их внимание на то, что металлы проявляют восстановительные свойства. Учащиеся сравнивают восстановительные свойства металлов, используя электрохимический ряд напряжений металлов.
После этого проводим лабораторные опыты “Химические свойства металлов” по плану, который записан на доске.
- Окисление меди кислородом воздуха.
- Взаимодействие магния с водой.
- Взаимодействие цинка с соляной кислотой.
- Взаимодействие железа с хлоридом меди (II).
Учащиеся фиксируют наблюдения и делают выводы о химических свойствах металлов.
Следующий этап – изучение способов получения металлов (7 мин). Учащиеся самостоятельно работают с таблицей “Общие способы получения металлов”, а также используют материал учебника. Они записывают в тетрадь общие способы получения металлов и перечисляют основные восстановители металлов.
Общие способы получения металлов
| Способы получения | Конкретные металлы | Химизм процесса |
I. Использование самородных металлов
II. Гидрометаллургия(восстановление из раствора)
| Реакции замещения в водном растворе | Ag, Cu, Zn, Cd, Mo, V | CuO→ CuSO4→ Cu |
III. Пирометаллургия(восстановление при высокой температуре)
| 1. Восстановление более активными металлами (металлотермия) | Тугоплавкие: Cr, Fe, Mn, W | МеО+Al→Ме+Al2O3+Q Cr2O3+Al→ MnO2+Mg→ |
| 2. Обжиг сульфидных руд | Zn, Fe | ZnS→ZnO→Zn |
IV. Восстановление из оксидов (при нагревании)
| 1. Водородом H2 | Pb, Cu, W, Mn, Fe | МеО+ H2→Ме+H2O-Q ZnO+ H2→ WO3 + H2 → |
| 2. Коксом C или кремнием Si | Чугун, Cu, , Zn, Sr, Pd, V, Co, Ni, Bi | МеО+ C→Ме+CO-Q V2O5 + C → SnO2 +Si→ |
| 3. Оксидом углерода (II) CO | Fe, ферросплавы | МеО+ CO→Ме+CO2-Q Fe2O3+ CO→ |
| 4.Разложением оксидов | Hg, Ag | HgO→ ? + ? – Q |
V. Электрометаллургия (восстановление электрическим током)
| 1. Электролиз расплавов солей и щелочей | Щелочные или щелочноземельные Ме | На катоде: |
| 2. Электролиз растворов солей | Mg-Ag | На катоде: |
Изучая применение металлов (7 мин), учащиеся работают с пособием Р.А.Лидина, В.А.Молочко “Химия для абитуриентов”, с.157 (М.: Химия, 1993) и составляют рассказ о применении металлов. На уроке заслушиваем и оцениваем два лучших рассказа. Затем проводим “химическую паузу” (3 мин), предлагая учащимся химические “перевертыши”. Прослушав текст “перевертыша”, учащиеся определяют правильное звучание фразы.
- Разговор – ртуть, крик – платина. (Слово – серебро, молчание – золото.)
- Гладь металл, пока холодно. (Куй железо, пока горячо.)
- Пролежал холод, сушь и оловянные трубы. (Прошел огонь, воду и медные трубы.)
- Не та грязь, что тусклая. (Не то золото, что блестит.)
- Звери живут за неметалл. (Люди гибнут за металл.)
УЭ-4.
Резюме. Самостоятельная работа.
Цели: повторить и обобщить знания о металлах, выявить степень усвоения учащимися материала модуля “Общие свойства металлов”.
Время работы -10 мин. Данную часть урока можно провести в форме самостоятельной работы над вопросами и заданиями из карты самоконтроля и самооценки по теме “Общие свойства металлов”. Работу организуем по трем вариантам. В случае затруднений учащиеся могут обратиться к рекомендуемым источникам информации.
Задания для самостоятельной работы
Закончите уравнения реакций, объясните один из окислительно-восстановительных процессов (подчеркнут).
В конце урока учащиеся записывают домашнее задание и высказывают свое мнение о данном уроке.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
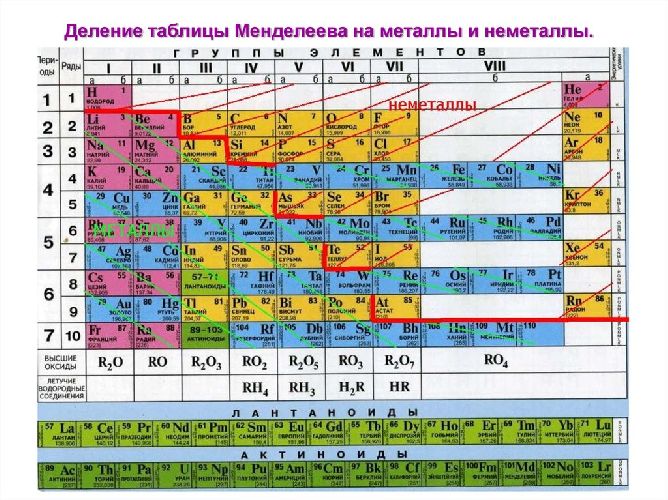
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Общая характеристика металлов 9 класс

КГУ«Школа-гимназия №32»
г. Нур-Султан
Общая характеристика металлов.
Учитель химии
Дарипова Айгуль Айтказиновна

Цели обучения:
9.1.4.1 знать определение металлической связи, металлической кристаллической решетки
9.1.4.2 определять вид связи и тип кристаллической решетки в металлах и предсказывать их физические свойства
9.2.1.3 описывать характерные физические и химические свойства металлов, объяснять способность металлов проявлять только восстановительные свойства

Критерии оценивания
Может перечислить физические свойства металлов
Может дать определение металлической связи
Может описать строение металлической кристаллической решетки
Может объяснить физические свойства металлов на основе их строения
Может предсказать физические свойства металлов на основе расположения в периодической таблице

Металлы, заметьте, бывают везде:
На суше и в море, в воздушной среде.
Металлы мы «видим» в различных вещах,
В серёжках и кольцах, других мелочах.
Приносят радость амулеты
И разноцветные браслеты.
Оберегают нас металлы,
Даря магическую тайну.

Древние алхимики говорили: «Семь металлов создал свет по числу семи планет», – и полагали, что под влиянием лучей планет в недрах Земли и рождаются металлы. Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). Само слово «металл», по-видимому, происходит от греческого «металлон», что означает «рудники», «копи». В истории человечества выделяют века: медный, бронзовый, железный



Положение металлов в системе химических элементов Д. И. Менделеева
Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы
На внешнем уровне 1-3 реже 4 и 5 электронов
К металлам относятся s-элементы (кроме H, He), большинство p-элементов, все d- и f-элементы
Имеют большой радиус атома
Являются восстановителями



Общая характеристика металлов
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: высокими электропроводностью и теплопроводностью, способностью хорошо отражать свет (что обуславливает их блеск и непрозрачность), возможностью принимать нужную форму под воздействием внешних сил (пластичностью). Существует и другое определение металлов – это химические элементы, характеризующиеся способностью отдавать внешние (валентные) электроны.
Из всех известных химических элементов около 90 являются металлами. Большинство неорганических соединений – это соединения металлов.

Вид химической связи и тип кристаллической решетки

Металлическая связь – это химическая связь, образующаяся между катионами и свободно движущимися электронами в металлической кристаллической решетке



Задание 1
Изобразить электронную и графическую формулу атома магния;
Показать схему образования катиона магния
Определить вид химической связи и тип кристаллической решетки для магния и хлорида магния

Физические свойства металлов
Тверды они все, кроме ртути,
Блестящи и твёрды по сути.
Беда у них тоже одна —
Коррозия ест их до дна.

Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.

Задание 2 по вариантам
1 вариант: распределить металлы по возрастанию температуры плавления
2 вариант: распределить металлы по возрастанию плотности

Закрепление
Индивидуальная работа
Что такое металлическая связь?
Какие силы существуют между катионами и электронами в металлической кристаллической решетке?
Почему медь проводит электрический ток?
Почему железо обладает ковкостью?
Опираясь на расположение металлов в ПСХЭ, сравните температуры плавления у металлов проставьте знаки «˃» «˂» между парами металлов:
Na Cu
Ca Fe
Mg Al
Объясните свой выбор

Что такое металлическая связь? Вид химической связи между катионами металлов и электронами
Какие силы существуют между катионами и электронами в металлической кристаллической решетке? Электростатические силы притяжения
Почему медь проводит электрический ток? В кристаллической решетке имеются делокализованные электроны, которые под действием электрического тока принимают направленное движение
Почему железо обладает ковкостью? Делокализованные электроны не дают разрушиться слоям катионов в кристаллической решетке Опираясь на расположение металлов в ПСХЭ, сравните температуры плавления у металлов проставьте знаки «˃» «˂» между парами металлов:
Na ˂ Cu
Ca ˂ Fe
Mg ˂ Al
Объясните свой выбор: плотность щелочных и щелочноземельных металлов меньше, чем у других металлов, переход из твердого состояния в жидкое требует меньше энергии
Читайте также:
