Общая характеристика щелочных металлов 9 класс
Обновлено: 01.05.2024
На основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов, межпредметные связи химии с биологией, физикой, медициной используя области применения основных соединений щелочных металлов, роль этих металлов в жизни человека.
Задачи урока:
Образовательные:
Сформировать знания о строении атома и свойствах щелочных металлов;
Совершенствовать экспериментальные умения и навыков учащихся.
Развивающие:
Сформировать навыки анализа и сопоставления известных химических фактов.
Совершенствовать умения логически мыслить.
Развить умения обобщать и делать правильные выводы из изученного материала.
Продолжить развитие умений переносить знания в новые ситуации и устанавливать межпредметные связи.
Воспитательные:
Создать условия для воспитания желания активно учиться, с интересом, без принуждения и перегрузок.
Продолжить развитие речевых навыков.
Продолжить развитие наблюдательности и умения делать выводы на основе наблюдаемого интереса к предмету и представлений.
Выработка положительной мотивации учения, чувства ответственности и уверенности в себе.
I. Организационный момент.
II. Вводное слово.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы изучили общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
III. Проверка домашнего задания.
IV. Актуализация знаний.
- На какие две большие группы происходит деление химических элементов?
- На металлы и неметаллы
- Где находятся металлы в периодической системе Д.И. Менделеева.
- В периодической системе элементы – металлы расположены в начале всех периодов, а также в четных рядах больших периодов побочных подгруппах. Условной границей, отделяющей металлы от неметаллов, служит диагональ, отведенная от бора к астату. Металлы оказываются левее и ниже этой прямой, неметаллы – правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, их называют амфотерными.
- Какие группы естественных семейств в периодической системе мы знаем?
– Мы знаем особые группы отдельных металлов: щелочные металлы, щелочно-земельные металлы, редкоземельные металлы (иттрий, лантан и лантаноиды).
– Благородные металлы (серебро, золото и шесть платиновых металлов) . Платиновые металлы (платиноиды, рутений, родий, палладий, осмий, иридий, платина) металлы подгруппы алюминия.
– Каковы особенности строения атомов металлов?
- Атомы металлов имеют сравнительно большие атомные радиусы, поэтому их внешние электроны значительно удалены от ядра и слабо сними связаны. И вторая особенность, которая присуща атомам наиболее активных металлов – это наличие на внешнем энергетическом уровне 1-3 электронов.
- Как особенности строения атома влияют на физические свойства?
- Характерные физические свойства металлов металлический блеск, электрическая проводимость, теплопроводность, Связана с особенностью строения кристаллических решеток атомов металлов. В узлах располагаются атомы и положительные ионы металлов, связанные посредством обобществленных внешних электронов, которые принадлежат всему кристаллу, эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решетки.
- Как особенности строения металлов влияют на их химические свойства?
- Самое характерное химическое свойство всех металлов – их восстановительная способность, т.е. способность атомов легко отдавать свои внешние электроны, превращаясь в положительные ионы. Металлы не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
V. Изучение нового материала
Учитель: Тема нашего урока “Щелочные металлы”
Задачи нашего урока:
-Дать общую характеристику щелочным металлам.
-Рассмотреть их электронное строение, сравнить физические и химические свойства.
-Узнать о важнейших соединениях металлов.
-Определить области применения этих соединений.
- Что мы будем изучать в этой теме? Каков наш план урока?
- Мы будем изучать положение щелочных металлов в периодической системе; строение атома щелочных металлов, физические и химические свойства и применение щелочных металлов.
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
1 . Перечислите щелочные металлы
- Это литий, натрий, калий, рубидий, цезий, франций.
Li (1817) лат. " литос" - камень
Na (1807) араб. "натрум" -сода
К (1807) араб. "алкали" - щелочь
Rb (1861) лат. "рубидус" - темно-красный
Cs (1860) лат. "цезиус" - небесно-голубой
Fr (1939) от названия страны Франция.
2. Почему данные металлы назвали щелочными?
- При взаимодействии с водой они образуют растворимые в воде основания – щелочи.
3. Где располагаются щелочные металлы в ПСХЭ Д.И.Менделеева ?
- Щелочные металлы – это элементы главной подгруппы первой группы Периодической системы Д.И. Менделеева.
4.Почему данные металлы Д.И. Менделеев объединил в одну группу?
- На внешнем энергетическом уровне атомы элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1.
- Просматриваем кадры виртуальной лаборатории, вы внимательно смотрите и готовите ответы на вопросы.
(Кадры о положение в периодической системе и строение атома)
5. Какую степень окисления проявляют щелочные металлы в соединениях?
- Щелочные металлы проявляют степень окисления + 1
6. Как изменяются восстановительные свойства щелочных металлов от лития к цезию?
Ученик: От лития к цезию восстановительные свойства усиливаются, активный металл цезий. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
- Сделаем вывод о строении атома щелочных металлов.
- Вывод: У щелочных металлов одинаковое количество электронов на внешнем уровне, и они проявляют одинаковую степень окисления.
Учитель: Записать строение атомов щелочных металлов в тетрадь.
Итак, мы рассмотрели положение щелочных металлов в периодической системе, рассмотрели строение атомов щелочных металлов.
- Обратим внимание на коллекцию щелочных металлов, их хранят в керосине, легко режутся ножом и быстро окисляются на воздухе. Исходя из строения атома, познакомимся с физическими свойствами щелочных металлов. Для металлов характерна низкая твердость, вернее мягкость, труднее всего резать литий, тогда как натрий и калий легко поддаются скальпелю. На основании таблицы, сделаем вывод о физических свойствах щелочных металлов.
Некоторые физические свойства щелочных металлов
В природе не существует в таких количествах, которые достаточны для изучения его свойств.
- Каков внешний вид и твердость щелочных металлов?
- Щелочные металлы серебристо-белые вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности.
- С возрастанием радиуса атома, от лития к цезию, наблюдается закономерность в их физических свойствах. Обратите внимание на таблицу. Как изменяется плотность щелочных металлов в группе?
- Все они легкие и легкоплавкие плотность их меньше 5 г/см 3 ,
- Сравните щелочные металлы по твердости.
- Самый твердый из щелочных металлов литий, самый легкий цезий.
- Сделаем вывод исходя из физических свойств щелочных металлов.
- По мере увеличения характера изменения физических свойств, возрастает плотность металлов, а твердость, температура плавления и кипения уменьшаются.
Затем учащиеся сравнивают физические показатели плотности металлов и температуры плавления. Делают вывод о зависимости температуры плавления от плотности металла.
Проблема: В каком виде щелочные металлы встречаются в природе?
Почему в природе щелочные металлы в основном существуют в виде соединений?
Ответ: В природе щелочные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие одного неспаренного электрона на внешнем энергетическом уровне)
- Какие места по распространенности в земной коре занимают элементы натрий и калий?
Натрий шестое, а калий седьмое.
Физкультминутка – отдых глазам.
- Зная общие физические свойства, активность металлов, предположите химические свойства щелочных металлов. С какими веществами взаимодействуют щелочные металлы?
- Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
- А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочных металлов, для этого предлагаю посмотреть виртуальные опыты.
- Записывает химические свойства щелочных металлов.
Характерным свойством щелочных металлов является окрашивание пламени.
Демонстрируется виртуальный опыт.
Прокаливается железная проволока до тех пор, пока не перестанет ею окрашиваться пламя, затем вносится в пламя на кончике проволоки раствор соли натрия. Наблюдаем окрашивание пламени ионами натрия в желтый цвет. Затем протирается проволока о руку и вновь вносится в пламя. Снова наблюдаем окрашивание пламени спиртовки в желтый цвет.
Желтое свечение паров натрия использовался 3 января 1959 г в полете одной из советских космических ракет для определения ее местонахождения в момент выбрасывания из нее паров натрия по сигналу с Земли.
Опыт повторяется, используя хлорид калия. Наблюдаем окрашивание пламени в фиолетовый цвет.
Учитель о применение щелочных металлов и их соединений:
В свободном виде в природе ЩМ не встречаются из-за своей исключительно высокой химической активности.
NaCl- хлорид натрия, поваренная соль.
Na 2 CO 3 – карбонат натрия, кристаллическая сода, применяют в производстве стекла, мыла, бумаги.
NaHCO 3 – гидрокарбонат натрия, пищевая сода (в быту), питьевая сода (в медицине).
NaOH – гидроксид натрия, Шуманит – средство для чистки кухонных поверхностей.
Na 2 SO 4 ∙10 H 2 O – сульфат натрия, глауберова соль, применяют для производства соды, стекла, в качестве слабительного средства.
KOH – гидроксид калия, едкое кали, применяется в качестве электролита в щелочных аккумуляторах.
Задача: почему в Англии в последние десятилетия наблюдается снижение смертности от болезней сосудов головного мозга?
Научно-популярная информация - подсказка: Это связано с увеличением потребления свежих фруктов и овощей. В свежих овощах и фруктах всегда много калия и мало натрия. Натрий задерживает воду в организме, повышая артериальное давление, а калий, напротив, способствует его снижению. Вот почему увеличение потребления овощей, фруктов, в частности яблок, можно рассматривать как существенную меру предупреждения болезней сосудов головного мозга.
Ученик делает вывод:
На основании положения щел очных металлов в периодической системе и строения их атомов можно сделать вывод, что эти мет аллы представляют собой активные вещества. В химических реакциях они проявляют металлические свойства, то есть являются восстановителями. С увеличением заряда я дра распространенность щелочных металлов в природе уменьшается, поэтому литий, нат рий и калий широко распространены в природе, рубидий и цезий относятся к редким элементам, а франция на Земле чрезвычайно мало.
Сами щелочные металлы применяются в промышленности. Однако их соединения распространены значительно шир е.
VI. Закрепление изученного материала.
Выполните тест.
1.К щелочным металлам не относится: а) рубидий; в) калий; б) цезий; г) медь.
2.Электронная формула ) 2 ) 8 ) 8 ) 1 соответствует элементу: а) литию; в) калию; б) натрию;
3.Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически; в) не изменяется; б) увеличивается;
4.Щелочные металлы проявляют очень сильные:
а) окислительные свойства; в) восстановительные свойства; б) амфотерные свойства;
5.К физическим свойствам щелочных металлов не относится:
а) серебристо-белые; б) мягкие и легки; г) тугоплавкие.
6.При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота; б) щелочь и выделяется водород; г) соль .
7.Натрий и калий хранят в керосине , потому что они:
а) имеют резкий запах; б) легко окисляются на воздухе;
1. Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Общая характеристика щелочных металлов 9 класс
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
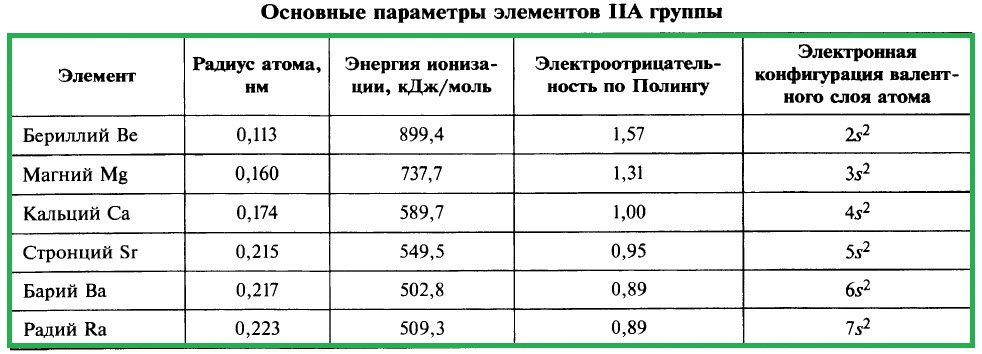
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:

Щелочные металлы. Элементы IA-группы
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.

Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns 1 , где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см 3 ), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
Элемент
Окраска пламени
Li
Rb
Na
Cs
К
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид: При сгорании натрия обычно образуется пероксид (Na2O2):Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом:
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.

Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода:
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):Щелочные металлы находят широкое применение в промышленности и в технике:
- литий – в литий-ионных аккумуляторах, в термоядерной энергетике для получения изотопа водорода – трития, а также в качестве теплоносителя в ядерных реакторах;
- натрий используют как теплоноситель в ядерных реакторах, для синтеза некоторых органических соединений (например, как катализатор в синтезе каучука, как активный восстановитель в других реакциях, часто в сплаве с калием), в металлотермии (натрийтермия);
- цезий легко теряет электроны даже под действием света, поэтому он применяется в фотоэлементах.
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
NaOH – едкий натр (каустическая сода),
NaCl – поваренная соль,
NaNO3 – чилийская селитра,
Na2SO4 • 10H2O – глауберова соль,
Na2CO3 • 10H2O – сода кристаллическая,
КОН – едкое кали,
КCl – хлорид калия, входит в состав калийной соли (NaCl • КCl + КCl),
KNO3 – индийская селитра,
К2СO3 – поташ.
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
Читайте также:
