Оксиды металлов могут быть
Обновлено: 16.05.2024
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
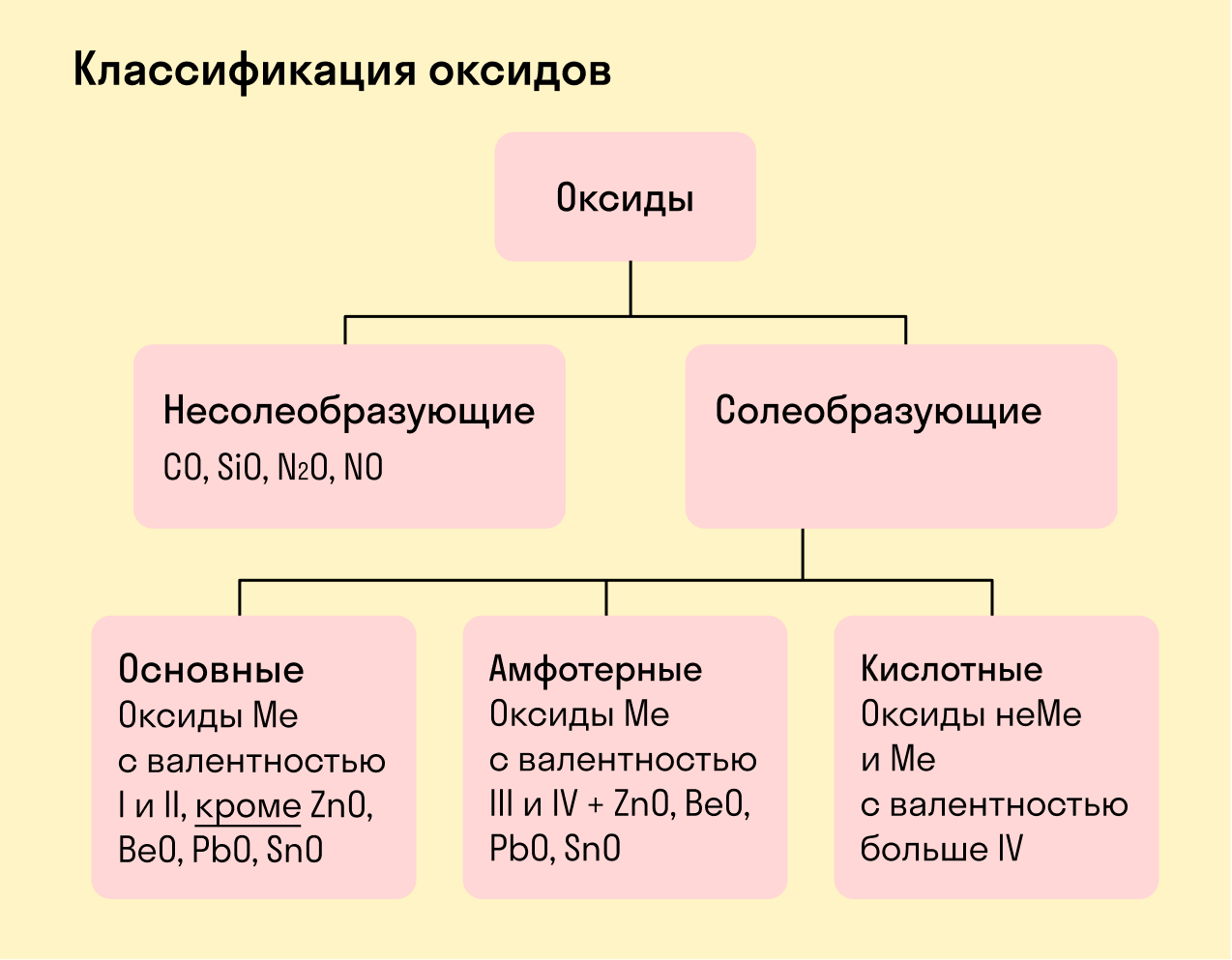
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов

Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Оксиды

Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
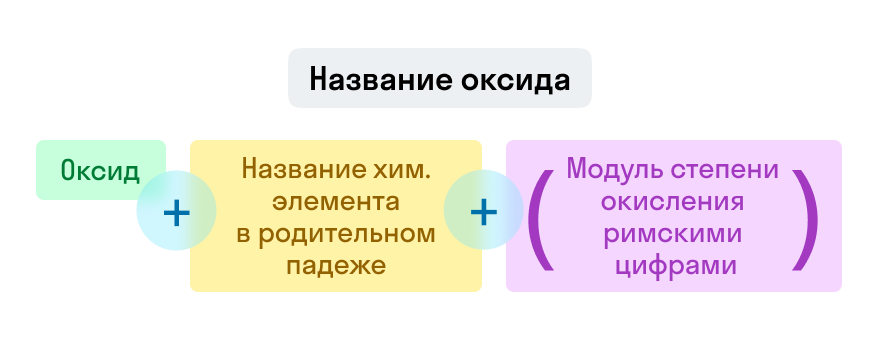
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
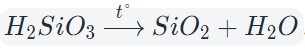
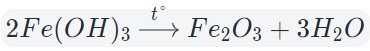
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Свойства, номенклатура, применение и примеры оксидов металлов
оксиды металлов это неорганические соединения, образованные металлическими катионами и кислородом. Они обычно содержат огромное количество ионных твердых веществ, в которых оксид аниона (O 2- ) электростатически взаимодействует с видами М + .
M + это любой катион, полученный из чистого металла: от щелочных и переходных металлов, за исключением некоторых благородных металлов (таких как золото, платина и палладий), до более тяжелых элементов блока p периодической таблицы ( как свинец и висмут).

Верхнее изображение показывает железную поверхность, покрытую красноватыми корками. Эти «корочки» - это то, что известно как ржавчина или ржавчина, которые, в свою очередь, представляют собой визуальный тест на окисление металла в зависимости от условий его окружающей среды. Химически ржавчина представляет собой гидратированную смесь оксидов железа (III).
Почему окисление металла приводит к деградации его поверхности? Это связано с включением кислорода в кристаллическую структуру металла.
Когда это происходит, объем металла увеличивается, а исходные взаимодействия ослабевают, что приводит к разрушению твердого тела. Кроме того, эти трещины позволяют большему количеству молекул кислорода проникать во внутренние металлические слои, поглощая весь кусок изнутри..
Однако этот процесс происходит на разных скоростях и зависит от природы металла (его реакционной способности) и физических условий, которые его окружают. Следовательно, существуют факторы, которые ускоряют или замедляют окисление металла; два из них - наличие влаги и pH.
Почему? Поскольку окисление металла с образованием оксида металла подразумевает перенос электрона. Они "путешествуют" от одного химического вида к другому, пока среда способствует этому, либо присутствием ионов (H + , не доступно + , мг 2+ , Cl - , и т. д.), которые изменяют рН, или молекулами воды, которые обеспечивают транспортные средства.
Аналитически тенденция металла образовывать соответствующий оксид отражается в его восстановительных потенциалах, которые показывают, какой металл реагирует быстрее по сравнению с другим.
Золото, например, имеет гораздо больший восстановительный потенциал, чем железо, поэтому оно сияет своим характерным золотым свечением без оксида, который его размывает..
- 1 Свойства неметаллических оксидов
- 1.1 Основность
- 1.2 Амфотеризм
- 2.1 Традиционная номенклатура
- 2.2 Систематическая номенклатура
- 2.3 Товарная номенклатура
- 2.4 Расчет числа валентностей
- 3.1 Прямая реакция металла с кислородом
- 3.2 Реакция солей металлов с кислородом
- 5.1 Оксиды железа
- 5.2 Щелочные и щелочноземельные оксиды
- 5.3 Группа IIIA оксидов (13)
Свойства неметаллических оксидов
![]()
Свойства оксидов металлов варьируются в зависимости от металла и того, как он взаимодействует с анионом О 2- . Это влечет за собой то, что некоторые оксиды имеют более высокую плотность или растворимость в воде, чем другие. Однако все они имеют общий металлический характер, что неизбежно отражается на его основности..
Другими словами: они также известны как основные ангидриды или основные оксиды.
основность
Основность оксидов металлов может быть проверена экспериментально с использованием кислотно-основного индикатора. Как? Добавление небольшого куска оксида в водный раствор с небольшим количеством растворенного индикатора; это может быть сжиженный сок фиолетовой капусты.
Имея диапазон цветов в зависимости от pH, оксид превратит сок в голубоватый цвет, соответствующий базовому pH (со значениями от 8 до 10). Это потому, что растворенная часть оксида высвобождает ионы ОН - к окружающей среде, будучи в эксперименте ответственными за изменение pH.
Таким образом, для оксида МО, который растворяется в воде, он превращается в гидроксид металла («гидратированный оксид») в соответствии со следующими химическими уравнениями:
Второе уравнение представляет собой баланс растворимости гидроксида М (ОН)2. Обратите внимание, что металл имеет заряд 2+, что также означает, что его валентность равна +2. Валентность металла напрямую связана с его тенденцией к получению электронов.
амфотерность
Оксиды металлов являются основными, однако не все имеют одинаковый металлический характер. Как узнать? Расположение металла М в периодической таблице. Чем больше он находится слева от него и в более низкие периоды, тем более металлическим он будет и, следовательно, более основным будет его оксид.
На границе между основными и кислотными оксидами (неметаллическими оксидами) находятся амфотерные оксиды. Здесь слово «амфотерный» означает, что оксид действует и как основание, и как кислота, что так же, как в водном растворе, он может образовывать гидроксид или водный комплекс М (ОН2)6 2+ .
Водный комплекс - не более чем координация N молекулы воды с металлическим центром М. Для комплекса М (ОН2)6 2+ , металл М 2+ Он окружен шестью молекулами воды и может рассматриваться как гидратированный катион. Многие из этих комплексов проявляют интенсивную окраску, такую как наблюдаемая для меди и кобальта.
номенклатура
Как называются оксиды металлов? Есть три способа сделать это: традиционный, систематический и фондовый.
Традиционная номенклатура
Чтобы правильно назвать оксид металла в соответствии с правилами, регулируемыми IUPAC, необходимо знать возможные валентности металла М. Самому большому (наиболее положительному) присваивается название металла суффикс -ico, тогда как минор, префикс -oso.
Пример: с учетом валентностей +2 и +4 металла М его соответствующими оксидами являются МО и МО2. Если бы М был свинцом, Pb, то PbO был бы оксидным отвесомнести, и PbO2 оксидная сливаICO. Если металл имеет только одну валентность, он называется его оксидом с суффиксом -ico. Итак, На2Или это оксид натрия.
Тем не менее, этот тип номенклатуры представляет определенные трудности и обычно используется наименее.
Систематическая номенклатура
Он учитывает количество атомов М и кислорода, составляющих химическую формулу оксида. Из них ему назначены соответствующие префиксы: моно-, ди-, три-, тетра- и т. Д..
На примере трех недавних оксидов металлов PbO является моноксидом свинца; PbO2 диоксид свинца; и Na2Или окись динатрия. Для случая ржавчины, Fe2О3, его соответствующее название является триоксидом дигеро.
Товарная номенклатура
В отличие от двух других номенклатур, в этом валентность металла имеет большее значение. Валентность указывается римскими цифрами в скобках: (I), (II), (III), (IV) и т. Д. Оксид металла тогда называют оксидом металла (n).
Применяя номенклатуру запаса для предыдущих примеров, мы имеем:
-PbO: оксид свинца (II).
-PbO2: оксид свинца (IV).
-не доступно2О: оксид натрия. Поскольку он имеет уникальную валентность +1, он не указан.
-Миннесота2О7: оксид марганца (VII).
Расчет числа валентностей
Но если у вас нет периодической таблицы с валентностями, как вы можете их определить? Для этого мы должны помнить, что анион O 2- он вносит два отрицательных заряда в оксид металла. Следуя принципу нейтральности, эти отрицательные заряды должны быть нейтрализованы положительными зарядами металла..
Поэтому, если число атомов кислорода известно по химической формуле, валентность металла может быть определена алгебраически, так что сумма зарядов дает ноль.
Mn2О7 имеет семь атомов кислорода, то его отрицательные заряды равны 7х (-2) = -14. Чтобы нейтрализовать отрицательный заряд -14, марганец должен обеспечить +14 (14-14 = 0). Положить математическое уравнение тогда:
2 происходит из-за того, что есть два атома марганца. Решаем и очищаем Х, валентность металла:
Как они образовались?
Влажность и рН напрямую влияют на окисление металлов в их соответствующих оксидах. Наличие СО2, Оксид кислоты может быть достаточно растворен в воде, которая покрывает металлическую часть, чтобы ускорить введение кислорода в анионной форме в кристаллическую структуру металла..
Эту реакцию также можно ускорить с повышением температуры, особенно когда желательно получить оксид за короткое время..
Прямая реакция металла с кислородом
Оксиды металлов образуются как продукт реакции между металлом и окружающим кислородом. Это может быть представлено с помощью химического уравнения ниже:
Эта реакция медленная, так как кислород имеет сильную двойную связь O = O и электронный перенос между ним и металлом неэффективен.
Тем не менее, он значительно ускоряется с увеличением температуры и площади поверхности. Это связано с тем, что энергия, необходимая для разрыва двойной связи O = O, обеспечивается, и, поскольку существует большая площадь, кислород равномерно движется по всему металлу, одновременно сталкиваясь с атомами металла..
Чем больше количество реагента кислорода, тем больше валентность или степень окисления, возникающая для металла. Почему? Поскольку кислород захватывает все больше электронов из металла, пока он не достигнет максимальной степени окисления.
Это можно увидеть, например, для меди. Когда кусок металлической меди реагирует с ограниченным количеством кислорода, образуется медь2O (оксид меди (I), оксид меди или двуокись диоксида):
4Cu (s) + O2(г) + Q (тепло) => 2Cu2O (s) (красное твердое вещество)
Но когда он реагирует в эквивалентных количествах, получается CuO (оксид меди (II), оксид меди или оксид меди):
2Cu (s) + O2(г) + Q (нагрев) => 2CuO (s) (сплошной черный цвет)
Реакция солей металлов с кислородом
Оксиды металлов могут образовываться в результате термического разложения. Чтобы это было возможно, одна или две маленькие молекулы должны быть освобождены от исходного соединения (соли или гидроксида):
Обратите внимание, что H2O, CO2, НЕТ2 и O2 высвобождаются ли молекулы.
приложений
Из-за богатого состава металлов в земной коре и кислорода в атмосфере оксиды металлов обнаруживаются во многих минералогических источниках, из которых можно получить твердую основу для производства новых материалов..
Каждый оксид металла находит очень специфическое применение: от пищевых (ZnO и MgO) до цементных добавок (CaO) или просто в виде неорганических пигментов (Cr).2О3).
Некоторые оксиды настолько плотны, что контролируемый рост их слоев может защитить сплав или металл от дальнейшего окисления. Даже исследования показали, что окисление защитного слоя происходит так, как если бы это была жидкость, покрывающая все трещины или поверхностные дефекты металла..
Оксиды металлов могут принимать захватывающие структуры в виде наночастиц или крупных полимерных агрегатов..
Этот факт делает их предметом исследований для синтеза интеллектуальных материалов из-за его большой площади поверхности, которая используется для разработки устройств, которые реагируют на наименьший физический стимул.
Аналогично, оксиды металлов являются сырьем для многих технологических применений, от зеркал и керамики с уникальными свойствами для электронного оборудования до солнечных батарей..
примеров
Оксиды железа
2Fe (s) + O2(г) => 2FeO (s) оксид железа (II).
6FeO (s) + O2(г) => 2Fe3О4(s) Магнитный оксид железа.
Вера3О4, также известный как магнетит, это смешанный оксид; Это означает, что он состоит из твердой смеси FeO и Fe2О3.
Щелочные и щелочноземельные оксиды
Как щелочные, так и щелочноземельные металлы имеют одну степень окисления, поэтому их оксиды являются более «простыми»:
-не доступно2O: оксид натрия.
-CaO: оксид кальция.
-MgO: оксид магния.
-BeO: оксид бериллия (амфотерный оксид)
Группа IIIA оксиды (13)
Элементы группы IIIA (13) могут образовывать оксиды только с степени окисления +3. Таким образом, они имеют химическую формулу М2О3 и его оксиды следующие:
Номенклатура оксидов, типы, свойства и примеры
оксиды они представляют собой семейство бинарных соединений, в которых существуют взаимодействия между элементом и кислородом. Таким образом, оксид имеет очень общую формулу типа EO, где E - любой элемент.
В зависимости от многих факторов, таких как электронная природа E, его ионный радиус и валентность, могут образовываться различные типы оксидов. Некоторые очень просты, а другие, как Pb3О4, (называется minium, arcazón или красный свинец) смешанные; то есть они являются результатом комбинации более чем одного простого оксида.
![]()
Но сложность оксидов может пойти дальше. Существуют смеси или структуры, в которые может вмешиваться более одного металла, и где, кроме того, пропорции не являются стехиометрическими. В случае свинца3О4, отношение Pb / O равно 3/4, причем числитель и знаменатель являются целыми числами.
В нестехиометрических оксидах пропорции являются десятичными числами. E0,75О1,78, является примером гипотетического нестехиометрического оксида. Это явление происходит с так называемыми оксидами металлов, особенно с переходными металлами (Fe, Au, Ti, Mn, Zn и т. Д.)..
Однако существуют оксиды, характеристики которых намного проще и дифференцируемы, как и ионный или ковалентный характер. В тех оксидах, где преобладает ионный характер, они будут состоять из катионов E + и анионы O 2- ; и эти чисто ковалентные, простые (E-O) или двойные (E = O) звенья.
То, что диктует ионный характер оксида, является разницей электроотрицательности между E и O. Когда E является очень электроположительным металлом, тогда EO будет иметь высокий ионный характер. Принимая во внимание, что если E является электроотрицательным, а именно неметаллическим, его оксид EO будет ковалентным.
Это свойство определяет многие другие свойства оксидов, а также их способность образовывать основания или кислоты в водном растворе. Отсюда возникают так называемые основные и кислотные оксиды. Те, кто не ведет себя одинаково или проявляют обе характеристики, являются нейтральными или амфотерными оксидами..
- 1 Номенклатура
- 1.1 Систематическая номенклатура
- 1.2 Номенклатура акций
- 1.3 Традиционная номенклатура
- 2.1 Основные оксиды
- 2.2 Кислоты
- 2.3 Нейтральные оксиды
- 2.4 Амфотерные оксиды
- 2.5 Смешанные оксиды
- 5.1 Оксиды переходных металлов
- 5.2 Дополнительные примеры
Есть три способа упомянуть оксиды (которые также применимы ко многим другим соединениям). Они верны независимо от ионного характера оксида ЭО, поэтому их названия ничего не говорят об их свойствах или структуре.
Учитывая оксиды ЕО, Е2О, Е2О3 и ЭО2, На первый взгляд вы не можете знать, что стоит за вашими химическими формулами. Тем не менее, цифры указывают на стехиометрические пропорции или отношение E / O. Из этих номеров им могут быть даны имена, даже если не указано, с какой валентностью «работает» E.
Номера атомов для E и O указываются греческими префиксами. Таким образом, моно- означает, что существует только один атом; ди-, два атома; три-, три атома и т. д..
Итак, названия предыдущих оксидов в соответствии с систематической номенклатурой:
-Это шиньонE (EO) оксид.
-Это шиньонокисел диE (E2O).
-Triоксид диE (E2О3).
-диE оксид (EO2).
Применяя затем эту номенклатуру для свинца3О4, красный оксид первого изображения, мы имеем:
Pb3О4: тетраоксид тривести.
Для многих смешанных оксидов или с высокими стехиометрическими соотношениями очень полезно прибегнуть к систематической номенклатуре, чтобы назвать их.
Валенсия
Хотя неизвестно, какой элемент является Е, достаточно с отношением Е / О знать, какую валентность он использует в своем оксиде. Как? Через принцип электронейтральности. Для этого необходимо, чтобы сумма зарядов ионов в соединении была равна нулю.
Это сделано, предполагая высокий ионный характер для любого оксида. Таким образом, O имеет заряд -2, потому что это O 2- , и E должен обеспечить n +, чтобы нейтрализовать отрицательные заряды оксидного аниона.
Например, в EO атом E работает с валентностью +2. Почему? Потому что иначе он не смог бы нейтрализовать нагрузку -2 единственного О. Для Е2Или E имеет валентность +1, так как заряд +2 должен быть разделен между двумя атомами E.
И в Е2О3, сначала необходимо рассчитать отрицательные заряды, вносимые О. Поскольку их три, тогда: 3 (-2) = -6. Для нейтрализации нагрузки -6 требуется, чтобы Е обеспечивало +6, но поскольку их два, +6 делится на два, в результате чего Е имеет валентность +3.
Мнемоническое правило
О всегда имеет валентность -2 в оксидах (если это не перекись или супероксид). Таким образом, мнемоническое правило для определения валентности E состоит в том, чтобы просто учитывать число, которое сопровождает O. E, с другой стороны, будет иметь число 2, сопровождающее его, и если нет, это означает, что произошло упрощение..
Например, в EO валентность E равна +1, потому что даже если она не записана, есть только один O. И для EO2, в отсутствие 2, сопровождающего E, произошло упрощение, и для его появления необходимо умножить на 2. Таким образом, формула остается в виде E2О4 и валентность Е тогда равна +4.
Однако это правило не выполняется для некоторых оксидов, таких как Pb3О4. Поэтому всегда необходимо проводить расчеты нейтралитета..
Из чего он состоит?
Имея валентность E под рукой, номенклатура акций состоит из указания ее в круглых скобках и с римскими цифрами. Из всех номенклатур это самый простой и точный в отношении электронных свойств оксидов..
Если E, с другой стороны, имеет только одну валентность (которую можно найти в периодической таблице), то она не указана.
Таким образом, для оксида EO, если E имеет валентность +2 и +3, он называется: оксид (название E) (II). Но если E имеет только валентность +2, то его оксид называется: оксид (имя E).
Чтобы упомянуть название оксидов, к их латинским названиям следует добавить суффиксы -ico или -oso для больших или меньших валентностей. Если их больше двух, то префиксы -hype для самых маленьких и -per для самых больших из всех.
Например, свинец работает с валентностями +2 и +4. В PbO он имеет валентность +2, поэтому он называется: окись свинца. В то время как PbO2 Это называется: Plúmbico оксид.
И Pb3О4, Как это называется в соответствии с двумя предыдущими номенклатурами? У него нет имени. Почему? Потому что Pb3О4 на самом деле состоит из смеси 2 [PbO] [PbO2]; то есть красное твердое вещество имеет двойную концентрацию PbO.
По этой причине было бы неправильно пытаться дать имя Pb3О4 который не состоит из систематической номенклатуры или популярного сленга.
Типы оксидов
В зависимости от того, какой частью таблицы Менделеева является E и, следовательно, его электронной природы, может быть сформирован тот или иной тип оксида. Отсюда возникает множество критериев для присвоения им типа, но наиболее важными являются критерии, связанные с их кислотностью или основностью..
Основные оксиды
Основные оксиды характеризуются тем, что они являются ионными, металлическими и, что более важно, образуют основной раствор при растворении в воде. Чтобы экспериментально определить, является ли оксид основным, его необходимо добавить в емкость с водой и универсальным индикатором, растворенным в нем. Его окраска перед добавлением оксида должна быть зеленой, нейтральный pH.
Как только оксид добавлен в воду, если его цвет меняется с зеленого на синий, это означает, что pH стал основным. Это потому, что он устанавливает баланс растворимости между образующимся гидроксидом и водой:
EO (s) + H2O (l) => E (OH)2(S), Е 2+ (ac) + OH - (Aq)
Хотя оксид нерастворим в воде, для растворения небольшой части достаточно, чтобы изменить рН. Некоторые основные оксиды настолько растворимы, что образуют едкие гидроксиды, такие как NaOH и KOH. То есть оксиды натрия и калия, Na2О и К2Или они очень простые. Обратите внимание на валентность +1 для обоих металлов.
Кислотные оксиды
Кислотные оксиды характеризуются наличием неметаллического элемента, являются ковалентными, а также образуют кислотные растворы с водой. Опять же, его кислотность можно проверить с помощью универсального индикатора. Если на этот раз при добавлении оксида в воду его зеленый цвет станет красноватым, то это кислотный оксид.
Какая реакция имеет место? Следующее:
Примером кислотного оксида, который является не твердым веществом, а газом, является СО2. Когда он растворяется в воде, он образует углекислоту:
Кроме того, СО2 Он не состоит из анионов ИЛИ 2- и катионы C 4+ , но в молекуле, образованной ковалентными связями: O = C = O. Это, пожалуй, одно из самых больших различий между основными оксидами и кислотами.
Нейтральные оксиды
Эти оксиды не изменяют зеленый цвет воды при нейтральном pH; то есть они не образуют ни гидроксиды, ни кислоты в водном растворе. Вот некоторые из них: N2O, NO и CO. Как и СО, они имеют ковалентные связи, которые могут быть проиллюстрированы структурами Льюиса или любой теорией связи..
Амфотерные оксиды
Другой способ классификации оксидов зависит от того, реагируют ли они с кислотой или нет. Вода - очень слабая кислота (и основа тоже), поэтому амфотерные оксиды не имеют «обеих сторон». Эти оксиды характеризуются взаимодействием как с кислотами, так и с основаниями..
Оксид алюминия, например, представляет собой амфотерный оксид. Следующие два химических уравнения представляют их реакцию с кислотами или основаниями:
Аль2(SO4)3 соль сульфата алюминия и NaAl (OH)4 комплексная соль под названием тетрагидроксин алюминат натрия.
Оксид водорода, Н2Или (вода), она также амфотерна, и об этом свидетельствует ее ионизационное равновесие:
Смешанные оксиды
Смешанные оксиды - это те, которые состоят из смеси одного или нескольких оксидов в одном и том же твердом веществе. Pb3О4 Это пример их. Магнетит, Вера3О4, это также еще один пример смешанного оксида. Вера3О4 Это смесь FeO и Fe2О3 в пропорциях 1: 1 (в отличие от свинца)3О4).
Смеси могут быть более сложными, что приводит к образованию разнообразных оксидных минералов..
свойства
Свойства оксидов зависят от их типа. Оксиды могут быть ионными (Е N+ О 2- ), такой как CaO (Ca 2+ О 2- ), или ковалентный, как SO2, O = S = O.
Исходя из этого факта и тенденции элементов реагировать с кислотами или основаниями, для каждого оксида собирается ряд свойств..
Кроме того, вышесказанное отражается на физических свойствах, таких как точки плавления и кипения. Ионные оксиды имеют тенденцию образовывать кристаллические структуры, которые очень устойчивы к нагреванию, поэтому их точки плавления высоки (выше 1000ºC), в то время как ковалентные продукты плавятся при низких температурах, или даже газы или жидкости.
![]()
Оксиды образуются, когда элементы реагируют с кислородом. Эта реакция может происходить при простом контакте с атмосферой, богатой кислородом, или требует нагревания (например, пламя прикуривателя). То есть когда объект сжигается, он реагирует с кислородом (пока он присутствует в воздухе).
Например, если взять кусок фосфора и поместить его в пламя, он сгорит и образует соответствующий оксид:
Во время этого процесса некоторые твердые вещества, такие как кальций, могут гореть ярким и ярким пламенем.
Другой пример получен сжиганием древесины или любого органического вещества, которое обладает углеродом:
Но при кислородной недостаточности вместо СО образуется СО2:
Обратите внимание, как отношение C / O используется для описания различных оксидов.
Примеры оксидов
![]()
Верхнее изображение соответствует структуре ковалентного оксида I2О5, самая стабильная форма йода. Обратите внимание на его простые и двойные связи, а также формальные заряды I и кислорода к его боковым.
Оксиды галогенов характеризуются тем, что они являются ковалентными и очень реакционноспособными, как, например, случаи O2F2 (F-O-O-F) и OF2 (Р-О-Р). Диоксид хлора, ClO2, например, это единственный оксид хлора, который синтезируется в промышленных масштабах.
Поскольку галогены образуют ковалентные оксиды, их «гипотетические» валентности рассчитываются одинаково по принципу электронейтральности..
Оксиды переходных металлов
Помимо оксидов галогенов, у нас есть оксиды переходных металлов:
-CoO: оксид кобальта (II); оксид кобальта; ты окись кобальта.
-HgO: оксид ртути (II); оксид ртути; ты окись ртути.
-Ag2О: оксид серебра; оксид серебра; или окись диплата.
-Au2О3: оксид золота (III); оксид золотистого цвета; или диоксид триоксида.
Дополнительные примеры
-В2О3оксид бора; оксид борной кислоты; или диборо триоксид.
-Cl2О7: оксид хлора (VII); хлорная окись; дихлор гептоксид.
Читайте также:




