Олово активный металл или нет
Обновлено: 04.05.2024
Температура плавления, ° С 231,9 Температура кипения, ° С 2625 Плотность, г/см3 7,29 Твердость (по Бринеллю) 3,9 Содержание в земной коре, % (масс.) 0,0004 Степени окисления +2, +4
Физические свойства. Олово - мягкий серебристо-белый пластичный металл (может быть прокатан в очень тонкую фольгу - станиоль) с невысокой температурой плавления (легко выплавляется из руд), но высокой температурой кипения. Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок ("оловянная чума"), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес. См. также
АЛЛОТРОПИЯ;
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. Оловосодержащие сплавы обладают прекрасными антифрикционными свойствами в присутствии смазки, поэтому широко используются как материал подшипников.
Химические свойства. При комнатной температуре олово химически инертно к кислороду и воде. На воздухе олово постепенно покрывается защитной оксидной пленкой, которая повышает его коррозионную стойкость. С химической инертностью олова и его оксидной пленки в обычных условиях связано использование его в покрытии жестяной тары для продуктов питания, прежде всего - консервных банок. Олово легко наносится на сталь и продукты его коррозии безвредны. В соединениях олово проявляет две степени окисления: +2 и +4, причем соединения олова(II) в большинстве своем относительно нестабильны в разбавленных водных растворах и окисляются до соединений олова(IV) (их используют иногда как восстановители, например SnCl2). Разбавленные соляная и серная кислоты действуют на олово очень медленно, а концентрированные, особенно при нагревании, растворяют его, причем в соляной кислоте получается хлорид олова(II), а в серной - сульфат олова(IV). С азотной кислотой олово реагирует тем интенсивнее, чем выше концентрация и температура: в разбавленной HNO3 образуется растворимый нитрат олова(II), а в концентрированной HNO3 - нерастворимая b-оловянная кислота H2SnO3. Концентрированные щелочи растворяют олово с образованием станнитов - солей оловянистой кислоты H2SnO2; в растворах станниты существуют в гидроксоформе, например Na2[[Sn(OH)4]]. Наибольшее промышленное значение соединения олова(II) имеют в производстве гальванических покрытий. Соединения олова(IV) находят обширное промышленное применение. Оксиды олова амфотерны, проявляют и кислотные, и основные свойства. Оксид олова(IV) встречается в природе в виде минерала касситерита, а чистый SnO2 получают из чистого металла; диоксид олова SnO2 применяется для приготовления белых глазурей и эмалей. Из SnO2 при взаимодействии со щелочами получают станнаты - соли оловянной кислоты, наиболее важные из которых - станнаты калия и натрия; растворы станнатов находят широкое применение как электролиты для осаждения олова и его сплавов. SnCl4 - тетрахлорид олова, исходное соединение для многих синтезов других соединений олова, включая и оловоорганические.
Применение. В современном мире более трети добываемого олова расходуется на изготовление пищевой жести и емкостей для напитков. Жесть в основном состоит из стали, но имеет покрытие из олова обычно толщиной менее 0,4 мкм.
Сплавы. Одна треть олова идет на изготовление припоев. Припои - это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn - Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов. Современные оловянно-свинцовые сплавы содержат 90-97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Покрытия из олова и его сплавов. Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Соединения. Олово образует различные химические соединения, многие из которых находят важное промышленное применение. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические
(см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида - вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сельскохозяйственные химикаты, для изготовления красок и консервации древесины.
ЛИТЕРАТУРА
Спиваковский В.Б. Аналитическая химия олова. М., 1975 Большаков К.А., Федоров П.И. Химия и технология малых металлов. М., 1984
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
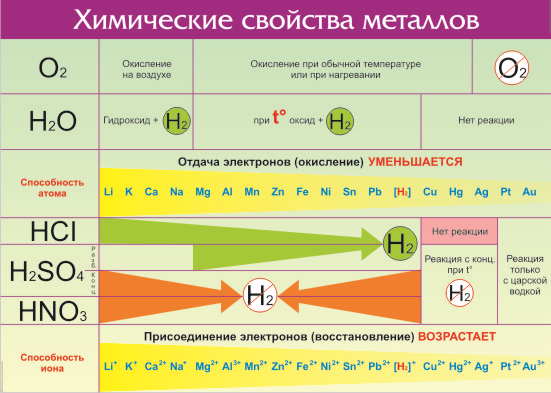
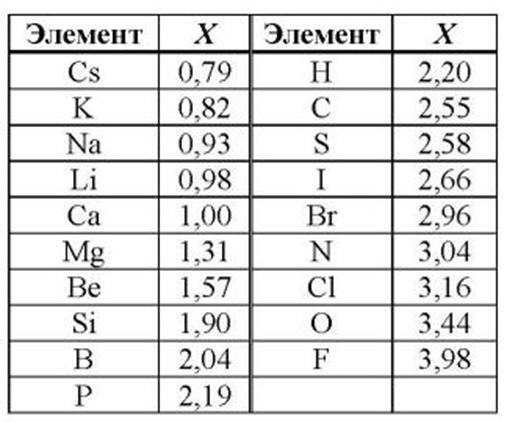
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Электрохимический ряд активности металлов
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
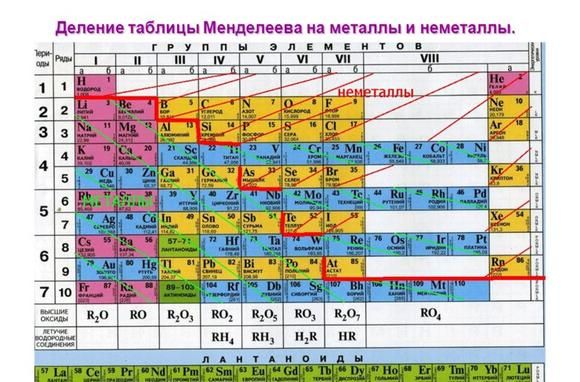
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
ОЛОВО — разноликий металл
Металл олово был открыт раньше железа, а его сплав с медью — самый первый, созданный людьми.
Люди отметили значимость бронзы, назвав эпоху своего развития Бронзовым веком.
Неизвестная история
История открытия олова и сплавов из него покрыта пылью времен. Никто не назовет имени первооткрывателя металла, никто не знает — кто догадался первым сплавить олово с медью. Зато известно, что еще 6000 лет назад люди пользовались изделиями из металла.

Происхождение латинского названия ученые выводят из санскритского sta — прочный.
Русское наименование относят к греческим корням. Alophoys по-гечески белый, что указывает на цвет металла.
Свойства Sn

Stannum (Sn) — латинское наименование этого гибкого, пластичного, легкоплавкого металла. Имеет № 50 в периодической таблице Менделеева.
По химическим свойствам металл подобен своим «соседям» — германию и свинцу.
В реакциях проявляет степени окисления +2, +4.
С водой или воздухом не реагирует. Причина этому — пленка оксида на поверхности металла.
Растворяется в разбавленных кислотах; с неметаллами реагирует при нагреве.
Физические свойства олова:
- плотность β-Sn 7,3 г/см3;
- плотность жидкого олова 6,98 г/см³;
- удельная электропроводность 8,69 МСм/м.
Металл обладает редким свойством: плавится при низкой температуре (232°С), а кипит при высокой (2620°С).
| Свойства атома | |
|---|---|
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) | 118,710(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) | 708,2 (7,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C[2] |
| Температура кипения | 2893 K, 2620 °C[3] |
| Уд. теплота плавления | 7,19[2]; кДж/моль |
| Уд. теплота испарения | 296[4] кДж/моль |
| Молярная теплоёмкость | 27,11[4] Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 66,8 Вт/(м·К) |
| Номер CAS | 7440-31-5 |
Аллотропные свойства олова
Аллотропия — свойство элемента менять свою кристаллическую решетку при изменении температуры. Модификация альфа (серое олово) устойчиво при низких температурах (ниже 13 °С). Имеет кубическую решетку, по типу алмаза. Практического применения не имеет.
Бета-модификация (белое, металлическое олово), из которого делают солдатиков, им же покрывают консервные банки. Кристаллическая структура тетрагональная.

В гамма-модификацию металл переходит при температуре 161-232°С.
Печально: в музее А.В. Суворова случилось несчастье. В запаснике, где хранилась ценная коллекция оловянных солдатиков, зимой лопнули трубы отопления, и коллекция просто рассыпалась в пыль.
Маркировка металла
Промышленность выпускает металл в проволоке, чушках, прутках.
Месторождения оловянных руд
Д.И. Менделеев писал:
«Олово встречается в природе редко, в жилах древних пород, почти исключительно в виде окиси SnO2, называемой оловянным камнем».
Олово относится к редким рассеянным металлам. В природе среди элементов занимает 47-е место по распространенности.
Мировые запасы оловянных руд расположены в:
- Китае;
- Малайзии;
- Индонезии;
- Бразилии;
- Перу;
- Австралии.
Значимые месторождения российских оловянных руд сосредоточены на Дальнем Востоке (в Приморском крае, в Якутии, в Хабаровском крае). Добыча металла большей частью происходит в подземных шахтах.
Основные руды:
- оловянный камень, касситерит — содержит до 78% металла;

Печально: по подсчетам ученых, оловосодержащих минералов на Земле осталось лет на 30. Потом придется добывать его из лома, или искать замену…
Сплавы
По своей классификации оловянные сплавы делятся на припои, подшипниковые и легкоплавкие.
- Баббиты. В них добавляют свинец, медь, сурьма. Баббиты могут иметь легирующие присадки. Маркировки баббитов: Б88, Б83, Б83С.
- Бронза — сплав меди с оловом. Любая бронза содержит небольшие добавки фосфора, цинка, свинца, никеля и других элементов. Марки бронзы: Бр ОФ 6,5-0,15; Бр.ОЦ 4-3; Бр.ОЦ10-2; Бр.ОФ 10-1; Бр.ОНС 11-4-3.
- Пьютер. Сплав с висмутом, сурьмой, медью, изредка со свинцом.
- Припои. Бывают твердые и легкоплавкие. В сплав добавляют свинец и другие элементы. Марки припоев: ПОС-30, ПОС-40, ПОС-90.
Плюсы и минусы олова
К достоинствам относим:
- Нетоксичность, это позволяет использовать металл в пищевой промышленности, в производстве посуды.
- Достойная антикоррозионная устойчивость в агрессивных средах.
- Не реагирует с серой; поэтому используют везде, где металл «завернут» в резиновую или пластиковую изоляцию.
- Подвержен «оловянной чуме».
- Довольно высокая стоимость ограничивает широкое применение металла.
- Невысокая температура плавления (всего 232°С).
Производство изделий из олова и его сплавов
Продукция из олова была востребована с давних времен. Дети играют в оловянных солдатиков уже 4000 лет.
- Электроника с ее платами сейчас повсюду, и любые контакты соединяются припоем из олова и его сплавов. Оловянное напыление для медных проводов полезно, это защита от воздействия серы (она входит в состав резиновой изоляции).
- Оловянные сплавы баббиты обладают прекрасными антифрикционными свойствами. Ни один из механизмов (от велосипеда до могучего КРАЗа) не обходится без подшипников.
- Используют металл в типографском сплаве гарте. Полиграфическое производство невозможно без оловянных сплавов.

Воздействие на организм оловянных изделий минимально. Поэтому применение металла в пищевой промышленности вполне оправдано.
Простая консервная банка и гибель полярной экспедиции
Французский повар Франсуа Аппер придумал, как долго хранить пищу. Он предложил герметично закрывать продукты в банки из белой жести (это тонкий лист из железа, покрытый оловянным напылением). Теперь мы не можем представить жизни без баночки вкусных консервов.
Но те же консервные банки (вернее, «оловянная чума») способствовали гибели экспедиции Р. Скотта к Южному полюсу. Из баков, запаянных оловянным припоем, вылилось горючее. Металл перешел в альфа-модификацию и просто раскрошился на морозе.
Стоимость олова
Главная мировая площадка инвесторов в металлы находится в Лондоне. Это LME (Лондонская биржа металлов).
Цена тонны олова на LME составляла 15590,0 US$ за тонну (данные на 28.05.2020).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Читайте также:
