Опорный конспект по металлам
Обновлено: 14.05.2024
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
- все s-элементы, кроме водорода и гелия;
- все d-элементы;
- p-элементы IIIА-группы, кроме бора;
- некоторые p-элементы IVA- (олово и свинец) и VA- (сурьма и висмут) групп, а также p-элемент VIIА-группы — полоний.
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:Эти же процессы происходят и в металлических сплавах.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла. В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.
Мы вряд ли представляем себе жизнь без электричества, которое поступает в каждый дом, в каждую квартиру по сети электрических проводов своеобразной кровеносной системе современной технической цивилизации. Лучше всего проводят электрический ток серебро, медь, золото, алюминий. Серебро и золото — дорогие металлы. Медь также недешёвый металл. Поэтому кабели линий электропередачи (ЛЭП) делают главным образом из алюминия.
Кстати, прочная опора линии электропередачи тоже металлическая. Прочность — одно из основных свойств большинства металлов, позволяющее использовать их в качестве конструкционных материалов. Один из наиболее прочных и в то же время лёгких металлов — титан. Этот металл и сплавы на его основе — незаменимые конструкционные материалы в самолётостроении и космической технике.
Все металлы теплопроводны. Это свойство, как и нетоксичность некоторых металлов, лежит в основе их применения для производства кухонной посуды: кастрюль, сковородок, противней. Батареи центрального отопления должны быстро нагреваться поступающей в них водой и эффективно отдавать теплоту окружающему воздуху, поэтому их тоже изготавливают из металла.
Самыми теплопроводными металлами являются те, которые хорошо проводят электрический ток: серебро, медь, золото, алюминий.
Металлы обладают металлическим блеском. Блестят они потому, что отражают лучи света, а не пропускают их, как стекло, и не поглощают, как сажа. Окраска большинства металлов серебристо–белая, так как они в равной степени отражают все лучи видимой части спектра. Золото и медь частично поглощают коротковолновое излучение, поэтому обладают окраской от жёлтой до красно–коричневой. Самые блестящие металлы — ртуть, палладий, серебро и алюминий, поэтому отражатели прожекторов, автомобильных фар и фонарей покрывают тонким слоем палладия, алюминия или хрома. Почти все измельчённые в порошок металлы, кроме магния и алюминия, теряют блеск и превращаются в серые или чёрные порошки.
Пластичность металлов в сочетании с блеском делают их незаменимым материалом для художников. Самым пластичным по праву считается золото. Из одного грамма этого металла можно вытянуть нить длиной 2 км или раскатать фольгу толщиной 0,00008 мм. Такой тонкий листочек даже в руки взять невозможно: он сразу прилипнет к коже. Это свойство находит своё применение: тонкими золотыми листочками покрывают купола церквей, скульптуры, деревянную резьбу.
Современная техника и промышленность нуждаются в металлических материалах с самыми разнообразными и трудно сочетаемыми свойствами, которых нет у чистых металлов. На помощь технологам приходят сплавы.
Например, из железосодержащих руд выплавляют чугун — сплав железа с углеродом, в котором массовая доля углерода составляет от 2 до 4%. Чугун — хрупкий материал, изделия из которого получают не ковкой, а литьём, как из пластмасс. Из чугуна изготавливают различные массивные конструкции: корпуса станков, турбин, детали двигателей, ограждения. Настоящее произведение искусства — ограды мостов и решётки парков Санкт–Петербурга.
Если из чугуна удалить излишек углерода и довести его содержание до 1—2%, получится сталь. В отличие от чугуна, она пластична, ковка, имеет гладкую блестящую поверхность. Сталь можно прокатать в тонкий лист или железнодорожный рельс, вытянуть в проволоку, согнуть уголком.
Для придания стали специфических свойств в неё добавляют другие металлы — так называемые легирующие добавки. Используя их, выплавляют сотни разных сортов стали. Нержавеющая сталь содержит хром и никель. В жаропрочную сталь добавляют вольфрам. Молибден придаёт стали твёрдость. Алюминий добавляют в сталь, идущую на изготовление кузовов автомобилей.
Сплав меди с оловом, бронза, обладает хорошими литейными свойствами. Из неё отливают не только колокола и художественные изделия, но и подшипники, вентили, клапаны и детали машин.
Сплав меди с цинком называют латунью. Она прочнее меди, устойчива к атмосферной коррозии. Из латуни изготавливают трубки, шестерни, армейские знаки отличия, химическое оборудование.
Нарядные столовые приборы, посуду, недорогие украшения изготавливают из мельхиора — сплава меди с никелем. Несмотря на то, что никеля в этом сплаве всего 20%, мельхиор лишён медного цвета и по внешнему виду напоминает серебро.
Сплав алюминия с медью, магнием и марганцем называют дуралюмин (дюраль) и используют в самолёто-, судо- и машиностроении.
Конспект урока по химии «Металлическая химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Опорный конспект по металлам
Металлы, как и все химические элементы, имеют три формы существования: атомы, простые и сложные вещества. Из 118 элементов периодической системы к металлам относят 96.
Общие физические свойства металлов.
Физические свойства металлов обусловлены металлической кристаллической решёткой и металлической химической связью. Напомним, что для металлов характерны металлический блеск, пластичность, высокая электро- и теплопроводность, рост электрического сопротивления при повышении температуры, а кроме того, такие практически значимые свойства, как ковкость, твёрдость, магнитные свойства.
Металлы — твёрдые при обычных условиях вещества (кроме ртути, которая становится твёрдой и ковкой при низких температурах).
Металлы пластичны и тягучи, кроме хрупких висмута и марганца. Из меди, алюминия, олова, а также золота изготавливают тончайшие листы — фольгу. Золотая фольга может иметь толщину около 100 нм! Такую фольгу используют для золочения предметов интерьера, стен и потолков, изделий из гипса, дерева, металла, стекла и пластика.
Все металлы имеют металлический блеск, большинство из них серебристо-белого или серого цвета. Из-за того, что стронций, золото и медь поглощают в большей степени близкие к фиолетовому цвету короткие волны и отражают длинные волны светового спектра, эти металлы окрашены в светло-жёлтый и медный цвет. Очень тонкие листки серебра и золота имеют совершенно необычный вид — они представляют собой голубовато-зелёную фольгу, а мелкие порошки металлов кажутся тёмно–серыми и даже чёрными. И только порошки магния и алюминия сохраняют серебристо-белый цвет.
В технике металлы принято классифицировать по различным физическим свойствам:
Металлы принято делить на чёрные (железо и его сплавы) и цветные (остальные металлы и сплавы). Соответственно называются и отрасли металлургической промышленности: чёрная и цветная металлургия.
Важнейшими продуктами цветной металлургии являются титан, вольфрам, молибден и другие металлы, которые могут использоваться в качестве специальных легирующих добавок для производства сверхтвёрдых, тугоплавких, устойчивых к коррозии сплавов, широко применяемых в машино– и станкостроении, в оборонно–космической отрасли.
Современные композиционные материалы, выполненные на основе керамики или полимеров, становятся сверхпрочными, если укреплены металлическими нитями из молибдена, вольфрама, титана, специальных сталей и т. д.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.

- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:
Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид 3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2) , Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn 0 + 2H + = Zn 2+ + H2 0
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO – + Zn 2+ + Н2 0
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn 0 + Сu 2+ = Zn 2+ + Сu 0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)

Конспект урока по химии в 11 классе «Металлы». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Опорный конспект "Положение металлов в ПСХЭ. Физические свойства"

Большинство химических элементов относят к металлам – 96 из 118 известных элементов. Металлы – это химические элементы, атомы которых отдают электроны внешнего электронного слоя, превращаясь в катионы.
I,II, III группы Периодической системы, а также побочные подгруппы остальных групп включают только Ме ( кроме Н и В). В остальных группах главных подгруппах металлы отделены диагональю В – At.
Ме имеют сравнительно большие R(радиус) и малое число ẽ(электроны) ( от 1 до 3) на внешнем слое. Исключение составляют 6 Ме: германий Ge, олово Sn, свинец Pb – 4ẽ, сурьма Sb, висмут Bi – 5ẽ, полоний Ро – 6ẽ.
Для атомов Ме характерны исключительно восстановительные свойства (т.е. способность отдавать ẽ и превращаться в катионы +).
Закономерности изменения свойств Ме.
В главной подгруппе:
- число ẽ на внешнем уровне не изменяется;
- R атома увеличивается;
- электроотрицательность уменьшается;
- восстановительные свойства усиливаются;
- Ме свойства усиливаются.
В периоде:
- заряды ядер атомов увеличиваются;
- R атомов уменьшаются;
- число ẽ на внешнем слое увеличивается;
- электроотрицательность возрастает;
- восстановительные свойства уменьшаются;
- Ме свойства ослабевают.
Тип химической связи в молекулах Ме – металлическая хим связь.
Рассмотрим образование химической связи на примере
11 Na 1s2 2s2 2p6 3s1 3p0 3d0 , где 3s, 3р, 3d – валентные орбитали. ẽ может занимать любую из орбиталей на 3 уровне. При сближении атомов орбитали перекрываются, ẽ перемещаются свободно.
Металлическая связь – это связь в Ме и сплавах между атом-ионами Ме, расположенными в узлах кристаллической решетки, которая осуществляется обобществленными валентными ẽ.
Ме связь → Ме кр.реш. → физ.св
ẽ ẽ ẽ ẽ
свободные электроны (электронный газ)
Полиморфизм (аллотропия) – свойство Ме существовать в нескольких кристаллических модификациях(например 3 полиморфных модификации у Fe)
Физические свойства.
Металлический блеск ( Ag,Al,Pd)
Пластичность (наиболее выражена Au,Ag, Cu, Sn, Pb, Zn; не обладают Bi, Mn)
Электрическая проводимость (наиболее выражена Ag, Cu, Au, Al, наименее выражена у Mn, Pb, Hg)
Плотность (наибольшая Os, наименьшая Li, K, Na, Rb, Cs)
T плавления ( наибольшая W)
Магнитные свойства (ферромагнетики – сильно намагничиваются в магнитном поле и сохраняют магнитные свойства вне поля Fe, Co, Ni, Cd; парамагнетики – намагничиваются в магнитном поле, но магнитные свойства вне поля не сохраняют Al, W, Pt, Щелочные, щелочно-земельные, переходные Ме; диамагнетики – выталкиваются из магнитного поля Cu, Ag, Au, Bi)
В технике принято классифицировать Ме
по физическим свойствам:
по плотности – легкие - обладающие малой плотностью (Li, Be, Na , Mg, Al , K ,Ca, Ti, Ru, Sr, Cs, Ba , тяжелые - с плотностью, большей, чем у железа: Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg.
- по Т плавления – легкоплавкие - группа цветных металлов с низкой tпл, включающая Zn, Cd, Hg, Sn, Pb, Bi, TI, Sb и элементы с ослабленными металлическими свойствами: Ga, Ge, тугоплавкие - tпл которых выше tпл железа (1539°С); это разделение условное. К ним относятся: Ti, Zr, Hf, V, Nb, Та, Сг, Мо, W, Re, а также платиновые металлы: Ru, Rh, Os, Tr, Pt
- черные - используемые в черной металлургии (т. е. металлургии железа); кроме Fe сюда условно входят Mn, Ti и Сr, цветные (все остальные).
по химическим свойствам:
- благородные(Ag, Au, Pt, Os, Ir, Ru, Pd, Rh)
- щелочные ( I группа главная подгруппа)
- щелочно-земельные (Ca, Sr, Ba, Ra)
- редкоземельные ( Sc, Y, La и лантаноиды, Ac и актиноиды).

-82%
Конспект урока химии на тему "Металлы и их соединения"
Химия 9 класс Тема урока: Металлы и их соединения Цель урока: развитие умений в работе с периодической системой, навыков составления уравнений химических реакций и решения расчетных задач, использование знаний о металлах на практике.
Тип урока: урок закрепления и систематизации знаний. Форма проведения: урок- соревнование. Оборудование : карточки- задания для групповой работы учащихся, ПСХЭМ, коллекция «Металлы и сплавы», презентация «Металлы в жизни человека», рефлексивные листы.
содержание Что делают время ученики учитель 1.Организационный момент. Позитивный настрой. Прием «Снежный ком» Участвуют в диалоге, объединяются в две команды. Определяют тему и цель урока. Приветствует учащихся. Ведет диалог. Целеполагание. 6 мин 2. Обобщение и систематизация знаний. Работают в команде с использованием активных методов. Организует различные виды деятельности учащихся. 26 мин 3. Рефлексия Заполняют рефлексивный лист. Предлагает учащимся заполнить рефлексивный лист 4 мин
Подведение итогов урока. Ведут подсчет «химов» Подводит итоги урока 4 мин
Девиз урока: «Ум заключается не только в знании, но и в умении прилагать знание на деле…» ( Аристотель)
Здравствуйте ребята! Наш сегодняшний урок мы проведем в форме химического соревнования. Для этого сформируем две команды, по принципу «геометрическая фигура».( Учащиеся выбирают геометрическую фигурку и объединяются в команду) Команды, занимайте свои места. Чтобы игра была интересной, предлагаю подарить друг другу хорошее настроение! На столе у каждого из вас лежит лист бумаги. Подумайте и запишите на этот лист, то что вы желаете сами себе. А теперь сомните этот лист с пожеланием и бросьте в команду соперников. Учащиеся разворачивают листы и читают пожелания. Химия – наука о веществах, их свойствах и превращениях. Это мир – полный загадок и тайн. Мы закончили изучать тему «Металлы и их соединения», так чем мы будем заниматься сегодня? ( ответы учащихся: повторять, обобщать и систематизировать изученное.) Итак, как вы можете определить тему урока? Повторение и обобщение по теме «Металлы и их соединения» Тему мы с вами определили, исходя из темы урока, попробуйте определить цель вашего пребывания на уроке? Что конкретно мы будем повторять и обобщать?
Цель: повторить положение металлов в ПСХЭМ, закрепить знание свойств металлов, их применение в жизни человека.
Урок в форме соревнования между двумя командами, за каждое правильно выполненное задание команды получают жетоны в виде « химов». Побеждает команда у которой в конце урока будет больше «химов».
2)Установи соответствие. Каждый ученик выбирает карточку на которой написан один из терминов.( Корунд. Электрометаллургия. Сплавы. Металлургия. Пассивация.Коррозия Руды. Гидрометаллургия) На листах А-4 прикрепленных к стене в кабинете имеются ответы. Задача ученика найти верный ответ и озвучить его. ( Верные ответы оцениваются « химами») Коррозия Окислительно- восстановительный процесс разрушения металлов или сплавов под действием факторов окружающей среды. Металлургия Область науки, техники и производства, связанная с промышленным получением металлов из природного сырья. Гидрометаллургия Восстановление металлов из растворов их солей. Металлотермия. Восстановление металлов более активными металлами. Пассивация. Окисление металла под действием веществ- окислителей с образованием тонкой оксидной пленки, снижающей активность металла. Корунд Очень твердый, бесцветный минерал алюминия. Сплавы Материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов, из которых хотя бы один является металлом. Руды Минералы, пригодные для промышленного получения металлов.
3) «Допишите схемы химических уравнений»
Задание первой команде
Fe(OH)3 = Fe + CuSO4 =
Задание второй команде
4) «Верно- неверно» Верны ли утверждения? Рядом с утверждением поставьте + или –
1. Металлы чаще встречаются в природе в составе соединений. 2. Металлы ярко выраженные окислители. 3. Алюминий получают электролизом раствора его оксида. 4. Корунд одно из самых мягких природных соединений алюминия.
Верны ли утверждения? Рядом с утверждением поставьте + или -
1. Кальций входит в состав известняка. 2. Железо получают из бокситов. 3. Рубин, сапфир, корунд это соединения железа. 4. Металлы ярко выраженные восстановители.
5) Химические задачи. Задача №1 Рассчитайте массовую долю железа в магнитном железняке- Fe3O4 и красном железняке Fe2O3. Какая из этих руд богаче железом ?
Задача №2 Титан можно получить при взаимодействии оксида титана с магнием. Рассчитайте массу титана ( валентность 4), если в реакцию вступит 450 грамм оксида титана.
6) Назови вещества и расположи их в порядке возрастания относительной молекулярной массы. Ответы занесите в таблицу.
FeSO4 ; Fe2O3 ; FeCl3; Fe(OH)2 Формула и название вещества Относительная атомная масса FeSO4 Fe2O3 FeCl3 Fe(OH)2
NaAlO2 ; NaOH, NaCl, NaO. Формула и название вещества Относительная атомная масса NaAlO2 NaOH NaCl NaO
Пассивно. Недоволен. Длинным. Стало хуже
10) Подведение итогов урока. Подсчет «химов» каждой команды, определение команды- победителя.
Металлы
Данный видеофрагмент посвящён металлам, положению их в Периодической системе, их физическим свойствам, особенностям строения атомов металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлы"
Как известно, из 118 химических элементов 95 относится к металлам.
В периодической системе металлы располагаются левее и ниже условной линии, проходящей от бора к астату, а также в побочных подгруппах V, VI, VII, VIII группы. К металлам относятся почти все s-элементы, кроме H, He, половина p-элементы, d- и f-элементы (лантаниды и актиниды).
Металлы s- и p-семейства – это металлы главных подгрупп, а d- и f-семейства – это металлы побочных подгрупп.
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых p-элементов, как Sn, Pb, Bi, Po их больше (4-6). Валентные электроны атомов металлов слабо связаны с ядром, что и отличает их от атомов неметаллов. Кроме этого, атомы металлов имеют сравнительно большие радиусы атомов и небольшую электроотрицательность.

Поэтому металлы относительно легко отдают электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы.
У металлов побочных подгрупп с увеличением заряда ядра радиус атома изменяется незначительно, так как заполняется предвнешний энергетический уровень. Поэтому электроны сильнее притягиваются к ядру и восстановительные свойства ослабевают.
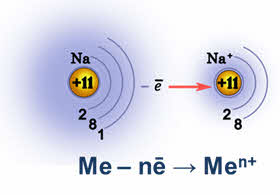
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8. Степень окисления металлов определяется валентными электронами внешнего и предвнешнего энергетического уровня.

Чем легче атом металла отдаёт свои электроны, тем он более сильный восстановитель.
Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов.

К наиболее распространённым металлам в земной коре относятся алюминий (8,8%), железо (4,65%), кальций (3,38%), натрий (2,64%), калий (2,41%), магний (2,35%) остальная часть приходится на другие металлы.

Элементы, массовая доля которых в земной коре составляет менее 0,01%, называются редкими. К числу редких металлов относятся лантаниды. Если элемент не способен концентрироваться в земной коре, то есть не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Это такие элементы, как Sc, Ga, In, Tl, Hf.
В 40-х годах 20 века немецкие учёные Вальтер и Ида Ноддак высказали мысль о том, что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы.
Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа учёные всё больше убеждались в справедливости этих слов.
Например, в организме взрослого человека массовая доля неорганических веществ составляет 6%. Из металлов здесь присутствуют Mg, Ca, Na, K.
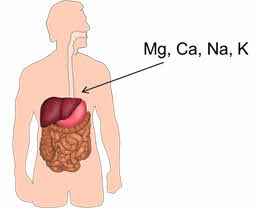
В составе многих ферментов, и иных биологически активных веществ в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия.

Как известно, у металлов металлическая химическая связь, которая предопределяет ряд свойств металлов. При обычных условиях почти все металлы (кроме ртути) представляют собой твёрдые вещества, имеющие кристаллическое строение.
В металлическом кристалле атомы и катионы металлов располагаются в строго определённых местах пространства – узлах кристаллической решётки.

Кристаллическая решётка каждого металла имеет свою повторяющуюся во всех направлениях пространства характерную структуру – элементарную ячейку.
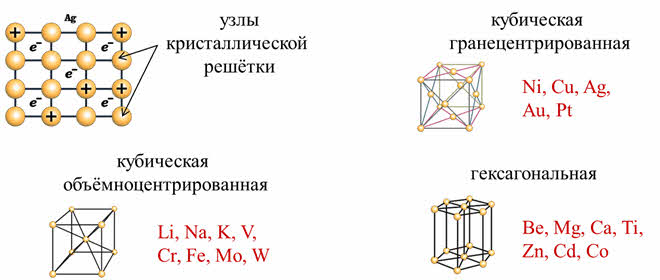
Известно много типов элементарн6ых ячеек, но наиболее распространёнными являются кубическая объёмноцентрированная, как у Li, Na, K, V, Cr, Fe, Mo, W, кубическая гранецентрированная, как у Ni, Cu, Ag, Au, Pt и гексагональная, как у Be, Mg, Ca, Ti, Zn, Cd, Co.
Для металлов характерна высокая электро- и теплопроводность, ковкость и пластичность, способность образовывать сплавы, металлический блеск.

По температуре плавления различают металлы тугоплавкие, у которых температура плавления больше 1000 0 С и легкоплавкие, у которых температура плавления меньше 1000 0 С. Самым тугоплавким металлом является W (3400 0 C), а самым легкоплавким – Hg (-39 0 C). Это свойство вольфрама позволяет использовать его в нитях ламп накаливания.

Самым электропроводным является серебро (Ag), вслед за ним идут Cu и Al.

Наиболее низкая электропроводность среди металлов у Mn. При понижении температуры электропроводность металлов возрастает, при абсолютном нуле у большинства металлов появляется сверхпроводимость.

Лучшим проводником теплоты является Ag, а худшим – Bi. Теплопроводность металлов позволяет использовать их для изготовления металлической посуды.

По твёрдости металлы очень сильно различаются. Самыми твёрдыми среди металлов являются Mo и Cr. Твёрдость щелочных металлов крайне низкая и не превышает твёрдости пластилина – их легко можно резать ножом.
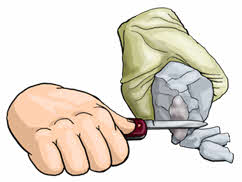
По плотности металлы делят на лёгкие и тяжёлые. Если плотность металла меньше 5 г/см 3 , то этот металл является лёгким, если плотность металла больше 5 г/см 3 , то этот металл считается тяжёлым. Лёгкими считаются такие металлы, как Al, Ti, Mg, а тяжёлыми Fe, Cu, Pb, Hg.

Такое свойство металлов, как пластичность выражается в их способности деформироваться под действием механической нагрузки. Поэтому металлы можно ковать, вытягивать в проволоку, прокатывать. Наиболее пластичными металлами являются золото, серебро и медь.

Например, из золота можно изготовить фольгу толщиной 0,003 мм. Такие тонкие листы фольги можно использовать при золочении. Вспомните Янтарную комнату или изделия из золота, которые дошли до нас спустя не одно тысячелетие.

Металлы имеют металлический блеск. Наибольше светоотражающей способностью обладает ртуть, поэтому ранее её использовали для изготовления знаменитых венецианских зеркал.

В настоящее время для изготовления зеркал, прожекторов и фар используют алюминий, палладий и серебро, потому что они имеют также высокую светоотражающую способность и неядовиты, в отличие от ртути.
Многие металлы в порошке теряют блеск и приобретают чёрную или серую окраску, только магний и алюминий сохраняют её. Поэтому алюминий используют для изготовления краски «серебрянка».

Большинство металлов имеют серебристо-белый цвет, только золото имеет жёлтый цвет, а медь – красный цвет, а стронций – светло-жёлтый.

Некоторые металлы, в зависимости от условий, могут кристаллизоваться в двух и более кристаллических формах. Такое явление называется полиморфизмом (аллотропия).
Например, белое олово, или β-олово устойчиво при температуре 13,2 0 С, серое олово, или α-олово, устойчиво при температуре ниже 13,2 0 С.
Железо имеет четыре кристаллические модификации: α, β, γ, δ.
Металлы также отличаются и по их отношению к магнитному полю: металлы ферромагнитные – намагничиваются, как никель и α-железо, парамагнитные – слабо намагничиваются – это алюминий, хром и диамагнитные, которые не притягиваются к магниту, а отталкиваются – это олово и медь.
Для d-элементов характерно образование ковалентных связей, как для вольфрама, молибдена, хрома, осмия, поэтому они тугоплавкие, твёрдые и тяжёлые.
Поэтому, по степени близости физических, химических свойств выделяют группы металлов: щелочные и щелочноземельные.
Познание человеком металлов своими корнями уходит в глубокую древность. Полагают, что первыми металлами. С которыми столкнулся человек и которые он начал использовать на практике, были медь, золото и серебро.

Причина заключается в том, что именно эти металлы встречаются в природе в самородном состоянии и легко могли быть случайно найдены нашими предками. Древние медные изделия были найдены при раскопках на Анатолийском плоскогорье в Турции и датируются 6,5 – 5,5 тыс. лет до н.э.
Одним из наиболее важных этапов в использовании человеком металлов стало освоение процесса получения железа из его природных руд. Но для получения железа из руд необходима высокая температура, поэтому получать железо стали примерно к 1500 г до н. э.
История открытия алюминия связана с фамилией А. Маргграфа, который в 1754 году получил оксид алюминия из «квасцовой земли».
Только в 1825 году в виде металла алюминий был получен Г. Эрстедом. В то время стоимость алюминия превышала стоимость золота из-за чрезвычайной сложности его получения.
Таким образом, атомы металлов всегда выступают в химических реакциях в качестве восстановителей, заряд ядра атома, радиус атома оказывает влияние на восстановительные свойства металлов, в вытеснительном ряду металлов их восстановительная активность уменьшается слева направо, в отличие от неметаллов для атомов металлов характерны только положительные степени окисления. Для металлов характерна металлическая химическая связь, которая определяет физические свойства металлов.
Читайте также:
