Определение эквивалента металла газометрическим методом
Обновлено: 16.05.2024
Цель работы– усвоение понятий эквивалент, молярная масса эквивалента, знакомство со способами расчета молярных масс эквивалентов простых и сложных веществ; экспериментальное определение эквивалента неизвестного металла объемным методом.
Основные слова и определения, которые следует знать[1]:
Моль – количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода .
Постоянная Авогадро NA - это число частиц в 1 моле любого вещества;
NA=6,022*10 23 моль -1 .
Молярная масса М- масса одного моля вещества. Молярная масса М численно совпадает с массами атомов и молекул, выраженнымив атомных единицах массы, и измеряется в граммах на моль (г/моль).
Атомная единица массы (а. е. м. или u) – это единица массы, равная 1/12 массы атома изотопа углерода 12 С, и применяемая в атомной и ядерной физике для выражения масс молекул, атомов, ядер, протона и нейтрона. 1 а.е.м. (u) ≈ 1.66054*10-27 кг.
Молярный объем Vм – объем 1-го моля газа, измеряется в литрах на моль (л/моль).
Формульная единица вещества ФЕ–это реально существующие частицы вещества:атомы (S, C, Fe), молекулы (H2O, CO2, NaOH, HCl, H2), ионы (Са +2 , СО3 -2 ), радикалы (ОН . , NO2 . ) и другие частицы вещества.
Химический эквивалент (Э)- это реальная или условная частица, которая может присоединять, высвобождать, или быть каким-либо другим способом равнозначна одному атому (иону) водорода в обменных (кислотно-основных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Химический эквивалент (Э)– это реальная или условная частица вещества ФЕ, эквивалентная в кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции – одному электрону
Эквивалентное числоиличисло эквивалентности Zэкв - это число, равное абсолютному значению степени окисления иона или количеству электронов, переданному восстановителем окислителю или окислителем восстановителю.
Фактор эквивалентности f–эточисло, показывающее, какая доля реальной частицы вещества ФЕ эквивалентна в данной кислотнооснoвной реакции одному иону водорода или в окислительно-восстановительной реакции одному электрону: f = 1/Zэкв, где Zэкв – это число эквивалентности, или эквивалентное число.
Фактор эквивалентности f экв–это величина, обратная числу эквивалентности; она показывает, какая доля формульной единицы вещества приходится на 1 химический эквивалент
Молярная масса химического эквивалента Мэкв- этомасса одного моля химического эквивалента вещества, которая в Zэкв раз меньше соответствующей молярной массы ФЕ вещества, участвующего в реакции и выражается в граммах на моль (г/моль):
Молярный объем химического эквивалента (эквивалентный объем) Vэкв газа - это объем 1 моля химического эквивалента газа, выражается в литрах на моль (л/моль) и связан молярным объемом соотношением:
Vэкв = =Vm*fэкв
Закон эквивалентов:массы реагирующих веществ относятся между собой как молярные массы их эквивалентов:
m (A) : m (B) : m (D) . . . = Mэкв (A) : Mэкв (B) : Mэкв (D). . .
Теоретическая часть
Раздел химии, в котором рассматриваются количественные (массовые, объемные) соотношения между реагентами и продуктами реакции, а также количественный состав вещества, называют стехиометрией (от греч. Stoicheion –основа; metreo - измеряю). Она базируется на законах, определяющих строение вещества.
Эквивалент Э – это реальная или условная частица вещества ФЕ, эквивалентная в кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции – одному электрону.
ФЕ – формульная единица вещества, под которой понимается какое-либо вещество, например, NaOH, HCl, H2 и т. п.
Фактор эквивалентности f – число, показывающее, какая доля реальной частицы вещества ФЕ эквивалентна в данной кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции одному электрону: f = 1/Z,
где Z –число эквивалентности, или эквивалентное число, равное абсолютному значению степени окисления иона или числу электронов, переданному восстановителем окислителю или окислителем восстановителю.
Немецкие химики Венцель и Рихтер установили (1793 г.), что вещества реагируют и образуются в эквивалентных количествах.
Согласно закону эквивалентов, массы реагирующих веществ относятся между собой как молярные массы их эквивалентов:
Молярная масса эквивалента представляет собой массу одного моля эквивалента вещества, которая в Z раз меньше соответствующей молярной массы ФЕ вещества, участвующего в реакции и выражается в граммах на моль (г/моль):
Например, для реакции нейтрализации
(2+32+64=98) 2*(23+16+1=40) (23*2+32+64=142) 2*(18)
| H2SO4 | NaOH | Na2SO4 | H2O | |
| Формульное количество, моль | ||||
| Эквивалентное количество, моль | 1/2 | 1/2 | ||
| Число эквивалентности Z | ||||
| Фактор эквивалентности | 1/2 | 1/2 | ||
| Молярная масса эквивалента, г/моль | 98/2=49 | 40/1=40 | 142/2=71 | 18/1=18 |
Основные количественные законы протекания химических реакций, используемые в работе:
Основные идеи славянофильства: Славянофилы в своей трактовке русской истории исходили из православия как начала.
Что входит в перечень работ по подготовке дома к зиме: При подготовке дома к зиме проводят следующие мероприятия.
Поиск по сайту
Работа № 1. Определение эквивалента металла газометрическим методом
Эквивалентом элемента называют такую его массу, которая без остатка взаимодействует с одной массовой частью (м.ч.) атомов водорода или с восемью м.ч. атомов кислорода или же замещает указанное количество водорода и кислорода в химических реакциях.
Из определения следует, что эквивалент водорода равен 1 м.ч. (или 1 г, в этом случае его называют грамм-эквивалентом), а эквивалент кислорода─ 8 м.ч. (8 г). Эквиваленты можно выразить через объемные единицы. В этом случае необходимо применить закон Авогадро: «В равных объемах различных газов или паров при одинаковых внешних условиях (температура и давление) содержится одинаковое количество молекул» и его следствия. Например, 1 моль любого газа при нормальных условиях (н.у.) содержит 6,02∙10 23 молекул – число Авогадро (NА) и, как следствие, один моль любого газа (при н.у.) занимает объем 22,4 л. В связи с тем, что водород и кислород – газы, то в расчетах эквивалентов элементов можно сравнивать их количества не с массами эквивалентов этих газов, а с объемами их эквивалентов. Так как масса г-эквивалента водорода равна 1/2 массы моля водорода, а масса г-эквивалента кислорода равна 1/4 массы моля кислорода, следовательно, согласно закону Авогадро:
Эквиваленты элементов (Fe, Zn, Ca, Cu и др.) рассчитываются по формуле
где «А» ─ атомная масса элемента, «В» ─ степень его окисления, т.е. его валентность. Например, г-эквивалент меди в оксиде меди CuO или в соли CuSO4 равен Э(Cu)= г.
Эквиваленты «сложных» веществ (оксидов, оснований, кислот, солей) рассчитываются следующим образом.
Эквивалент кислоты равен отношению молекулярной массы кислоты (М) к ее основности (т.е. числу атомов водорода, участвующих в данной реакции). Например, г-эквивалент серной кислоты (в том случае, если в реакции участвуют два атома водорода) рассчитывается по формуле
Эквивалент основания равен отношению молекулярной массы щелочи (М) к ее кислотности (т.е. числу групп ОН - , участвующих в данной реакции). Например, г-эквивалент гидроксида натрия рассчитывается по формуле
Эквивалент соли равен отношению молекулярной массы соли (М) к произведению числа атомов металла, входящих в состав соли, на его валентность. Например, г-эквивалент сульфата алюминия Al2(SO4)3 рассчитывается по формуле:
Эквиваленты можно определить, используя один из основных стехиометрических законов химии – закон эквивалентов, которому подчиняются все реагирующие между собой вещества. Как простые, так и сложные: «Все вещества реагируют друг с другом в эквивалентном количестве, то есть количества эквивалентов каждого из участников реакции равны между собой».
Для реакции, протекающей согласно уравнению
a ∙A + b ∙B = d ∙D + f ∙F,
закон эквивалентов запишется следующим образом:
Так как количество эквивалентов вещества n, содержащихся в определенной его массе, равно , то закон эквивалентов можно записать иначе: ,
откуда следует, что массы реагирующих веществ пропорциональны их эквивалентам:
Для веществ, реагирующих в растворах, закон эквивалентов можно выразить формулой
где NA и NB – нормальные концентрации растворов веществ А и В, выраженные в г-экв/л; а VA и VB – объемы растворов, л
Б. Экспериментальная часть
Цель работы ─ изучение практической значимости закона эквивалентов для стехиометрических расчетов и определение с помощью газометрического метода эквивалента и атомной массы металла с известной валентностью.
Оборудование
Прибор для проведения эксперимента (рис. 6.1), включающий:
● «рабочую» (1) и «вспомогательную» (3) бюретки, заполненные водой и соединенные резиновым шлангом (сообщающиеся сосуды);
● двухколенную (2) пробирку, герметически присоединяемую к прибору во время эксперимента к «рабочей» бюретке;
● штатив (4) для крепления установки.
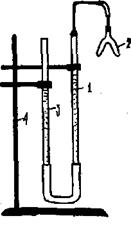
Рис. 6.1. Прибор для определения эквивалента
металла газометрическим методом
Последовательность выполнения
Работы
1. Заполнить таблицу
| Навеска металла, г* | |
| Начальный уровень воды в рабочей бюретке V1, мл | |
| Уровень воды после растворения металла V2, мл | |
| Объем водорода, полученный в результате опыта V2-V1 = V (H2) | |
| Температура опыта, о С ** | |
| Атмосферное давление (по барометру) ратм , мм рт. ст.** | |
| Давление насыщенного водяного пара h при температуре опыта, мм рт. ст.** | |
| Давление водорода при температуре опыта р(Н2)= (р атм – h), мм рт. ст. | |
| Валентность (степень окисления) металла | II |
*Навеска исследуемого металла, масса которой определяется с точностью до 0,0001 г, выдается студентам лаборантом.
** Данные, соответствующие строкам 5-7, предоставляются преподавателем.
2. Перед началом проведения эксперимента, необходимо отсоединить двухколенную пробиркуот основной бюретки, вылить содержимое пробирки (если оно имеется) в раковину и тщательно промыть двухколенную пробирку водопроводной водой.
3. Расположить рабочую и вспомогательную бюретки путем маневрирования их положения по высоте таким образом, чтобы уровень воды в основной бюретке был около нулевого значения.
4.Навеску металла поместить в одно из «колен» двухколенной пробирки.
5. В другое «колено» пробирки прилить (аккуратно, чтобы исключить попадание кислоты в «колено» с навеской металла) ~ 2 мл раствора соляной кислоты, т.е. до метки, нанесенной красным химическим карандашом.
6. Двухколенную пробирку вращательным движением плотно надеть на пробку (мениск воды в основной бюретке при этом немного сместится от нулевого значения).
7. Проверить герметичность прибора. С этой целью вспомогательную бюретку, предварительно освободив от крепления, резко опустить вниз на 15–20 см. Если прибор герметичен, то мениск воды в ней останется практически на том же уровне. Если герметичность отсутствует, мениски воды в бюретках будут постепенно сравниваться. В этом случае с помощью лаборанта следует проверить надежность соединений в приборе.
8. Перед началом эксперимента необходимо установить давление в герметичном приборе равным атмосферному давлению. Для этого, перемещая бюретки относительно друг друга, следует добиться, чтобы мениски воды в бюретках находились строго на одной высоте, т.е. на одной горизонтальной прямой.
9. Записать в таблицу значение начального уровня воды в рабочей бюретке.
10. Бережно прилить кислоту в «колено», где находится навеска металла, наклоняя пробирку осторожно, чтобы не нарушить герметичность прибора. Для того чтобы исключить разгерметизацию прибора в ходе выделения водорода по реакции, вспомогательную бюретку следует аккуратно снижать по высоте, а рабочую поднимать, добиваясь тем самым соблюдения положения менисков воды на одном уровне.
11. Полное растворение металла по реакции фиксируется визуально: выделение пузырьков водорода и понижение уровня воды в рабочей бюретке прекращается. Удостоверившись, что раствор в пробирке охладился до комнатной температуры, записать в таблицу конечный уровень воды после окончания эксперимента.
12. Перевести объем выделившегося водорода, измеренный при данном атмосферном давлении V(H2), к объему при нормальных условиях V0, используя уравнение, объединяющее газовые законы Бойля–Мариотта и Гей–Люссака:
где р0 – нормальное атмосферное давление (760 мм рт.ст.); V0 – объем водорода при нормальных условиях; То – нормальная температура по абсолютной шкале (273 К); р1 – давление водорода в условиях опыта (рн2 ,мм рт.ст.), V1 – объем водорода в условиях опыта (V (Н2), мл; Т – температура опыта (273 + t°С).
13. Рассчитать эквивалент металла по закону эквивалентов, используя пропорцию:
14. Рассчитать атомную массу металла по формуле
15. Используя периодическую таблицу элементов Д.И. Менделеева, определить природу металла по опытному значению атомной массы (группа элементов в таблице совпадает со степенью окисления металла, т.е. с его валентностью 2.
16. Составить уравнение реакции найденного металла с соляной кислотой.
17. Вычислить относительную ошибку опыта:
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Что называется химическим эквивалентом?
2. Сформулируйте закон эквивалентов.
3. Сформулируйте закон парциальных давлений, установленный Дальтоном.
4. Как вычисляется эквивалент сложного вещества (оксидов, кислот, оснований и солей)?
5. Вычислите эквивалент хрома в оксиде, в котором содержится 52% хрома и 48% кислорода.
6. Окислением 2,8 г кадмия получено 3,2 г оксида. Вычислите эквивалент кадмия.
Работа № 2. Криометрия
Цель работы – определение температуры кристаллизации (замерзания) раствора и использование этого физико-химического свойства для расчета молекулярной массы растворенного неэлектролита и степени диссоциации раствора электролита.
Оборудование и реактивы
1. Прибор криометр (рис. 6.2), состоящий из:
а) широкой стеклянной пробирки (1) для исследуемого раствора, закрепленной в штативе (2);
б) пробки со вставленным в нее термометром (3) и металлической мешалкой (4);
в) сосуда (криостата) (5) для охладительной смеси, которая готовится изо льда и 1-2 столовых ложек поваренной соли.
Отчёт по лабораторной работе № 1
Усвоить одно из основных химических понятий – понятие об эквиваленте – и научиться определять его количественное значение.
1. Наполнить водой кристаллизатор и бюретку (стеклянную трубку с делениями и краном для выпуска жидкости внизу). Проверить, плотно ли закрыт кран бюретки.
2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет.
3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы.
4. В колбу Вюрца (круглодонная колбас боковым отводом) при помощи мерного цилиндра отобрать 15-20мл соляной кислоты.
5. Вытереть насухо горло колбы фильтром.
6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой.
7. Стеклянную трубку бокового отвода колбы Вюрца соединить с расположенной под водой частью бюретки.
8. Отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки – объем в миллилитрах, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута.
9. Перевести колбу в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов теплового расширения.
10. Когда выделение пузырьков водорода прекратиться, отметить конечный уровень воды в бюретке.
11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе.
12. По показания барометра и термометра определить атмосферное давление и температуру в лаборатории.
Экспериментальные данные:
Масса навески металла – mМе=0,0096 г
Объем соляной кислоты - VНCl=15 мл
Объем воды в бюретке в начале эксперимента – V1=13,3 мл
Объем воды в бюретке по окончании эксперимента – V2=4,3 мл
Объем выделившегося водорода – Vизм.=V1-V2=9 мл
Высота столба воды в бюретке h=170 мм
Атмосферное давление в лаборатории Pатм= 770 мм рт.ст
Температура в лаборатории Т=20 о С
Обработка экспериментальных данных:
1. Водород находиться в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляется по формуле:
где Р1 – давление столба воды в бюретке, Па, Р1=9,8hdaq, 9,8 – переводной коэффициент из мм вод.ст. в Па; daq плотность воды, daq=1 г/см 3 ; Р2-давление насыщенного водяного пара.
Pатм=770 мм рт.ст.=102410 Па
Р=102410-1666-2332,7=98411,3 Па.
2. .Массу выделившегося водорода mН вычисляют по уравнению Клапейрона-Менделеева:
где МН2 – молярная масса водорода, МН2=2г/моль; V – объем водорода, м 3 ; R – универсальная газовая постоянная, R=8,314 Дж/(моль·К).
V=9 мл=9·10 -6 м 3
Т=20 о С=293 К
3. Вычислить эквивалент металла по закону эквивалентов:
где ЭМ(Н) – эквивалентная масса водорода, ЭМ(Н)=1 г/экв.
4. Зная степень окисления,найти молярную массу металла и определить что это за металл:
где Z– степень окисления металла, Z=2
Данный металл – Магний.
5. Вычислить точное значение эквивалентной массы и металла и найти относительную погрешность эксперимента:

В данной лабораторной работе мной определена эквивалентная масса Магния. Погрешность измерений 2,27%,что говорит о том, что опыт проведен верно.
Технические характеристики АП«ОМЕГА»: Дыхательным аппаратом со сжатым воздухом называется изолирующий резервуарный аппарат, в котором.
Конфликтные ситуации в медицинской практике: Наиболее ярким примером конфликта врача и пациента является.
Б. Экспериментальная часть

Читайте также:
