Определите вещества относящиеся к группе металлов
Обновлено: 16.05.2024
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
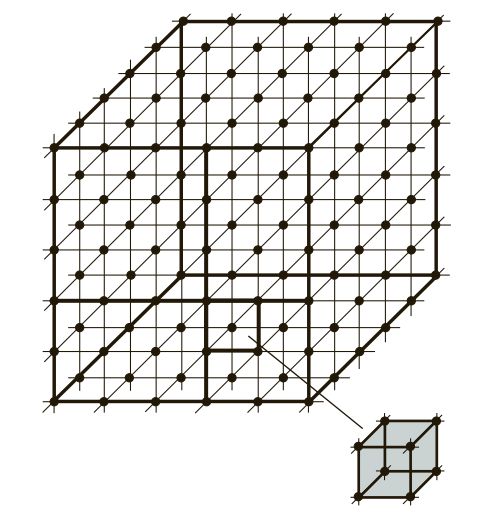
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
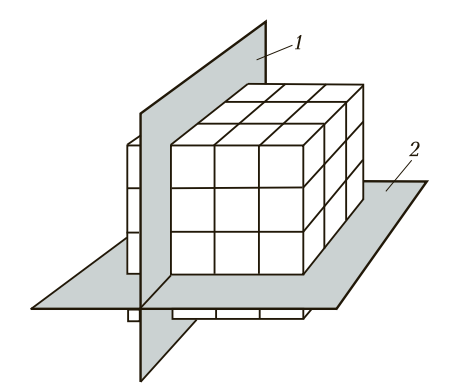
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
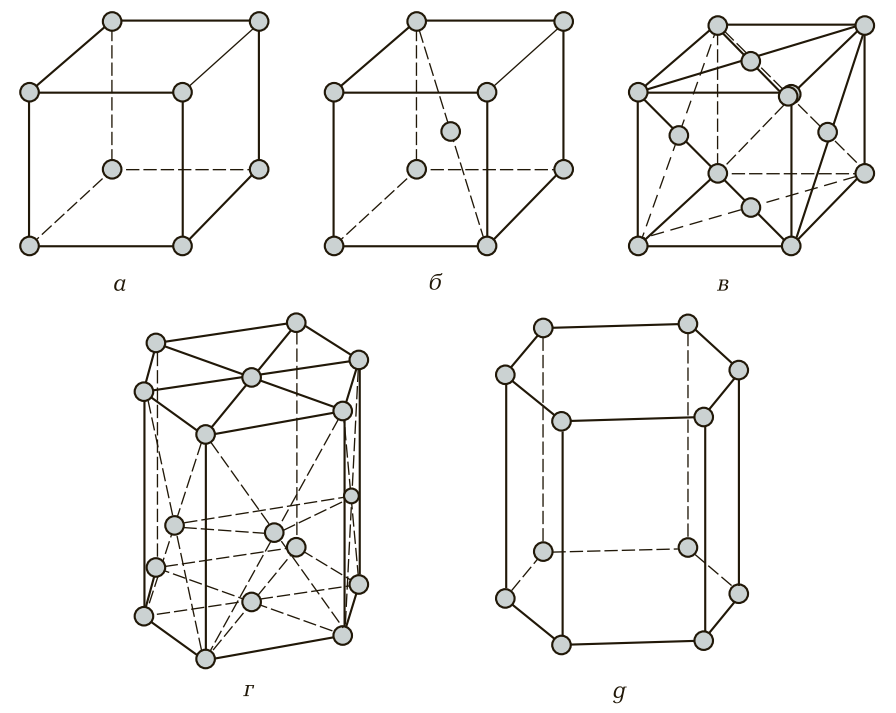
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
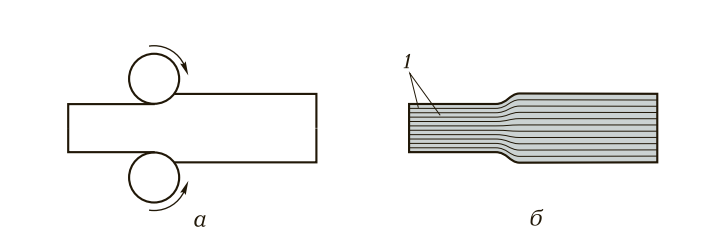
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
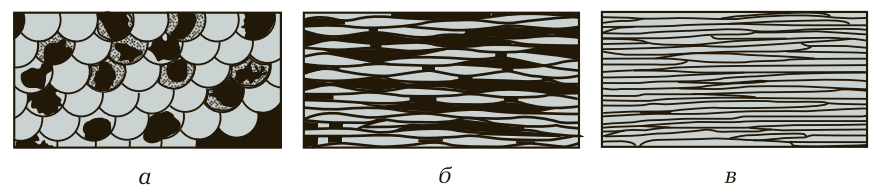
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
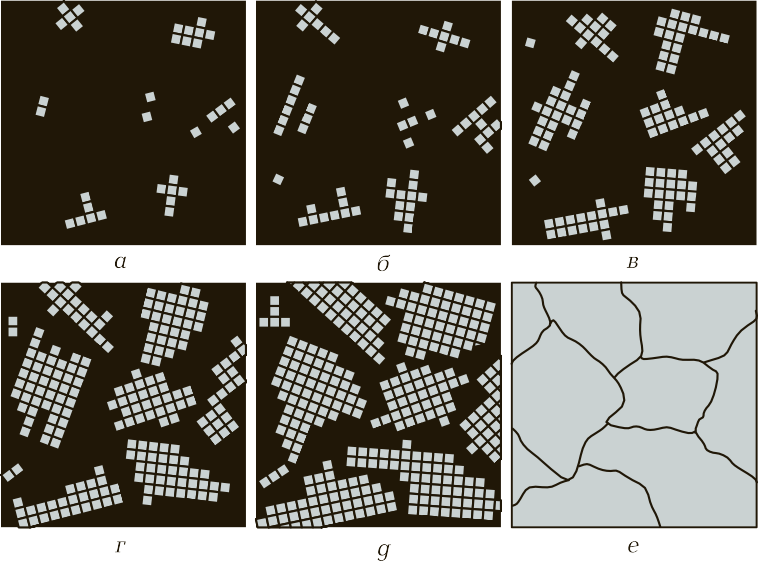
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
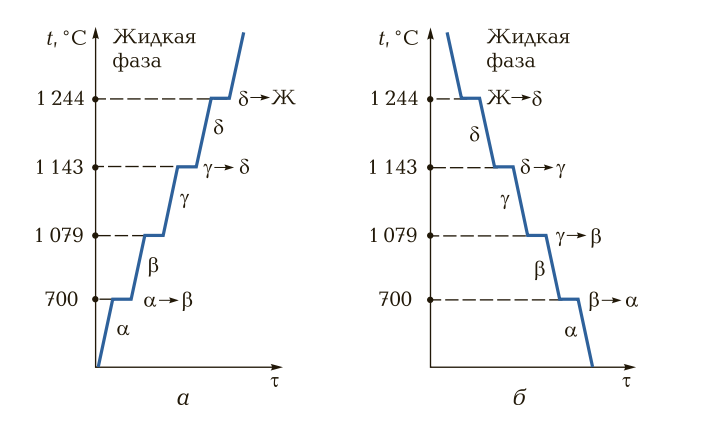
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Какие химические элементы являются металлами и какие являются неметаллами?
МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные свойства металла обусловлены наличием свободно перемещающихся электронов в его кристаллической решетке. Из известных в настоящее время 107 химических элементов 85 относятся к металлам.
Деление всех химических элементов периодической системы Д. И. Менделеева на металлы и неметаллы является условным. Если в периодической таблице провести диагональ через бор и астат, то в главных подгруппах, расположенных справа от диагонали, будут неметаллы, а в главных подгруппах слева от диагонали, побочных подгруппах и в восьмой группе (кроме инертных газов) — металлы. Причем элементы рядом с разделительной линией являются так называемыми металлоидами, т. е. веществами с промежуточными свойствами (металлов и неметаллов) . К ним относятся: бор В, кремний Si, германий Gе, мышьяк Аs, сурьма Sb, теллур Те, полоний Ро.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп) . Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Неметаллы - Это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы окажутся над ней т. е. они находятся в правом верхнем углу.
Атомы неметаллов ( по сравнению с атомами металлов) содержат большее число электронов на внешнем энергетическом уровне, по этому простые вещества - неметаллы обладают, как правило, окислительно - восстановительной деятельностью (кроме фтора и кислорода, которые являются окислителями)
Неметаллы различны по своему агрегатному состоянию. Многие из них газы (кислород, азот, гелий, водород, неон, ксенон, криптон и т. д.). Твердые вещества (фосфор, фтор, йод, бор и т. д.). Бром является жидкостью.
Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т. д.
Неметаллы имеют различные типы кристаллической решетки - атомную (бор, кремний, углерод в виде алмаза) и молекулярную (йод, белый фосфор, сера кристаллическая)
Физические свойства неметаллов зависят от типа решетки. Вещества с молекулярной решеткой - летучие, легкоплавкие, непрочные, с незначительной растворимостью в воде.
Кароче, там есть такая таблица металлов (такая полосочка, начинаеться Литем (кажись) а заканчиваеться чем-то тяжёлым) .
Основным признаком что эллемент - металл, являеться слабая связь электронов последнего уровня с ядром, они (металлы) могут эти электроны отдавать.
С этим связна причина их электропроводности.
проще говоря, металлы, это те элементы, которые на внешнем электронном уровне имеют 1-3 электрона, т. е. при взаимодействии с другими элементами, , они легко отдают эти электроны. Это 1, 2, 3 группа (гл. подг) перидической системы
А неметаллы, это те элементы, которые имеют почти завершенный электронный уровень, которым не хватает до завершения 1-3 электрона. Это 5,6,7 группа
Определите вещества относящиеся к группе металлов

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития
пероксид натрия
надпероксид калия
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- С серой реагируют все металлы, кроме золота и платины:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
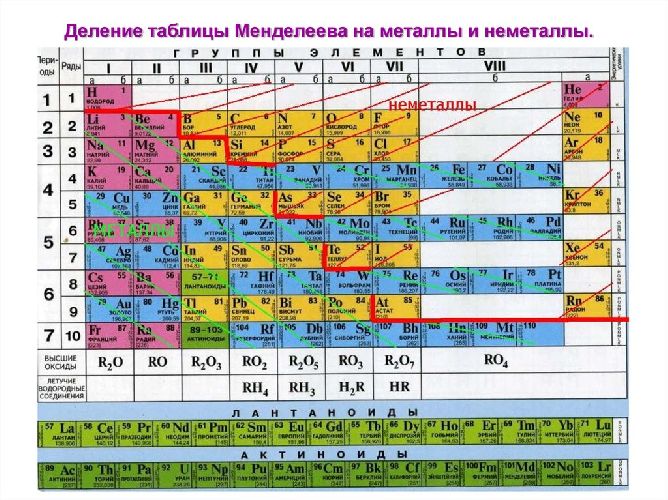
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:
