Осаждение металлов из растворов
Обновлено: 28.09.2024
Электролитическое осаждение - процесс выделения металла на катоде при прохождении через раствор (электролит) постоянного тока. Обычно электролитами служат такие растворы, в которых металл присутствует в виде сульфата или хлорида, находящихся в диссоциированном состоянии: MeSO4 ↔ Ме 2+ + SO4 2- . Часть молекул воды тоже диссоциирует Н2О ↔ Н + + ОН - . Находящиеся в растворе ионы под действием электрического тока движутся к электродам: положительно заряженные ионы (катионы) направляются к электроду, соединенному с отрицательным полюсом источника тока - к катоду, а отрицательно заряженные ионы (анионы) - к положительному электроду, аноду. На электродах ионы теряют заряд, выделяясь в виде атомов (молекул), или образуют химические соединения.
Закон Фарадея. Закон Фарадея устанавливает, что при разложении различных соединений одним и тем же количеством электричества на электродах выделяются количества вещества, пропорциональные их электрохимическим эквивалентам: , где: т - количество выделенного на электроде вещества, мг; I - сила тока, а; t - время прохождения тока, сек; q — электрохимический эквивалент (количество вещества выделяемого одним кулоном электричества - током в 1 а в течение 1 сек).
Для выделения грамм-эквивалента любого иона через электролит необходимо пропустить одно и то же количество электричества, равное 96520 к. Это число называют числом Фарадея и обозначают - F. Подставляя значение электрохимического эквивалента, получаем: .
Выход по току и коэффициент использования энергии. При электролизе часть тока расходуется непроизводительно. На катоде может выделяться не только металл, но и водород. Образовавшийся катодный осадок может подвергаться окислению и растворяться. При электролизе неизбежна некоторая утечка тока. Указанные причины сниженают выход по току, который определяется отношением количества фактически отложившегося на катоде вещества к тому количеству вещества, которое соответствует прошедшему через электролит количеству электричества: , где: - количество вещества, практически отложившееся на электроде; - теоретическое количество отложенного вещества.
При электролизе около электродов собираются продукты электролиза и образуется гальванический элемент, дающий ток в обратном направлении. Электродвижущая сила такого тока называется электродвижущей силой поляризации. В результате возникновения электродвижущей силы поляризации электролиз может прекратиться, если не увеличить напряжения на электродах. Минимальное напряжение внешнего источника тока, которое необходимо приложить к электродам, чтобы началось разложение электролита, называется напряжением разложения.
Таким образом, не вся электрическая энергия расходуется на электролиз; часть ее идет на преодоление сопротивлений и прочие неизбежные потери. Поэтому важным показателем электролизной установки является коэффициент использования энергии.
Коэффициент использования энергии - отношение количества энергии, теоретически необходимого для электролиза , к израсходованному количеству энергии : .
Энергия, теоретически необходимая для получения при электролизе единицы массы металла, определяется умножением количества электричества, необходимого для осаждения металла, на напряжение разложения: .
Катодный процесс. На катоде разряжаются катионы: Ме 2+ + 2е = Me.Процесс присоединения электронов называется восстановитальным. В результате приведенной реакции образуется осадок, формирование которого идёт в 3 стадии: 1) адсорбции иона на поверхности катода; 2) разряда иона; 3) образования кристаллической решетки и роста кристалла.
В зависимости от режима электролиза металлы могут осаждаться или в виде плотного осадка равномерной толщины, или в виде порошка, или в виде рыхлого кристаллического слоя (губчатые осадки). Иногда образуются древовидные отростки, называемые дендритами.
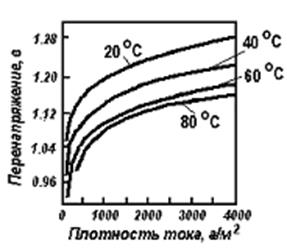
Рисунок 13.1 – Зависимость ή от Dk и Т
При электролитическом осаждении металла стараются получать плотный осадок, равномерного строения. В некоторых случаях получениют порошкообразные катодные осадки. На качество катодного осадка влияет введение в электролит коллоидов (желатины, столярного клея), которые адсорбируются поверхностью растущих на катоде кристаллов, обволакивают кристаллические центры и препятствуют их дальнейшему росту; поэтому катодный осадок получается мелкокристаллической структуры. Адсорбируемый слой коллоидов концентрируется на выпуклостях, имеющихся на катодной поверхности, и, препятствуя их дальнейшему росту, способствует выравниванию поверхности катодного осадка.
Присутствующие в растворах ионы водорода могут разряжаться на катоде вместе с ионами металла, если потенциал выделения водорода равен или меньше потенциала выделения металла. Потенциал выделения водорода зависит от материала катода, от состояния его поверхности. Наименьший потенциал выделения водорода наблюдается на губчатой платине. Зависимость перенапряжения водорода от плотности тока может быть выражена эмпирическим уравнением Тафеля: , где: — плотность тока; а и b — постоянные (а зависит от материала электрода, состояния его поверхности, состава электролита и температуры, b расчитывается по формуле: ).
Для выделения водорода со скоростью, соответствующей плотности тока, требуется дополнительная затрата энергии на восстановление иона водорода: Н + + ē → Н, чтоприводит к перенапряжению . различен на различных металлах, некоторые металлы катализируют реакцию.
С увеличением возрастает, с повышением Т - уменьшается (рисунок 1). Образование Н2 слагается из следующих стадий: 1) дегидратация ионов водорода, 2) разряд ионов водорода, 3) образования молекул водорода на поверхности катода; 4) отрыва пузырьков водорода с катода и выделения их в газовую фазу. Эта цепь процессов может быть изображена следующей схемой: Н3О + → Н + → → → Н2↑. Последняя стадия - выделение образовавшегося на катоде водорода - протекает тем успешнее, чем меньше поверхностное натяжение на границе жидкость - газ и чем оно больше на границе электрод - жидкость.
Выделение электроположительных металов происходит без особых затруднений, осаждение же электроотрицательных металлов идет успешно только при малых концентрациях водородного иона в электролите или при высоком перенапряжении водорода. Катодное осаждение кадмия и цинка возможно потому, что водород на них выделяется со значительным перенапряжением.
Прибавление в электролит коллоидов увеличивает перенапряжение водорода.
Анодный процесс. На аноде происходит разряд аниионов. При электролизе сернокислых растворов к аноду идут ионы гидроксила и кислотного остатка. Из этих двух ионов разряжаться на аноде будет тот, у которого потенциал более электроотрицательный, т. е. ион гидроксила. Так как гидроксильная группа после потери заряда неустойчива, то разряд иона гидроксила сопровождается образованием воды и выделением кислорода у анода: 4ОН - - 4е = 2Н2О + О2.
В кислых электролитах происходит разряд молекул воды: Н2О - 2е = 2Н + + 0.5О2.
При высокой плотности тока осадки получаются крупнокристаллическими, непрочно связанными с поверхностью катода, при низкой - мелкокристаллические, плотно пристающие к катоду.
На характер катодного осадка значительно влияет присутствие различных загрязнений в электролите. Одни примеси способствуют образованию древовидных наростов, другие приводят к получению дырчатых катодных отложений.
Из более концентрированных растворов получают катодные осадки плотные и мелкокристаллические; с понижением концентрации электролита осадок становится все менее плотным, наконец, рыхлым и даже порошковидным, легко осыпающимся с катода.
Разделение и осаждение металлов, получение конечных продуктов
Наиболее распространенные методы разделения и выделения металлов и их соединений из растворов — осаждение (электролиз, цементация, перевод в нерастворимые соединения, кристаллизация), сорбция, экстракция. Выбор наиболее рационального метода должен производиться в каждом отдельном случае с учетом ряда факторов, из которых первостепенное значение имеют состав поступающего на осаждение раствора и требования, предъявляемые к чистоте конечной продукции. Например, в медной промышленности применяют электролиз для переработки богатых растворов и цементацию меди — для осаждения меди при концентрации менее 15 г/л [20, 76].
Осаждение металлов производят электролизом, цементацией, восстановлением соединений до металла водородом, разложением комплексных солей.
Электролиз используют для извлечения металлов из очищенных растворов после выщелачивания (электроосаждение) и для получения чистых металлов из черновых продуктов (электрорафинирование). Этот метод получил широкое применение в гидрометаллургии меди, цинка, кадмия и марганца.
При цементации вытеснение ионов одного металла из растворов его солей производя ионами другого металла, расположенного выше в ряду напряжений (более электроотрицательного). Медь цементируют железом; или чугунной стружкой, железным скрапом губчатым железом, обезоловяненными консервными банками; золото — цинковой стружкой, цинковой и алюминиевой пылью; кадмий — цинковой пылью, никель —
кобальтовым порошком. Цементацию металлов производят в различных. аппаратах периодического или непрерывного действия (конусах барабанах, желобах, чанах, ваннах, аппаратах кипящего слоя).
Кроме того, никель, кобальт и медь осаждают из аммиачных растворов восстановлением их до металла водородом под давлением 3,5—5 МПа.
Осаждение меди или никеля из аммиачных растворов производят также разложением образовавшихся при выщелачивании комплексных углеаммониевых солей этих металлов. Медь осаждается в виде черной окиси меди, а никель — в виде карбоната. В результате дистилляции получают газообразный амиак и углекислоту, которые улавливают и вновь используют в процессе.
Часто металлы осаждаются в виде нерастворимых соединений: гидроокисей, сульфидов, ксантогенатов, карбонатов, вольфраматов, молибдатов и др. При оптимальном рН среды можно практически полностью отделить молибден от вольфрама в виде сульфида из растворов, содержащих вольфрамат натрия тиосоединения молибдена. Большое распространение в гидрометаллургических процeccax получил гидролиз, при котором возможно селективное осаждение некоторых металлов в виде гидроокисей иди основных шей.
При кристаллизации значительная часть извлекаемого металла осаждается в результате упарки и охлаждения раствора или изменения рН среды. Таким образом выделяют из раствора сульфат натрия при хлорирующем обжиге пиритных огарков и сульфат марганца при сернокислотном выщелачивании марганцевых руд. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых не должно превышать тысячных долей процента.
В некоторых случаях, особенно при получении полупроводниковых соединений редких металлов, требуется, чтобы суммарное содержание всех примесей не превышало 0,05—0,1%. Поэтому полученные соединения перечищают (растворяют или разлагают их, затем повторно осаждают, часто завершающей стадией осаждения является электролиз, кристаллизация или восстановление до металла водородом).
Сорбционные и экстракционные методы извлечения металлов из растворов для значительного повышения концентрации их и очистки от вредных примесей получили широкое распространение в технологии урановых, золотосодержащих, вольфрамовых, молибденовых, медных и редко-метальных руд [20, 46, 92].
В качестве сорбентов применяют иониты— вещества, способные к обмену ионами с окружающим раствором и практически не растворимые в применяемых в гидрометаллургии растворителях. В зависимости от характера обмениваемых ионов эти вещества делят на катиониты и аниониты.
Наибольшее распространение получила сорбция осветленных растворов в колонках с неподвижным слоем ионита. Однако в урановой и золотодобывающей промышленности успешно внедрена сорбция металла ионитами из жидкой фазы пульпы — бесфильтрационная сорбция. Возможность применения такого способа определяется значительной разницей в крупности ионита и выщелачиваемого материала, что позволяет отделить ионит пропусканием пульпы через сито с отверстиями соответствующего размера. При осуществлении такого варианта ионообменного процесса значительно упрощается и делается более экономичной технологическая схема вследствие исключения операций предварительного фильтрования пульпы. Весьма эффективно совмещение йоннообменной сорбции с выщелачиванием из руды полезных компонентов (ионообменное выщелачивание), позволяющее значительно повысить технико-экономические показатели гидрометаллургического процесса.
Для последующей десорбции металлов из ионитов (элюирование) применяют растворы различных реагентов — нитрата аммоний или натрия, хлористого натрия, аммиака, едкого натра, углекислого натрия, минеральных кислот и др.
Во многих случаях сорбция металлов характеризуется высокими технологическими показателями. Так, емкость анионита по урану составляет 30—50 кг/м 3 смолы в набухшем состоянии, извлечение металла из раствора достигает 98—99,8 %, На 1 м 3 загруженной смолы сорбируется 12—23 кг урана в сутки. Еще более высокая емкость получена по вольфраму и молибдену — до 160 кг/м 3 анионита.
Продолжительность использования ионообменных сорбентов во многих случаях определяется постепенным снижением их емкости вследствие частичного «отравления» ионитов, образования инертных пленок и разрушения обменных групп. Кроме того, неизбежны механические потери ионитов. Например, после двух лет работы опытной установки, на которой уран извлекался непосредственно из пульпы, общие потери ионита вследствие истирания составили 23 %, а емкость уменьшилась на 10 %. Скорость поглощения и элюирования осталась прежней.
В качестве сорбента применяют также активированный уголь, главным образом для сорбции золота и серебра из цианистых растворов.
Очистка растворов от мышьяка и сурьмы, коллоидальной серы и некоторых других вредных примесей осуществляется сорбцией их гидратом окиси железа.
Все большее значение в гидрометаллургии приобретают экстракционные процессы, при которых водный раствор солей металлов вступает в контакт с несмешивающейся с водой органической жидкостью, извлекающей определенные металлы из исходного раствора в виде комплексных соединений. Эффективность экстракционного процесса количественно характеризуется коэффициентом распределения извлекаемого металла
где Y — концентрация металла в органической фазе; X — то же, в водной фазе.
Практически процесс экстракции может быть реализован при коэффициенте распределения металла не менее 0,3—0,5. Высокое извлечение или практически полное разделение металлов достигается при условии противоточного осуществления процесса, когда операция экстракции повторяется многократно.
В ряде случаев при экстракции достигается высокая селекция металлов из растворов, позволяющая осуществить разделение весьма близких по химическим свойствам элементов.
В качестве экстрагентов используют амины, кетоны, карбоновые кислоты, спирты, эфиры, фосфорсодержащие соединения.. В качестве растворителей экстрагентов (разбавителей) применяют углеводороды и их хлорпроизводные.
После отделения органической фазы от водной производится реэкстракцкя металла обработкой органической фазы щелочным или кислым раствором, а иногда только водой. В реэкстракте можно получить концентрацию извлекаемых элементов во много раз выше, чем в исходном растворе.
Экстракцию широко применяют в урановой промышленности. В настоящее время значительные успехи по экстракции достигнуты также в технологии извлечения и очистки многих редких и некоторых цветных металлов — меди, никеля, кобальта, тантала, ниобия, вольфрама, молибдена, рения, индия, германия, гафния и др.
В промышленности для экстракции применяют смесители, отстойники, колонны с насадкой, тарельчатые колонны с пульсацией, центробежные экстракторы и т. д.
СПОСОБ ОСАЖДЕНИЯ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ Российский патент 2002 года по МПК C22B3/44
Изобретение относится к гидрометаллургии цветных металлов, а именно к способам их осаждения из растворов.
Известен способ осаждения цветных металлов из растворов путем обработки их в автоклаве серусодержащим соединением - сероводородом (Симонс К.С. Сероводород как гидрометаллургический реагент.- М.: Гидрометаллургия, Металлургия, 1971, с.264-275). Недостатком способа является токсичность и горючесть реагента.
Наиболее близким к предлагаемому способу по технической сущности и достигаемому результату является способ осаждения никеля и кобальта из растворов серусодержащим соединением - раствором тиосульфата, в частности раствором тиосульфата кальция (авт. св. СССР 810844, МПК С 22 В 23/04, опубл. в 1981).
В раствор солей никеля и кобальта вводят расчетное количество раствора тиосульфата кальция, нагревают до температуры 110-160 o С и выдерживают при перемешивании в течение времени, достаточного для получения необходимой полноты выделения.
Технология получения раствора тиосульфата кальция включает следующие операции: во-первых, получение пульпы тиосульфата кальция путем растворения серы в водной суспензии извести и окисления образующегося раствора кислородсодержащим газом и, во-вторых, отделение раствора тиосульфата кальция от твердой компоненты пульпы. Основными составляющими твердой компоненты пульпы являются кальций, сера элементарная и сера сульфитная. Соотношение Ж:Т в пульпе тиосульфата кальция зависит от условий ведения процесса и чистоты реагентов.
Недостатком способа осаждения цветных металлов раствором тиосульфата кальция является необходимость отделения раствора от твердой компоненты пульпы, что делает процесс более дорогим.
Задачей изобретения является удешевление процесса осаждения цветных металлов из растворов тиосульфатом кальция. Технический результат при осуществлении изобретения выражается в исключении из технологического процесса операции отделения раствора от твердой компоненты пульпы и в снижении расхода осадителя. В предлагаемом способе это достигается при использовании в качестве осадителя тиосульфата кальция в виде пульпы, содержащей как жидкий, так и твердый компонент.
Сущность метода состоит в следующем. При осаждении цветных металлов раствором тиосульфата, в частности раствором тиосульфата кальция, происходит взаимодействие ионов металлов с продуктами реакций диспропорционирования тиосульфатной серы, что приводит к осаждению насыщенных серой сульфидов: CuS, NiS2, CoS2. Первой реакцией ступенчатого диспропорционирования тиосульфатной серы является разложение тиосульфата в кислой среде на серу элементарную и сульфитную:
S2O3 2- +Н + -->НS03 - +S 0 .
Вторая реакция имеет вид:
3НSO3 - --->S 0 +2SO4 2- +H2O+Н + .
При вводе в раствор цветных металлов пульпы тиосульфата, кальция, основными составляющими которой являются элементарная сера и сульфит кальция в твердой компоненте пульпы и раствор тиосульфата кальция в жидкой компоненте, помимо указанных реакций происходит разложение сульфита по реакции: SO3 2- +H + -->HSO 3- .
Ввод в раствор цветных металлов вместе с твердой компонентой пульпы тиосульфата кальция дополнительного количества сульфитной серы способствует появлению дополнительного количества новообразованной элементарной серы.
Частицы элементарной серы, присутствующие в твердой компоненте пульпы тиосульфата кальция, являются дополнительными центрами зародышеобразования, что позволяет ускорить процесс сульфидообразования и получать более крупные и раскристаллизованные сульфиды.
Наличие в твердой компоненте соединений кальция способствует ускоренному формированию крупных кристаллов гипса.
Одновременное введение сульфита кальция и элементарной серы с раствором тиосульфата кальция позволяет не только ускорить процесс сульфидообразования, но и получать хорошо флотируемые пульпы.
Ввод в раствор цветных металлов вместе с раствором тиосульфата кальция дополнительного количества элементарной и сульфитной серы, содержащихся в твердой компоненте пульпы тиосульфата кальция, приводит при сохранении той же полноты выделения к снижению расхода раствора тиосульфата кальция, т.е. к снижению расхода осадителя.
Таким образом, в случае использования пульпы тиосульфата кальция, во-первых, исключается операция отделения раствора тиосульфата от твердой компоненты пульпы, что удешевляет процесс, и, во-вторых, снижается расход осадителя - раствора тиосульфата кальция за счет использования сульфитной и элементарной серы, содержащихся в твердой компоненте пульпы, для сульфидирования цветных металлов.
Предлагаемый способ осуществляется следующим образом.
Осаждение цветных металлов раствором и пульпой тиосульфата кальция из четырех видов модельных растворов (медный, железисто-медный, никелевый и кобальтовый) вели в автоклаве при повышенной температуре: 90 o С и 130 o С. Загрузка осадителя в раствор осуществлялась на холоду, автоклав нагревали до температуры процесса и выдерживали при этой температуре 45 мин. В твердой компоненте пульпы тиосульфата кальция содержалось, %: S 0 -1,3; Sсульфит.- 22,4; Sобщ.- 23,7; Са - 31,8. Концентрация серы "тио" в жидкой компоненте пульпы (в растворе) составляла 122 г/л. Соотношение объема пульпы (Ж:Т=16) и объема раствора определяли экспериментально при фильтрации пульпы. В примере это соотношение равно величине 1,1. Кек после фильтрации пульпы промывали водой, промводу смешивали с раствором тиосульфата кальция и смесь отправляли на осаждение. В опытах с использованием пульпы тиосульфата кальция к осадителю добавляли такое же количество воды. Удельный расход осадителя считали как отношение количества серы "тио" в осадителе к количеству осажденного металла.
Результаты опытов представлены в табл. 1.
Применение пульпы тиосульфата кальция вместо раствора тиосульфата кальция позволяет существенно снизить расход осадителя.
Осаждение цветных металлов раствором и пульпой тиосульфата кальция из модельного раствора состава, г/л: Ni - 10,2; Cu - 2,3; Co - 0,52; Fеобщ - 3,2; Fе 2+ - 1,1, Н2SO4 - 30,1 проводили в автоклаве следующим образом: I - нейтрализация модельного раствора пульпой известняка при 90 o C в течение 10 мин, II - ввод осадителя и выдержка при температуре 90 o С в течение 45 мин, III - выдержка при температуре 130 o С в течение 80 мин. Полученную пульпу направили на серосульфидную флотацию. Расход осадителя составил величину 1,55 г Sтио на г суммы никеля, меди и кобальта в исходном растворе для обоих вариантов осаждения, т. е. для варианта осаждения раствором тиосульфата кальция и для варианта осаждения пульпой тиосульфата кальция.
Результаты опытов приведены в табл. 2.
Использование пульпы тиосульфата кальция позволяет получать богатые по цветным металлам концентраты с низким содержанием кальция, при этом содержание никеля в хвостах и в растворе ниже, чем в случае использования раствора тиосульфата кальция.
Очистку цинкового электролита, содержащего 4 г/л меди и 162 г/л цинка, проводили раствором и пульпой тиосульфата кальция при температуре 95 o С в течение двух часов.
Расход тиосульфата кальция определяли в процентном отношении к стехиометрии реакции Сu 2+ +S2O3 2- +H2O-->CuS+SO4 2- +2H + .
Результаты опытов приведены в табл. 3.
Факт получения более быстрого и глубокого осаждения меди из раствора в случае использования пульпы тиосульфата кальция позволяет сделать вывод о возможности снижения расхода серы "тио", подаваемой в электролит, т.е. о возможности снижения расхода осадителя.
Применение пульпы тиосульфата кальция вместо раствора тиосульфата кальция для осаждения цветных металлов из растворов позволяет сделать процесс дешевле за счет исключения операции отделения раствора от твердой компоненты пульпы, а также снизить расход осадителя, при этом ускоряется процесс сульфидообразования, более быстро формируются кристаллы гипса и получаются лучше флотируемые пульпы.
Похожие патенты RU2182183C2
- Калашникова Мария Игоревна
- Волков Леонид Васильевич
- Шнеерсон Яков Михайлович
- Четвертаков Вадим Валерьевич
- Нафталь Михаил Нафтольевич
- Бельский Андрей Николаевич
- Петров Алексей Федорович
- Шаркий Роман Юрьевич
- Крупнов Леонид Владимирович
- Гник Василий Иванович
- Лапшина Нина Алексеевна
- Саверская Татьяна Петровна
- Бышевич Наталья Викторовна
- Гудков Александр Сергеевич
- Минеев Геннадий Григорьевич
- Богородский Андрей Владимирович
- Калашникова М.И.
- Кескинова М.В.
- Шнеерсон Я.М.
- Четвертаков В.В.
- Епифоров Александр Владимирович
- Гудков Сергей Станиславович
- Баликов Станислав Васильевич
- Богородский Андрей Владимирович
- Шнеерсон Яков Михайлович
- Лапин Александр Юрьевич
- Позднякова Наталья Николаевна
- Косицкая Татьяна Юрьевна
- Шнеерсон Я.М.
- Лапин А.Ю.
- Мальцев Н.А.
- Волков Л.В.
- Сухобаевский Ю.Я.
- Калашникова М.И.
- Кукин А.В.
- Салтыков П.М.
- Полосухин В.А.
- Макарова Т.А.
- Макаров Д.Ф.
- Нафталь М.Н.
- Марков Ю.Ф.
- Буркова И.И.
- Саверская Т.П.
- Шестакова Р.П.
- Григорьева Л.Г.
- Линдт В.А.
- Оружейников А.И.
- Николаев Ю.М.
- Филиппов Ю.А.
- Полосухин В.А.
- Сухобаевский Ю.Я.
- Ширшов Ю.А.
- Абрамов Н.П.
- Мальцев Н.А.
- Розенберг Ж.И.
- Вашкеев В.М.
- Козлов С.Г.
- Густов С.Г.
- Нафталь М.Н.
- Баскаев П.М.
- Сухобаевский Ю.Я.
- Шестакова Р.Д.
- Храмцова И.Н.
- Асанова И.Н.
- Петров А.Ф.
- Полосухин В.А.
- Линдт В.А.
- Волянский И.В.
- Кропачев Г.А.
- Макарова Т.А.
- Вашкеев В.М.
- Дмитриев И.В.
- Бельский А.Н.
- Козлов С.Г.
- Гоготина В.В.
- Шур М.Б.
- Лапшина Н.А.
- Железова Т.М.
- Выдыш А.В.
- Нафталь Михаил Нафтольевич
- Гавриленко Александр Филиппович
- Марков Юрий Фаустович
- Кропачев Георгий Альбертович
- Линдт Виктор Альбертович
- Николаев Юрий Михайлович
- Телешман Ирина Ивановна
- Шестакова Раиса Давлетхановна
- Обеднин Александр Константинович
- Вашкеев Виктор Максимович
- Сухобаевский Юрий Яковлевич
- Розенберг Жак Иосифович
- Ширшов Юрий Александрович
- Козлов Сергей Григорьевич
Иллюстрации к изобретению RU 2 182 183 C2
Реферат патента 2002 года СПОСОБ ОСАЖДЕНИЯ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ
Изобретение относится к гидрометаллургии цветных металлов, а именно к способам их осаждения из растворов. Способ осаждения цветных металлов из растворов включает обработку раствора пульпой тиосульфата кальция, предварительно полученной в результате реакции растворения серы в водной суспензии извести и окисления образующегося раствора кислородсодержащим газом и содержащей в жидком компоненте раствор тиосульфата кальция, а в твердом компоненте - кальций, серу элементарную и серу сульфитную. Способ позволяет снизить расход осадителя и удешевить процесс. 3 табл.
Формула изобретения RU 2 182 183 C2
Способ осаждения цветных металлов из растворов, включающий их обработку серусодержащим соединением - тиосульфатом кальция, отличающийся тем, что обработку ведут с использованием тиосульфата кальция в виде пульпы, содержащей как жидкий, так и твердый компонент.
СПОСОБ ВЫДЕЛЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ ИЗ СОЛЯНОКИСЛОГО РАСТВОРА Российский патент 1999 года по МПК C25C1/20
Изобретение относится к области гидрометаллургии и может быть использовано для электрохимического извлечения благородных металлов из солянокислых растворов.
При переработке дезактивированных катализаторов, содержащих платину и палладий, осаждении хлорпалладозамина и гексахлорплатината, растворении черновой платины и в других процессах первичной и вторичной переработки сырья образуются солянокислые растворы.
Одним из наиболее перспективных методов выделения благородных металлов из таких растворов является электрохимическое осаждение.
Известно выделение палладия из солянокислого раствора, содержащего палладий и платину в электролизере с катионообменной мембраной. Палладий селективно выделяется на титановом катоде до тех пор, пока его концентрация не станет равной концентрации платины в растворе. Затем раствор перерабатывают для извлечения платины (см. патент US 4382845, C 25 C 1/20, 1983).
Однако этот способ не предназначен для полного извлечения всех платиновых металлов, которые могут содержаться в растворах переработки первичного и вторичного сырья, а направлен исключительно на извлечение палладия.
Известен также способ извлечения благородных металлов (платины) из солянокислого раствора электролизом на углеродном волокнистом материале в электролизере с катионообменной мембраной при плотности тока 150-1000 А/м 2 (см. Варенцова В. И. и Варенцов В. К. Электролитическое извлечение платины и рения на проточные углеграфитовые катоды из солянокислых растворов. Цветные металлы, 1997, N 1, с 46-48).
Этот способ не пригоден для извлечения благородных металлов из растворов с высокими концентрациями, т.к. катоды быстро "забиваются" благородными металлами и требуют замены. Для извлечения благородных металлов необходимо сжигать катод.
Недостатком способа является высокое остаточное содержание платины в растворе.
Наиболее близким к предложенному является способ выделения благородных металлов из солянокислого раствора путем электрохимического осаждения на титановом катоде в электролизере с катионообменной мембраной.
Исходная концентрация платиновых металлов в католите 1-50 г/л. Анолит представляет собой раствор серной кислоты или сульфата натрия для исключения выделения хлора на аноде.
Плотность тока в процессе электролиза составляет 1-100 А/дм 2 (100-10000 А/м 2 ) (см. заявку DE 4227179, C 25 C 5/02, 1993).
Недостатком способа является высокое остаточное содержание благородных металлов в католите, например остаточное содержание рутения после электролиза составляет 0,19 г/л.
Это приводит к необходимости доизвлекать эти металлы другими методами, что усложняет и удорожает процесс.
Кроме того, метод не пригоден для извлечения благородных металлов из разбавленных растворов.
Задачей изобретения является создание такого способа извлечения благородных металлов из солянокислого раствора, который был бы универсален, т.е. позволял извлекать благородные металлы из растворов с любой концентрацией с высокой степенью извлечения и достижением низкой остаточной концентрации, а также упрощение процесса, его экологическая безопасность.
Для решения этой задачи в способе выделения благородных металлов, включающем их электрохимическое осаждение на плоском титановом катоде в электролизере с катионообменной мембраной, осаждение ведут при плотности тока 200-300 А/м 2 и скорости циркуляции католита 1-1,5 м 3 /м 2 •ч, а затем проводят осаждение на трехмерном проточном катоде из графитового материала при габаритной плотности тока 20-60 А/м 2 и скорости циркуляции католита 2-3,5 м 3 /м 2 •ч.
Кроме того, в качестве анолита используют раствор серной кислоты с концентрацией 5-10%.
Способ также отличается тем, что трехмерный проточный катод из графитового материала после насыщения благородными металлами обрабатывают смесью 6 М соляной кислоты и 1 М азотной кислоты и возвращают на осаждение.
Способ осуществляют следующим образом.
Солянокислый раствор, содержащий индивидуальные благородные металлы или их смесь, а также примеси неблагородных металлов, таких как алюминий, железо и т. д., циркулируют через катодное пространство электролизера со скоростью 1-1,5 м 3 /м 2 •ч (объем раствора в м 3 , проходящий вдоль поверхности электрода в м 2 в единицу времени в час).
В качестве катода используют титановую пластину. Катодная плотность тока 200-300 А/м 2 . Катодное пространство отделено от анодного катионообменной мембраной. В анодной камере, заполненной раствором серной кислоты, на электроде из свинца, легированного сурьмой (10-12 мас.%) и серебром (1-2 мас.%), или на электроде из платинированного титана выделяется кислород.
Доля хлора, выделяющегося на аноде, не превышает 1,5 об.% Низкое содержание хлора в анодных газах обеспечивают: наличие катионообменной мембраны, предотвращающей попадания ионов хлора в анолит, и использование раствора серной кислоты с концентрацией 5-10%.
После выделения не менее 90% благородных металлов процесс осаждения проводят с использованием трехмерного проточного катода из графитового материала при габаритной плотности тока 20-60 А/м 2 и скорости циркуляции электролита 2-3,5 м 3 /м 2 •ч.
Снижение плотности тока ниже 200 А/м 2 на плоском титановом катоде и ниже 20 А/м 2 на трехмерном проточном катоде уменьшает извлечение благородных металлов.
Увеличение плотности тока выше 300 А/м 2 на титановом катоде и выше 60 А/м 2 на трехмерном проточном катоде практически не влияет на показатели электролиза, но увеличивает затраты электроэнергии.
Увеличивается также доля ионов хлора, переносимых в анолит, а значит и выделение хлора на аноде.
При снижении скорости циркуляции ниже 1 м 3 /м 2 •ч при работе с титановым катодом и ниже 2 м 3 /м 2 •ч при работе с трехмерным проточным катодом снижается производительность, возможен перегрев электролита, снижается селективность мембраны и, следовательно, увеличивается перенос благородных металлов и хлор-ионов в анолит.
При повышении скорости циркуляции выше 1,5 м 3 /м 2 •ч при работе с титановым катодом и выше 3,5 м 3 /м 2 •ч при работе с трехмерным проточным катодом не происходит полного извлечения благородных металлов, возрастает их остаточное содержание в растворе.
Процесс осаждения можно проводить в электролизере фильтр-прессного типа с катионнообменными мембранами, в катодных пространствах которого расположены плоский титановый катод и трехмерные проточные катоды из графитового материала.
Количество трехмерных катодов определяется исходной концентрацией благородных металлов и необходимой величиной их остаточной концентрации.
После выделения благородных металлов на титановом катоде раствор, содержащий микроконцентрации благородных металлов, направляют в следующие ячейки для осаждения на трехмерных проточных катодах.
Осаждение можно проводить и в разных электролизерах с мембранами и различными катодами: один электролизер с титановым катодом, а другой или другие с трехмерными проточными катодами из графитового материала.
Независимо от способа осуществления процесса после насыщения трехмерного проточного катода из графитового материала благородными металлами из расчета 125-130 г металлов на 100 г углеродного материала трехмерный катод извлекают из катодной камеры и углеродный материал обрабатывают смесью 6 М соляной и 1 М азотной кислоты при нагревании до 60 o C в течение 2-3 ч. Не менее 95% осажденных на трехмерном катоде благородных металлов переходят в раствор. Углеродный материал промывают водой и используют повторно.
Такой способ обработки катодов взамен их сжигания для извлечения осажденных благородных металлов приводит к экономии углеродного материала, увеличивает срок их эксплуатации, что в свою очередь упрощает и удешевляет процесс, делает его экологически безопасным за счет исключения выделения хлора при сжигании катода.
Возможность такой регенерации трехмерных проточных катодов из графитового материала обусловлена использованием их при извлечении благородных металлов из растворов с низкой концентрацией.
Способ иллюстрируется следующими примерами.
Пример 1. Раствор, образующийся при переработке дезактивированных алюмопалладиевых катализаторов, содержащий, г/л: палладий 1,4; хлорид алюминия 16; хлорид железа 1,2; соляная кислота 114, в количестве 10 л циркулировали через катодную камеру электролизера фильтр-прессного типа.
Катодные камеры отделены от анодных катионообменной мембраной МФ-4-СК.
В качестве аналита использовали раствор 5% серной кислоты.
Катод-титановая пластина. Катодная плотность тока 200 А/м 2 . Скорость циркуляции католита 1,5 м 3 /м 2 •ч.
После выделения на титановом катоде 13,61 г палладия (97,2%) раствор с концентрацией 0,039 г/л направляли на осаждение в катодную камеру с трехмерным проточным катодом из углеродной ткани ТН-14 или углеродного ватина с титановым токоподводом-держателем.
При габаритной плотности тока 30 А/м 2 и скорости циркуляции раствора 2,5 м 3 /м 2 •ч на катоде выделилось 0,32 г палладия.
В следующей катодной ячейке при скорости циркуляции 2,5 м 3 /м 2 ч и габаритной плотности тока 40 А/м 2 на трехмерном катоде выделилось 0,066 г палладия. В растворе осталось 0,004 г палладия (0,0004 г/л). Суммарное извлечение палладия составило 99,97%, выход по току 33,7%.
Пример 2. Раствор, образующийся при выщелачивании платины из дезактивированного алюмоплатинового катализатора, содержащий, г/л: платину 0,58, соляную кислоту 142, хлорид алюминия 26 в количестве 10 л, последовательно пропустили через две катодные камеры электролизера фильтр-прессного типа, в котором анодные и катодные камеры разделены катионообменной мембраной 4МФ-СК, а анодное пространство заполнено 10% серной кислотой.
В первой камере на титановым катоде при плотности тока 300 А/м 2 и скорости циркуляции католита 1 м 3 /м 2 •ч выделилось 5,30 г платины (91,4%). На второй стадии при плотности тока 30 А/м 2 и скорости циркуляции электролита 2 м 3 /м 2 •ч на трехмерном катоде из углеродного материала - ватина выделилось 0,45 г платины. После электролиза в растворе осталось 0.050 г платины. Суммарное извлечение платины составило 99,14%, а выход по току 26%. Анодный выход по току для хлора изменялся от 1,1 до 1,4%.
Пример 3. Маточный раствор, после осаждения гексахлорплатината, содержащий, г/л: платину 0,427, палладий 0,053, иридий 0,015, железо 0,174, соляную кислоту 55,06, хлорид аммония 50, в количестве 10 л последовательно пропускали через катодную камеру электролизера, в котором анодная и катодная камеры разделены катионообменной мембраной, а анодное пространство заполнено 5% серной кислотой. В катодной камере на титановом катоде при катодной плотности тока 200 А/м 2 и скорости циркуляции электролита 1,2 м 3 /м 2 •ч выделяется 4,091 платины (95,8%), 0,492 г палладия (92,8%) и 0,132 г иридия (88,0%). Раствор, содержащий 0,0179 г/л платины, 0,0038 г/л палладия и 0,0018 г/л иридия, направили во второй электролизер с катионообменными мембранами. На трехмерном катоде из углеродного материала - ватина при габаритной плотности тока 30 А/м 2 и скорости циркуляции электролита 3 м 3 /м 2 •ч выделяется 0,123 г платины и 0,031 г палладия и 0,012 г иридия и на третьей стадии на трехмерном катоде из углеродного материала при габаритной плотности 50 А/м 2 , скорости циркуляции электролита 2,5 м 3 /м 2 •ч выделилось 0,003 палладия и 0,047 г платины, 0,001 иридия. В растворе после трехстадийного электролиза осталось: 0,004 г палладия, 0,009 г платины и 0,005 иридия. Суммарное извлечение платины составило 99,8%, палладия 99,2%, иридия 96,7%, выход по току 6,9%.
Анодный выход по току для хлора изменялся от 0,89 до 1,2.
Пример 4. Маточный раствор после осаждения черновой платины, содержащий, г/л: палладий 0,332, платину 0,881, родий 0,010, иридий 0,052, осмий 0,010, золото 0,010, железо 0,167; соляную кислоту 122,7, в количестве 10 л пропускали последовательно через три катодные камеры электролизера фильтр-прессного типа, в котором катодные и анодные камеры были разделены катионообменной мембраной, а анодные заполнены 10% раствором серной кислоты. В первой камере на титановом катоде при плотности тока 300 А/м 2 и скорости циркуляции 1 м 3 /м 2 •ч выделилось 5,900 г платины; 2,926 г палладия; 0,076 родия; 0,359 иридия; 0,068 г осмия; 0,094 г золота. Во второй камере на трехмерном катоде из углеродного материала при габаритной плотности тока 20 А/м 2 при скорости циркуляции электролита 3,5 м 3 /м 2 •ч выделилось 2,71 г платины; 0,289 г палладия; 0,012 г родия; 0,106 г иридия; 0,018 осмия и 0,003 золота и в третьей камере на трехмерном катоде из углеродного материала при габаритной плотности тока 60 А/м 2 и скорости циркуляции 2 м 3 /м 2 •ч выделилось 0,174 г платины; 0,098 г палладия; 0,003 родия; 0,044 иридия; 0,005 осмия. В растворе после трехстадийного электролиза осталось: 0,026 г платины; 0,007 г палладия; 0,009 родия; 0,011 г иридия; 0,009 осмия; 0,003 золота. Суммарное извлечение платины составило -99,7%; палладия- 99,8%; родия - 91,0%; иридия 97,9%; осмия -91,0%; золота - 97,0%. Суммарный выход по току составлял 6,7%. Анодный выход по току для хлора изменялся от 0,96 до 1,4%.
После использования трехмерного проточного катода из графита до насыщения его благородными металлами из расчета 128 г металла на 1000 г углеродного материала, катод извлекли из катодной камеры и углеродный материал обработали смесью 6 М соляной и 1 М азотной кислоты при нагревании до 60 o C в течение 2,5 ч. В результате обработки 95% благородных металлов перешли в раствор. Углеродный материал промыли водой и катод использовали повторно.
Приведенные примеры показывают, что способ универсален, т.е. пригоден для переработки растворов с любой концентрацией благородных металлов с высоким извлечением и низким остаточным содержанием.
Способ экологичен, т.к. практически исключает выделение хлора на аноде и сжигание катодов из углеродного материала, при котором выделяется хлор, находящийся в порах катода.
Способ экономичен и прост, т.к. заменяет дорогостоящую операцию сжигания катодов их регенерацией.
Похожие патенты RU2131485C1
- Карманников В.П.
- Игумнов М.С.
- Драенков А.Н.
- Татаринцев А.Н.
- Ковалев В.В.
- Клеандров В.Т.
- Юрасова О.В.
- Карманников В.П.
- Игумнов М.С.
- Клименко М.А.
- Федулова Т.В.
- Юрасова О.В.
- Драенков А.Н.
- Татаринцев А.Н.
- Ковалев В.В.
- Клеандров В.Т.
- Карманников В.П.
- Игумнов М.С.
- Драенков А.Н.
- Татаринцев А.Н.
- Ковалев В.В.
- Клеандров В.Т.
- Юрасова О.В.
- Карманников В.П.
- Назаров Ю.Н.
- Игумнов М.С.
- Туляков Н.В.
- Юрасова О.В.
- Клименко М.А.
- Горбатенко В.П.
- Драенков А.Н.
- Евстифеев А.А.
- Ожигов А.В.
- Блюденов И.В.
- Яушев М.Г.
- Зигрид Херрманн[De]
- Уве Ландау[De]
- Карманников В.П.
- Клименко М.А.
- Елютин А.В.
- Федулова Т.В.
- Фролова И.В.
- Юрасова О.В.
- Драенков А.Н.
- Татаринцев А.Н.
- Кутилов В.А.
- Ковалев В.В.
- Драенков А.Н.
- Татаринцев А.Н.
- Кутилов В.А.
- Звонцов Б.Ф.
- Ковалев В.В.
- Карманников В.П.
- Клименко М.А.
- Елютин А.В.
- Федулова Т.В.
- Фролова И.В.
- Юрасова О.В.
- Петрова Е.А.
- Самахов А.А.
- Макаренко М.Г.
- Антонов А.А.
- Морозов А.В.
- Крыщенко К.И.
- Зигрид Херрманн[De]
- Увеландау[De]
Реферат патента 1999 года СПОСОБ ВЫДЕЛЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ ИЗ СОЛЯНОКИСЛОГО РАСТВОРА
Изобретение относится к области гидрометаллургии благородных металлов и может быть использовано для их электрохимического выделения из солянокислого раствора. Исходный солянокислый раствор, содержащий благородные металлы, циркулируют со скоростью 1-1,5 м 3 /м 2 •ч в катодной камере электролизера с катионообменными мембранами. Осаждение проводят на титановом катоде при плотности тока 200-300 А/м. Затем раствор направляют в катодную камеру с трехмерным проточным катодом из графитового материала. Осаждение ведут при габаритной плотности тока 20-60 А/м и скорости циркуляции католита 2- 3,5 м 3 /м 2 •ч. Анолит - раствор серной кислоты концентрацией 5-10%. Трехмерный катод после насыщения регенерируют смесью 6М соляной и 1М азотной кислоты. Результат изобретения - создание способа, пригодного для использования в растворах с любой концентрацией благородных металлов с высоким извлечением, низким остаточным содержанием, экологичного и экономичного. 2 з.п. ф-лы.
Формула изобретения RU 2 131 485 C1
1. Способ выделения благородных металлов из солянокислого раствора, включающий электрохимическое осаждение на плоском титановом катоде в электролизере с катионообменной мембраной, отличающийся тем, что осаждение ведут при плотности тока 200 - 300 А/м 2 и скорости циркуляции католита 1 - 1,5 м 3 /м 2 • ч, а затем проводят осаждение на трехмерном проточном катоде из графитового материала при габаритной плотности тока 20 - 60 А/м 2 и скорости циркуляции католита 2 - 3,5 м 3 /м 2 • ч. 2. Способ по п.1, отличающийся тем, что в качестве анолита используют раствор серной кислоты с концентрацией 5 - 10%. 3. Способ по п.1, отличающийся тем, что трехмерный проточный катод из графитового материала после насыщения благородными металлами обрабатывают смесью 6М соляной кислоты и 1М азотной кислоты и возвращают на осаждение.
Осаждение
Осаждение металлов из растворов производят электролизом, цементацией, кристаллизацией, получением нерастворимых соединений и другими методами.
Электролиз применяют как для извлечения металлов из очищенных растворов после выщелачивания (электроосаждение), так и для получения чистых металлов из черновых продуктов (электрорафинирование).
Цементация – электрохимический процесс, протекающий на поверхности металлических частиц с растворенными ионами, при котором происходит растворение металла (железа, цинка) и вытеснение из раствора в осадок меди, золота, серебра:
CuSO4 + Fe →FeSO4 + Cu;
2Na[Au(CN)2] + Zn →2Au + Na2[Zn(CN)4];
2Na[Ag(CN)2] + Zn →2Ag + Na2[Zn(CN)4].
При цементации вытеснение ионов одного металла из раствора его солей осуществляется другим металлом, расположенным выше в ряд напряжений (более электроотрицательным). Так, для цементации меди применяют железо. Для цементации золота и серебра—цинковую и алюминиевую пыль. Для цементации кадмия — цинковую пыль; никеля — кобальтовый порошок.
В медьсодержащих растворах потенциал меди Е = 0,52 В, железа – Е = -0,44 В. Наиболее эффективно цементация меди проходит при рН растворов в пределах 2,5 – 3 [20].
Теоретический расход железа на цементацию меди (Сu2+) составляет 0,874 весовых единицы на единицу меди. Практически расход, как правило, больше (1,2 – 3 кг на 1 кг осаждаемой меди) за счет того, что в процессе цементации помимо осаждения меди протекают другие реакции, в числе которых: 2Fe3++ Fe →3Fe2+ и H+ + Fe →3Fe2+ H2, которые ведут к непроизводительным затратам железа.
При цементации меди используют железный скрап (стружку, обрезки проволоки). Стружку предварительно дробят, а проволочные обрезки измельчают для увеличения поверхности. К недостаткам этих окислителей относится непостоянство химического состава, наличие масла, лака, затрудняющих управление процессом.
Более эффективно использование губчатого железа и железного порошка, широко применяющихся при схеме выщелачивание – цементация - флотация. При этом выщелачиваются окисленные минералы меди, а затем производится её цементация на порошке железа и флотационное извлечение вместе с сульфидными минералами меди.
При цементации золота и серебра из используется цинковый порошок. В ряду напряжений металлов в цианистых растворах потециал цинка (Е = -1,26 В) более отрицателен, чем потенциал золота (Е = -0,54 В) и серебра (Е = -0,31 В). Золото и серебро осаждаются полностью. Протекают также побочные реакции вытеснения водорода цинком, восстановления кислорода а также образование цианидов цинка. Поэтому расход цинка на практике в десятки раз выше, чем теоретически потребный (0,19 г цинка на 1 г золота).
Для предотвращения обратного растворения золота и других благородных металлов растворы перед цементацией деаэрируют, а затем просачивают через слой дисперсного цинка.
При осаждении благородных металлов цинковой пылью получаются сложные по составу шламы. Наряду с золотом и серебром в них содержится избыток цинка, гидроксид и карбонат цинка, цианид цинка, карбонат и сульфат кальция, соединения меди, сурьмы, селена и др. Для удаления примесей наиболее распространён способ кислотной обработки осадка, прокалки (сушки) и плавки его на золото-серебряный сплав.
Цементацию металлов проводят в различных аппаратах периодического или непрерывного действия (конусах, барабанах, желобах, чанах, ваннах, фильтрах, аппаратах кипящего слоя).
Кристаллизация — это способ осаждения извлекаемого металла при упаривании и охлаждении раствора или изменении рН среды. Таким способом выделяют из раствора сульфат натрия при хлорирующем обжиге пиритных огарков или сульфат марганца при сернокислотном выщелачивании марганцевых руд. В вольфрамовой и молибденовой промышленности кристаллизацию применяют для получения чистых вольфрамата и молибдата аммония, содержание вредных примесей в которых измеряется тысячными долями процента.
Для получения нерастворимых соединений растворы после выщелачивания подвергается воздействию соответствующих химических реагентов. В результате чего ценные компоненты переходят в форму нерастворимых соединений, которые выпадают в осадок.
Так, при взаимодействии с известью, аммиачной водой при рН до 2,3-3,5 осаждаются из растворов железо, алюминий:
Fe2(SO4)3 + 3СаО + 3H2O →2Fe(OH)3↓ +3СаSO4↓;
Al2(SO4)3 + 6NH4OH→2Al(OH)3↓ + 3(NH4)2SO4.
При рН свыше 6,0 осаждается гидроксид меди:
CuSO4 + 2NH4OH→Cu(OH)2↓ + (NH4)2SO4.
При действии NaOH на раствор урана осаждается полиуранат натрия:
2UO2SO4 + 6NaOH→Na2U2O7↓ +2Na2SO4 + 3H2O.
Таким же универсальным методом является осаждение сульфидов металлов путём обработки растворов сернистым натрием, сероводородом или другими растворимыми сульфидами:
Варьируя рН селективно осаждают такие металлы, как медь, никель, кобальт, железо и др. Медь и олово осаждаются в сильнокислых растворах, другие металлы – в слабокислых.
Химическое осаждение проводят в обычных реакторах с механическим или пневматическим перемешиванием с последующим обезвоживанием осадка в сгустителях или на фильтрах.
Читайте также:
