Основания это электролиты которые диссоциируют на катионы металла и анионы
Обновлено: 14.05.2024
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы , минимальна и становится больше при диссоциации по каждой следующей ступени.
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 « MgOH + + OH – (первая ступень)
MgOH + « Mg 2+ + OH – (вторая ступень)
Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.
H + + RO – « ROH « R + + OH –
Амфотерность объясняется малым различием прочности связей R–H и О–Н.
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др.
Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H + + SnO2 2– « Sn(OH)2 « Sn 2+ + 2OH –
+2H2O ¯ основные свойства
Солями называют электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы.
Средние соли, растворимые в воде, диссоциируют практически полностью:
Кислые соли диссоциируют ступенчато, например:
NaHCO3 « Na + + HCO3 – (первая ступень)
Анионы кислых солей в дальнейшем диссоциируют незначительно:
HCO3 – « H + + CO3 2– (вторая ступень)
Диссоциацию основной соли можно выразить уравнением:
CuOHCl « CuOH + + Cl – (первая ступень)
CuOH + « Cu +2 + OH – (вторая ступень)
Катионы основных солей по второй ступени диссоциируют в незначительной степени.
Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла. Например:
Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например:
Количественной характеристикой электролитической диссоциации является степень диссоциации a, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N)
Степень диссоциации выражается в долях единицы или процентах.
По степени диссоциации все электролиты делятся на сильные (a>30%), слабые (a<3%) и средней силы (a - 3-30%).
Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся:
| Кислоты | HCl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HMnO4, H2SeO4 |
| Основания | NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
| Соли | растворимые в воде (приложение, табл.2) |
Слабые электролиты частично диссоциируют на ионы при растворении в воде. К ним относятся вода, почти все органические кислоты (СН3СООН, HCOOR, H2C2O4 и др.), некоторые минеральные кислоты (HNO2, HCN, H2S, H2SiO3, H2CO3 и др.), гидроксид аммония NH4OH, а также все основания металлов, кроме оснований щелочных и щелочноземельных металлов.
Диссоциация оснований, кислот, солей

В данном видеофрагменте учащиеся знакомятся с уравнениями диссоциации электролитов: оснований, кислот и солей. Все приведенные уравнения диссоциации объясняются и акцентируется внимание на наиболее сложных моментах, подчеркивается общность свойств электролитов. Это поможет сконцентрировать внимание учащихся по этой теме.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Диссоциация оснований, кислот, солей"
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
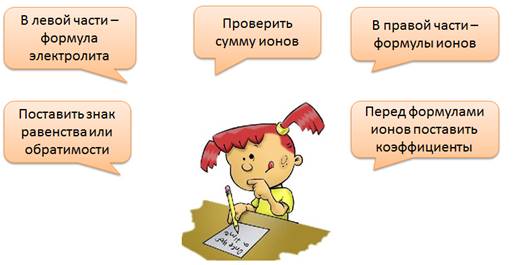
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
HCl = H + + Cl -
H2SO4 = 2H + + SO4 2-
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H + + NO2 -
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
1) H3PO4 ⇆ H + + H2PO4 -
2) H2PO4 - ⇆ H + + HPO4 2-
3) HPO4 2- ⇆ H + + PO4 3-
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH = Na + + OH -
Ca(OH)2 = Ca 2+ + 2OH -
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
1) Cu(OH)2 ⇆ CuOH + + OH -
2) CuOH + ⇆ Cu 2+ + OH -
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
NaCl = Na + + Cl -
Al2(SO4)3 = 2Al 3+ + 3SO4 2-
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4 + ), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
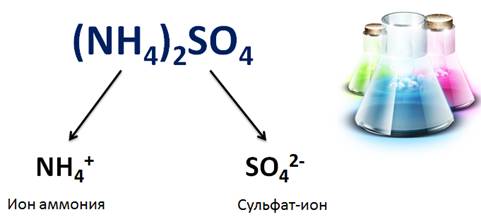
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)

Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H + , а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH – . Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H + . Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
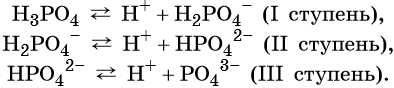
От образовавшегося на первой ступени кислотного остатка H2PO4 – последующий отрыв иона H + происходит гораздо труднее из-за наличия отрицательного заряда на анионе, поэтому вторая ступень диссоциации протекает гораздо труднее, чем первая. На третьей ступени протон должен отщепляться от аниона HPO4 2– , поэтому третья ступень протекает лишь на 0,001%.
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Такие свойства оснований, как взаимодействие с кислотами, кислотными оксидами, амфотерными гидроксидами и способность изменять окраску индикаторов, обусловлены наличием в растворах OH – -ионов.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
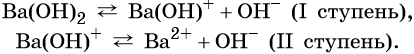
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
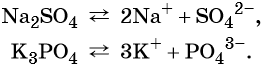
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
10. Степень диссоциации слабых электролитов
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Диссоциация оснований
Ступенчатая диссоциация оснований объясняет образование основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.Диссоциируют амфотерные электролиты слабо.
H + + RO - ↔ ROH ↔ R + + OH -
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др. Диссоциацию амфотерного гидроксида, например Sn(OH)2 , можно выразить уравнением (суммарно):
2H + + ZnO2 2- ↔ Zn(OH)2 ↔ Zn 2+ + 2OH -
В кислой среде амфотерный гидроксид ведет себя, как основание:
ZnOH + ↔ Zn 2+ + OH -
В щелочной среде амфотерный гидроксид ведет себя, как кислота:
Диссоциация солей
Соли -это электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы. Средние соли, растворимые в воде, диссоциируют практически полностью
Кислые соли - это электролиты, которые диссоциируют на катионы металла и кислотный остаток, содержащий в своем составе атом водорода. Например,
натрия гидросульфит гидросульфит – ион
Основные соли – это электролиты, которые диссоциируют на кислотный остаток и катион металла, содержащий в своем составе гидроксо- группу. Например,
CuOHCl ↔ CuOH + + Cl -
гидроксомеди хлорид гидроксомеди – катион
Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла и кислотный остаток. Например,
Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например,
натрия тетрагидроксоцинкат (II) тетрагидроксоцинкат (II) - ион
тетраамминмеди (II) сульфат тетраамминмеди (II) - ион
Степень диссоциации
Количественной характеристикой электролитической диссоциации является степень диссоциации α, равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации выражается в долях единицы или процентах. По степени диссоциации все электролиты делятся на сильные (α > 30%), слабые (α < 3%) и средней силы (3% < α < 30%).
Степень диссоциации зависит:
· от природы растворителя; например, СоCl2 – синего цвета, а ионы Со 2+ - розового цвета. Если хлорид кобальта растворить в воде, то раствор становится розовым, образуется много ионов. Много молекул распались на ионы. Если растворить в спирте, то раствор становится синим, т.к. в основном находятся молекулы
· от концентрации (разбавления раствора)
зеленый р-р голубой р-р
При разбавлении равновесие сместилось вправо, т.к. при разбавлении увеличилось число катионов.Таким образом, чем больше концентрация, тем меньше степень диссоциации, а чем меньше концентрация, тем больше степень диссоциации.
· от природы электролита: цинк реагирует с равными объемами кислот одинаковой молярной концентрации идет с разными скоростями:
Реакция с хлороводородной кислотой протекает бурно и быстрее, чем с уксусной кислотой, так как она образует меньшее число ионов.
· от добавления к раствору первого электролита электролита II с одноименным ионом степень диссоциации электролита уменьшается.
Рассмотрим опыт:В пробирку нальем 1 мл раствора воды и добавим по 2 капли растворов NH4OH и фенолфталеина. Раствор окрасится в малиновый цвет. Затем добавим электролит с одноименным ионом – NH4Cl (твердый), при этом раствор обесцвечивается:
C увеличением числа одноименных ионов NH4 + при добавлении хлорида аммония равновесие смещается влево, так как катионы аммония связывают почти все гидроксид - ионы в молекулы NH4OH и ранее малиновый раствор обесцвечивается.
· от температуры: при ее повышении степень диссоциации увеличивается для слабых электролитов (эндотермическая реакция).
· от числа атомов кислорода в молекуле кислот одного и того же элемента. Чем больше атомов кислорода в молекуле кислот, тем больше степень ее диссоциации.
Например, HСlO (хлорноватистая кислота) – практически не распадается на ионы, она слабее угольной (a < 0,17 %),
Читайте также:
