Основными являются оксиды только металлов
Обновлено: 01.06.2024
Окси́д (о́кисел, о́кись) — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Окислами называется класс минералов, представляющих собой соединения металла с кислородом (см. Категория:Окислы).
Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов.
Содержание
Классификация
В зависимости от химических свойств различают:
- солеобразующие оксиды
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO); Оксиды металлов, валентность которых I-II, кроме ZnO.
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2); Оксиды металлов с валентностью V-VII и оксиды неметаллов.
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3); Оксиды металлов с валентностью III-IV и ZnO.
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент образует несколько оксидов, то в их названиях указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распостранены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства: Основные оксиды.
Примечание:кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода = щелочь
3. Сильноосновный оксид + кислотный оксид = соль
4. Основный оксид + водород = металл + вода
Примечание: металл менее активный, чем алюминий.
Химические свойства: Кислотные оксиды.
Некоторые оксиды, например SiO2, с водой не реагируют, поэтому их кислоты получают косвенным.
2. Кислотный оксид + основной оксид = соль
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 = соль2 + летучий оксид
Химические свойства: Амфотерные оксиды.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)
ZnO + CaO = CaZnO2 (при сплавлении)
Получение оксидов
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2. Обжиг или горение бинарных соединений в кислороде:
3. Термическое разложение солей:
4. Термическое разложение оснований или кислот:
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
6. Взаимодействие некоторых металлов с водой при высокой температуре:
7. Взаимодействие солей с кислотными оксидами при нагревании с выделением летучего оксида:
9. При действии водоотнимающих веществ на кислоты и соли:
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Оксид" в других словарях:
оксид — окисел, глинозем Словарь русских синонимов. оксид сущ., кол во синонимов: 3 • глинозем (8) • окисел … Словарь синонимов
ОКСИД — ОКСИД, а, муж. (спец.). То же, что окисел. | прил. оксидный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Оксид — – соединение химического элемента с кислородом. Оксиды – весьма распространенный тип соединений, содержащихся в земной коре и во вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд… … Нефтегазовая микроэнциклопедия
оксид — ОКСИД, а, м Соединение химического элемента с кислородом; окислы. Оксид цинка применяют как белый пигмент, активатор … Толковый словарь русских существительных
оксид — oksidas statusas T sritis chemija apibrėžtis Elemento junginys su deguonimi. atitikmenys: angl. oxide rus. окисел; окись; оксид … Chemijos terminų aiškinamasis žodynas
Оксид азота(II) — Оксид азота(II) … Википедия
Оксид углерода(II) — Оксид углерода(II) … Википедия
Оксид меди(I) — Оксид меди(I) … Википедия
Оксид бериллия — Общие Систематическое наименование Оксид бериллия Традиционные названия Бромеллит Химическая формула BeO Эмпирическая формула BeO Физические свойства … Википедия
Основные оксиды
![]()
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
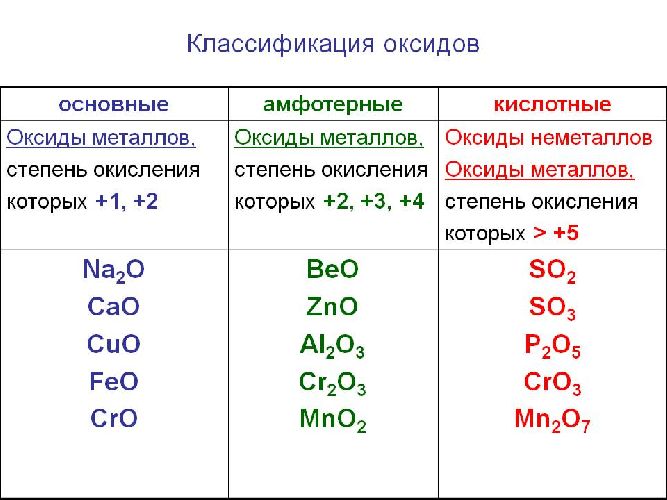
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
![Классификация оксидов]()
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
![Основные оксиды и соответствующие им основания]()
Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
При нагревании разлагаются только оксиды ртути и благородных металлов:
![Оксид ртути]()
Рис. 3. Оксид ртути.
Список основных оксидов:
Название оксида Химическая формула Свойства Оксид кальция CaO негашенная известь, белое кристаллическое вещество Оксид магния MgO белое вещество, малорастворимое в воде Оксид бария BaO бесцветные кристаллы с кубической решеткой Оксид меди II CuO вещество черного цвета практически нерастворимое в воде Оксид ртути II HgO твердое вещество красного или желто-оранжевого цвета Оксид калия K2O бесцветное или бледно-желтое вещество Оксид натрия Na2O вещество, состоящее из бесцветных кристаллов Оксид лития Li2 O вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Осно́вные оксиды — оксиды 1, 2 и некоторых 3 валентных металлов. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr
- оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra
- оксиды переходных металлов в низших степенях окисления
Металлы в основных оксидах обычно проявляют степень окисления 1 и 2.
Характерные реакции
- Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция — сильное основание:
- Основные оксиды взаимодействуют с кислотами, образуя соответствующие соли:
- К образованию солей также приводит реакция основных оксидов с кислотными оксидами:
- И с амфотерными оксидами:
Все основные оксиды
- Li2O; Na2O; K2O; CuO; Ag2O; MgO; CaO; SrO; BaO; HgO; MnO; CrO; NiO;
- Оксид франция Fr2O; Cs2O; Rb2O; FeO
См. также
Ccылки
Смотреть что такое "Основные оксиды" в других словарях:
ОКСИДЫ — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Современная энциклопедия
Оксиды — ОКСИДЫ, соединения химических элементов (кроме фтора) с кислородом. При взаимодействии с водой образуют основания (основные оксиды) или кислоты (кислые оксиды), многие оксиды амфотерны. Большинство оксидов при обычных условиях твёрдые вещества,… … Иллюстрированный энциклопедический словарь
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
Оксиды металлов — это соединения металлов с кислородом. Многие из них могут соединяться с одной или несколькими молекулами воды с образованием гидроксидов. Большинство оксидов являются основными, так как их гидроксиды ведут себя как основания. Однако некоторые… … Официальная терминология
оксиды — Соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (наприме, Na2О, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды подразделяют на… … Справочник технического переводчика
ОКСИДЫ — хим. соединения элементов с кислородом (устаревшее название окислы); один из важнейших классов хим. веществ. О. образуются чаще всего при непосредственном окислении простых и сложных веществ. Напр. при окислении углеводородов образуются О.… … Большая политехническая энциклопедия
Основные факты — Нефть – это горючая жидкость, представляющая собой сложную смесь из углеводородов. Различные типы нефти существенно различаются по химическим и физическим свойствам: в природе она представлена и в виде черного битумного асфальта, и в форме… … Нефтегазовая микроэнциклопедия
Оксиды — [oxides] соединение химического элемента с кислородом. По химическим свойствам все оксиды делятся на солеобразующие (например, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) и несолеобразующие (например, СО, N2O, NO, H2O). Солеобразующие оксиды… … Энциклопедический словарь по металлургии
Основной оксид
Осно́вные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся:
- оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr
- оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra
- оксиды металловпереходных элементов в низших степенях окисления
Металлы в основных оксидах обычно проявляют валентность I и II.
- Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им основные гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция – сильное основание:
- Основные оксиды взаимодействуют с кислотами, образуя соотвествующие соли:
- К образованию солей также приводит реакция основных оксидов с кислотными оксидами:
- И с амфотерными оксидами:
- Li2O; Na2O;
- Оксид калия K2O;
- Оксид серебра Ag2O; MgO; CaO;
- Оксид стронция SrO; BaO;
- Оксид ртути HgO; MnO; Fe2O3;
- Оксид хрома(II) CrO;
- Оксид никеля NiO;
Смотреть что такое "Основной оксид" в других словарях:
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид свинца(II) — Общие … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
Читайте также: