Озон металл или неметалл
Обновлено: 18.05.2024
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
В 1840 году ученый Кристиан Фридрих Шенбейн раскрыл структуру и свойства озона. Полученный газ он назвал «озоном» (с греч. языка «пахнуть»). Кристиан Фридрих Шенбейн провел эксперимент, где озон вытеснил йод из иодида калия.
Получение озона
Существует несколько способов получения молекул озона.
- Из кислорода воздуха при электрическом разряде
- 3О2 = 2О3 – 284 кДж
В промышленных условиях газ получают в озонаторах и отделяют фракционной перегонкой.
- 3О2 = 2О3 – 284 кДж
- Взаимодействие охлажденной концентрированной серной кислоты и пероксида бария
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Данной реакцией синтезируют озон в лабораториях.
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
- Температура сжижения -112˚С (газ приобретает оттенок индиго).
- Температура плавления -197˚С.
- Молярная масса озона – 48 г/моль.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Озоновый слой может разрушить война. При испытании ядерного оружия выделяется огромное количество энергии и образуются окислы азота, которые разрушают озон. В период с 1952 по 1971 года при ядерных взрывах в атмосферу попало около 3 млн т окислов азота.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
Озон (газ)

Озон возникает естественным образом в верхних слоях атмосферы, где он образуется в результате фотохимической реакции. Он также образуется в результате электрических разрядов и химических реакций, в результате которых кислород выделяется при охлаждении. В нижних слоях атмосферы он является токсичным загрязнителем для животных и растений. Однако в стратосфере он образует защитный слой для жизни на Земле, поглощая ультрафиолетовое излучение Солнца.
1. Физические и химические свойства
Озон - это голубой газ с сильным, проникающим запахом, опасный для дыхания и более окисляющий, чем кислород. Он имеет плотность 1,66 и сжижается при температуре -112°C, образуя крайне нестабильную жидкость цвета индиго. Он в холодном состоянии окисляет йод и почти все металлы, особенно ртуть и серебро; он вытесняет хлор, бром и йод из их соединений с водородом или металлами; он максимально окисляет серную, фосфорную и мышьяковую кислоты; он также разрушает органические материалы (пробку, резину) путем окисления. С другой стороны, с различными ненасыщенными органическими соединениями он дает нестабильные аддитивные соединения, озониды.
2. Используется
Озон используется благодаря своим окислительным и бактерицидным свойствам для дезинфекции воздуха в замкнутых пространствах, стерилизации воды, отбеливания текстиля и выдержки вина и древесины. При лечении ран (озонотерапия) он применяется в виде струи или в водном растворе, в одной или нескольких дозах в зависимости от полученного результата. Он используется в приготовлении высыхающих масел и в синтезе некоторых растительных эссенций.
3. Атмосферный озон
3.1. Стратосферный озон и преимущества озонового слоя
Озон играет фундаментальную роль в балансе окружающей среды Земли. 90% атмосферного озона находится на высоте от 20 до 50 км. Этот "озоновый слой" объясняет существование на этих же высотах области большой стабильности в отношении вертикальных обменов - стратосферы. Хотя он является незначительным компонентом атмосферы (его максимальная относительная концентрация, наблюдаемая на высоте 25 км, не превышает 5-6 миллионных долей по объему), озон является единственным поглотителем ультрафиолетового солнечного излучения с длиной волны от 240 до 300 нанометров. Это поглощение позволяет поддерживать жизнь животных и растений на Земле, устраняя коротковолновое излучение, которое может разрушать клетки живой материи и подавлять фотосинтез. По этой причине с 1980-х годов существует большая озабоченность по поводу ущерба, нанесенного стратосферному озоновому слою в результате деятельности человека.
3.2. Тропосферный озон и его влияние на живые организмы
На высоте ниже 10 км уровни озона очень низкие, порядка 0,03 миллионных долей. Однако, в отличие от своей полезной роли в стратосфере, озон действует у земли как окислитель, который нарушает фотосинтез и может вызвать повреждение растений (коричневые пятна на листьях, соответствующие некрозу). В районах с высоким уровнем загрязнения, где его уровень может быть намного выше, озон непосредственно влияет на здоровье человека, особенно на дыхательную систему и слизистые оболочки. Озон раздражает легкие, вызывая кашель, респираторный дискомфорт, а иногда даже отек легких. Лечение после тяжелых ингаляций заключается в строгом покое под наблюдением врача.
Количество озона в атмосфере выражается как "уменьшенная толщина", т.е. вертикальная толщина столба, в котором был бы собран весь газ, при нормальной температуре и давлении. В среднем эта толщина составляет 2,5 мм.
4. Озоновая дыра
4.1. Открытие озоновой дыры
В 1985 году британские исследователи впервые сообщили о существовании озоновой дыры, а точнее, о значительном уменьшении толщины озонового слоя над Южным полюсом. Верхние слои атмосферы этого региона являются ареной бешеного цикла разрушения озона. Во время полярной зимы образование стратосферного воздушного вихря изолирует атмосферу Антарктики от остальной части Южного полушария. Затем температура стратосферы может опуститься до -85°C, что приведет к образованию ледяных облаков. Эти полярные облака фиксируют хлор в стратосфере в виде соляной кислоты (HCl) и нитрата хлора (ClONO2). В южную весну, когда Солнце вновь появляется в сентябре и октябре, его излучение вызывает диссоциацию хлора в результате фотохимической реакции. После этого запускается настоящая цепная реакция: каждый атом высвобожденного хлора может разрушить до 100 000 молекул озона. Этот процесс продолжается до ноября и уменьшает толщину слоя почти наполовину. К этому времени Солнце достаточно прогрело атмосферу, чтобы рассеять стратосферные облака. Полярный вихрь, ограничивавший озоновую дыру, исчезает, и богатый озоном воздух из средних широт просачивается обратно в стратосферу Антарктики. На Северном полюсе такая "дыра" в слое не образуется, а локальные дефициты озона наблюдаются с 1991 года. Это связано с циркуляцией воздуха, который сильно отличается от антарктического, и более мягкими зимними температурами.
4.2 Происхождение и последствия
Если некоторые природные факторы, такие как выброс сернистых газов при извержениях вулканов , всегда способствовали частичному и временному разрушению озонового слоя, то опасность, которую представляют промышленные выбросы хлора, ученые осуждают с 1980 года. Хлорфторуглероды (ХФУ), используемые в качестве аэрозольных пропеллентов, хладагентов или пенообразователей в некоторых жестких пенопластах, являются основной причиной разрушения озонового слоя. Многие другие химические вещества, такие как галоны (галогенизированные производные углеводородов), используемые в огнетушителях, а также некоторые растворители, такие как четыреххлористый углерод или бромистый метил, также способствуют образованию озоновой дыры. Все эти соединения чрезвычайно стабильны и могут оставаться в атмосфере в течение 50-100 лет. Они попадают на полюса и высвобождают свои атомы хлора (или брома), которые разрушают озон.
Истощая озоновый слой, человеческая деятельность поставила под угрозу нашу естественную защиту от солнца. Истощение стратосферного озона приводит к увеличению количества ультрафиолетового излучения, достигающего земли. Эти лучи могут повреждать ДНК человека, вызывать рак кожи и катаракту, а также другие заболевания. Они также оказывают вредное воздействие на растения и фитопланктон.
4.3. Международная осведомленность
С 1985 года (Венская конвенция) несколько международных конференций ознаменовали собой глобальное осознание необходимости защиты стратосферного озонового слоя и обеспечения ограничения воздействия человеческой деятельности на климат. Основные страны-производители ХФУ отказались от производства и использования этих озоноразрушающих газов. Сегодня гидрофторуглероды (ГФУ) и перфторуглероды (ПФУ), второе поколение заменителей ХФУ, безопасны для озонового слоя (хотя для его восстановления потребуются годы), но они являются мощными парниковыми газами, способствующими глобальному потеплению.
Газ озон: химические, физические свойства, формула, отличия и другое
Химический элемент озон - формула, строение и основные свойства газа
На уроках химии ученики знакомятся с таблицей Менделеева, а также изучают структурные формулы и производные разных веществ. Поскольку эта наука тесно связана со всеми сферами жизни человека, необходимо уделить ей внимание. Много интересной информации имеется об озоне. Химическим элементом, который его образует, выступает кислород. Газ делает состав воздуха пригодным для существования на суше.
- История открытия
- Способы получения
- Вещество в атмосфере
- Физические особенности
- Химическая природа
- Области использования
- Влияние на здоровье человека
- Занимательные факты
История открытия

Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23 o C. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.
Способы получения
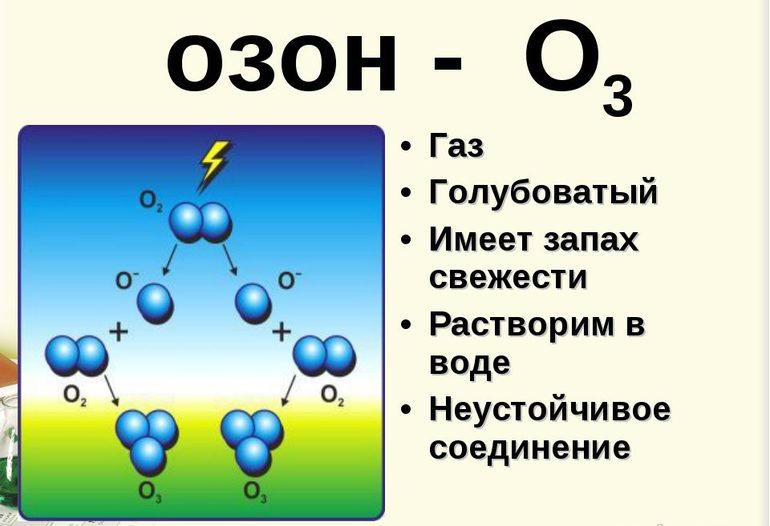
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
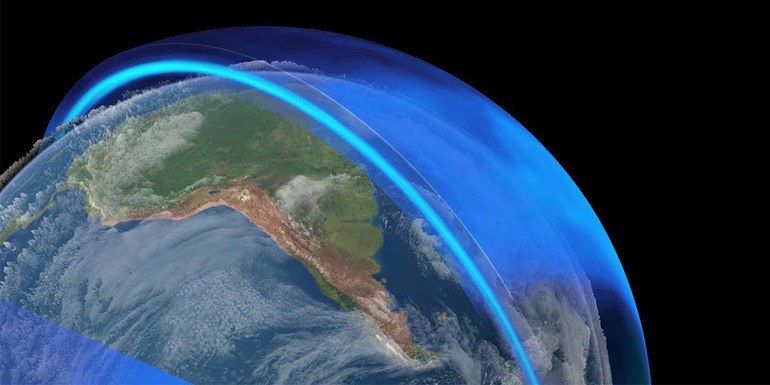
В последние годы специалисты уделяют много внимания появлению «озоновых дыр». В этих областях наблюдается значительно уменьшенный объём стратосферного вещества. Через такой тонкий газовый слой до Земли доходит жёсткое ультрафиолетовое излучение. Озон могут разрушать пыль, газы и различные естественные факторы.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности

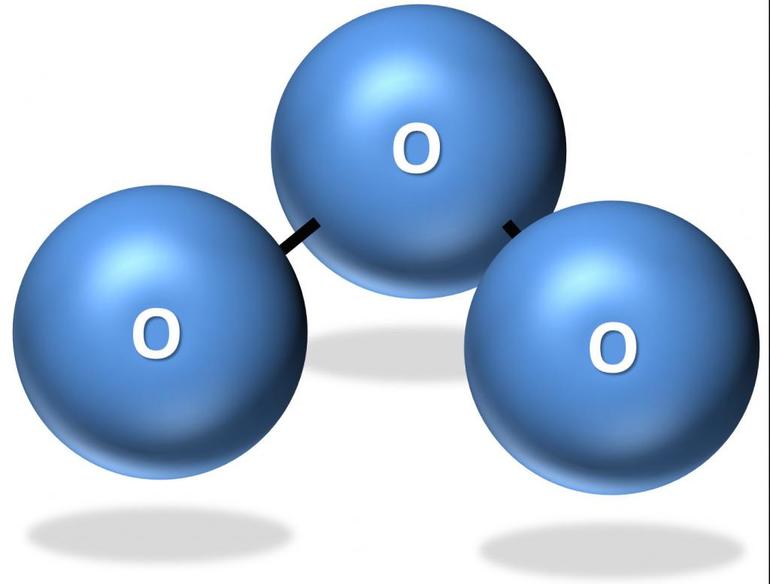
Вещество представляет аллотропную модификацию кислорода, состоящую из трёхатомных молекул. Химическая формула озона и обозначение — O 3 . При нормальных условиях вещество выглядит как голубой ядовитый газ с резким запахом, напоминающим металлический аромат. При сжижении преобразуется в жидкость оттенка индиго. В твёрдом состоянии выглядит как тёмно-синие или чёрные кристаллы. Полярная молекула отличается уголковым строением. Между атомами имеется две связи О-О.
Основные физические свойства озона:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .
Плотность озона в газообразном состоянии равна 2,1445 г/дм 3 , в жидком — 1,59 г/см 3 , в твёрдом — 1,73 г/см 3 . Ещё одна важная характеристика вещества — его молекулярная кристаллическая решётка.
O 3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа

Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Если смешать озон с концентрированным раствором аммиака, получится нитрит аммония с выделением белого дыма. Вещество также способно «чернить» изделия из серебра, образуя AgO и Ag2O3.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Озон разрушает все органические вещества, с которыми он контактирует. При реакции выделяется большое количество энергии. К примеру, такие вещества, как эфир, спирт или метан, самовоспламеняются, когда они соприкасаются с озонированным воздухом. При смешении этилена и озона произойдёт сильный взрыв.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
- стерилизация медицинских инструментов;
- отбеливание бумаги;
- очистка нефтепродуктов и масел;
- лабораторный и промышленный синтез.
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.

Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека

Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:

- Озон эффективно уничтожает бактерии и плесень.
- В малых концентрациях запах вещества может напоминать хлор, сернистый газ или даже чеснок.
- Озон образуется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- Он применяется в стоматологии вместо антибиотиков.
- Для очистки воды вещество начали использовать в 1898 году во Франции.
- Во время Первой мировой войны его применяли в качестве антисептического средства.
- Самая большая озоновая дыра была обнаружена над Антарктидой в 1985 году. Это явление отличается диаметром свыше 1000 км.
- Молнии Кататумбо считаются крупнейшим одиночным генератором озона в тропосфере нашей планеты.
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.
Озон металл или неметалл
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Содержание
Строение озона
Обе связи O-O в молекуле озона имеют одинаковую длину 1,272 Å. Угол между связями составляет 116,78° [1] . Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной с другим и наоборот. Молекула полярна, дипольный момент 0,5337 D [2] .
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу [3] . Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия [3] :
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали [когда?] Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проволками для получения электрического разряда [3] .
Физические свойства
- — 48 а.е.м. газа при нормальных условиях — 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху — 1,62 (1,658 [4] ).
- Плотность жидкости при −183 °C — 1,71 г/см³ — −111,9 °C. Жидкий озон — тёмно-фиолетового цвета. — −197,2 ± 0,2 °С (приводимая обычно т.пл. −251,4 °C ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению) [5] . В твёрдом состоянии — чёрного цвета с фиолетовым отблеском. в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом.
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен. — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1 : 100000.
Химические свойства
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 19 июля 2012.
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут [6] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (—78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
+ 3H_2O + O_2>" />
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить Серную кислоту как из элементарной серы, так и из диоксида серы:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
В газовой фазе озон взаимодействует с сероводородом с образованием двуокиси серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый нитрилперхлорат может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (-196 °C), атомарный водород взаимодействует с озоном с образованием супероксидного радикала с димеризацией последнего [7] :
Озон может образовывать озониды, содержащие анион O3 − . Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3, и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия [8] :
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na + или Li + [9] :
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция [7] :
Озон может быть использован для удаления марганца из воды с образованием осадка, который может быть отделён фильтрованием:
" />
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину [10] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлажденной концентрированной серной кислоты с пероксидом бария:
Биологические свойства
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм может приводить к преждевременной смерти. [11]
Наиболее опасное воздействие:
- на органы дыхания прямым раздражением и повреждением тканей
- на холестерин в крови человека с образованием нерастворимых форм, приводящим к атеросклерозу
- на органы размножения у самцов всех видов животных, в том числе и человека (вдыхание этого газа убивает мужские половые клетки и препятствует их образованию). При долгом нахождении в среде с повышенной концентрацией этот газ может стать причиной мужского бесплодия.
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³ [12]
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³ [12]
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³. [13]
Озон эффективно убивает плесень и бактерии.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения
- при получении многих веществ в лабораторной и промышленной практике
- для отбеливания бумаги
- для очистки масел
- для очистки воды и воздуха от микроорганизмов (озонирование)
- для дезинфекции помещений и одежды
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие [13] токсинов после обработки, тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина.
- лучшая, по сравнению с кислородом, растворимость в воде:
- По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия [14] перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В 21 веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности столь необходимых при применении данной техники [источник не указан 219 дней] .
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике [15] . Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона больший удельный вес, чем у жидкого кислорода (1,35 и 1,14 соответственно), а его температура кипения выше (минус 112° и минус 183°С соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона. При взрыве возникает движущаяся с огромной скоростью — по некоторым данным более 200 км/сек — детонационная волна и развивается разрушающее детонационное давление более 4000 атм, что делает применение жидкого озона невозможным при нынешнем уровне техники [16] .
Озон в атмосфере
![]()
Атмосферный озон играет важную роль для всего живого на планете. Образуя озоновый слой в стратосфере, он защищает растения и животных от жёсткого ультрафиолетового излучения. Поэтому проблема образования озоновых дыр имеет особое значение. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждать растения.
Примечания
См. также
Ссылки
- Чрезвычайно опасные вещества
- Озон
- Окислители
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Озон" в других словарях:
ОЗОН — (ново греч., от греч. ozo иметь сильный запах). Наэлектризованный кислород, с своеобразным запахом, химически сильно реагирующий. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ОЗОН [гр. ozon пахнущий] газ,… … Словарь иностранных слов русского языка
ОЗОН — ОЗОН, неустойчивый голубой газообразный аллотроп КИСЛОРОДА (О3). Имеет характерный резкий запах. Разлагается на молекулярный кислород. Присутствует в атмосфере, главным образом, в ОЗОНОВОМ СЛОЕ, где он образуется из кислорода под действием… … Научно-технический энциклопедический словарь
озон — а, м. ozone m. <гр. ozon пахнущий. Соединение из трех атомов кислорода; обладает характерным запахом, наблюдаемом при разряде электричества; образуется во время грозы, или при тихом электрическом разряде или при действии ультрафиолетовых лучей … Исторический словарь галлицизмов русского языка
ОЗОН, О3 — ОЗОН, О3, аллотропная форма кислорода; синий газ, tкип 111,95 шC. Озон обеспечивает сохранение жизни на Земле, т.к. озоновый слой атмосферы задерживает часть ультрафиолетовой радиации Солнца и поглощает инфракрасное излучение Земли, препятствуя… … Современная энциклопедия
ОЗОН — (от греч. ozon пахнущий), аллотропная модификация кислорода (О3). Обладает большой химической реактивностью и токсичностью. Газ синего цвета с резким запахом. Образуется из О2 при электрическом разряде (например, во время грозы) и под действием… … Экологический словарь
Озон — ОЗОН, О3, аллотропная форма кислорода; синий газ, tкип 111,95 °C. Озон обеспечивает сохранение жизни на Земле, т.к. озоновый слой атмосферы задерживает часть ультрафиолетовой радиации Солнца и поглощает инфракрасное излучение Земли, препятствуя… … Иллюстрированный энциклопедический словарь
озон — газ, кислород Словарь русских синонимов. озон сущ., кол во синонимов: 2 • газ (55) • кислород … Словарь синонимов
озон — Форма кислорода, доля которой в атмосфере очень мала, но озон имеет жизненное значение для биосферы, так как абсорбирует ультрафиолетовую составляющую солнечной радиации … Словарь по географии
ОЗОН — отряд «зелёных» особого назначения ОЗН ОЗоН основы законодательства о нотариате юр … Словарь сокращений и аббревиатур
ОЗОН — (от греч. ozon пахнущий) О3, аллотропная модификация кислорода. Газ синего цвета с резким запахом, tкип 112 .С, сильный окислитель. При больших концентрациях разлагается со взрывом. Образуется из О2 при электрическом разряде (напр., во время… … Большой Энциклопедический словарь
ОЗОН — ОЗОН, озона, мн. нет, муж. (от греч. ozo пахну) (хим.). Газ, особая форма кислорода, содержащая в молекуле три атома (вместо обычных двух атомов), образующаяся в воздухе во время грозы и обладающая сильным окислительным и обеззараживающим… … Толковый словарь Ушакова
Читайте также:

