Переходный металл и металл
Обновлено: 03.05.2024
Периодическая система всегда под руками
В органической химии элементов немного, и можно не сомневаться, что любой человек, осмелившийся назвать себя химиком, помнит, где находится углерод, кислород, азот и галогены, и уж тем более водород. В химии переходных металлов элементов намного больше, и упомнить их все не всем по силам, и человек, даже отдавший химии всю жизнь, имеет полное право замешкаться, вспоминая, где, например, находится какой-нибудь иридий, и элемент ли это вообще, а может быть цветок какой аленький или синенький.
Но здесь это совершенно необходимо – мы все время будем считать электроны, оценивать положение элементов в группах и рядах, и не попадаться на глупые вопросы, например, про катализ кросс-сочетания фосфиновыми комплексами свинца. Фосфиновые комплексы у свинца вполне могут быть, но металл это непереходный, а следовательно нам в этом курсе малоинтересный. Вторая буква в символе просто предательская – перевернем ее и все встанет на свои места.
Поэтому сразу обзаведемся Периодической таблицей элементов. Для наших целей больше подходит не привычная с детства (раннего или позднего, кому как повезло) уютная и компактная короткопериодная таблица, восходящая еще к Д.И.Менделееву, а так называемая длиннопериодная. Историческая короткопериодная таблица была основана на ранжировании элементов по единственно доступному в глубокой древности параметру, атомным весам. Ни о каких электронах, а тем более атомных орбиталях, валентных оболочках и пр. тогда не было известно совершенно ничего. Короткопериодная форма поэтому мешает в группах элементы различных типов, разделяя их только по неочевидным на близорукий взгляд главным и побочным подгруппам. Но самая неудачная особенность исторической формы – запихивание 15 элементов в одну восьмую группу, что делает непростым понимание того, чем все эти восхитительные элементы различаются, и почему только им, благородным газам и металлам, и тройке более банальных металлов досталась такая свалка. Воздадим поэтому должное восхищение величию исторической Таблицы, и перейдем к более современной форме, которая построена по заполнению валентных уровней электронами, и четко разделяет разные блоки элементов.
Маленькое отступление, навеянное посещением Северной Химической Аудитории. Пожалуйста, никогда не называйте Периодическую таблицу Таблицей имени Д.И. Менделеева. Это какое-то филологическое недоразумение, крайне оскорбительное для памяти действительно великого ученого. Можно сколько угодно спорить о том, называть ли таблицу таблицей Менделеева, и какую конкретно таблицу так называть, и можно ли так называть длиннопериодную форму (на мой взгляд, можно, но это неважно), и не нужно ли тогда же поминать Лотара Мейера – все это суета, которую стоит оставить бессмысленным чиновникам от науки и ошивающимся вокруг них проходимцам. Все вменяемые люди знают и помнят, кому история химии обязана этим выдающимся инструментом, и пошло мельтешить вокруг этого не стоит. Ничто никуда не денется и не забудется.
D-Элементы
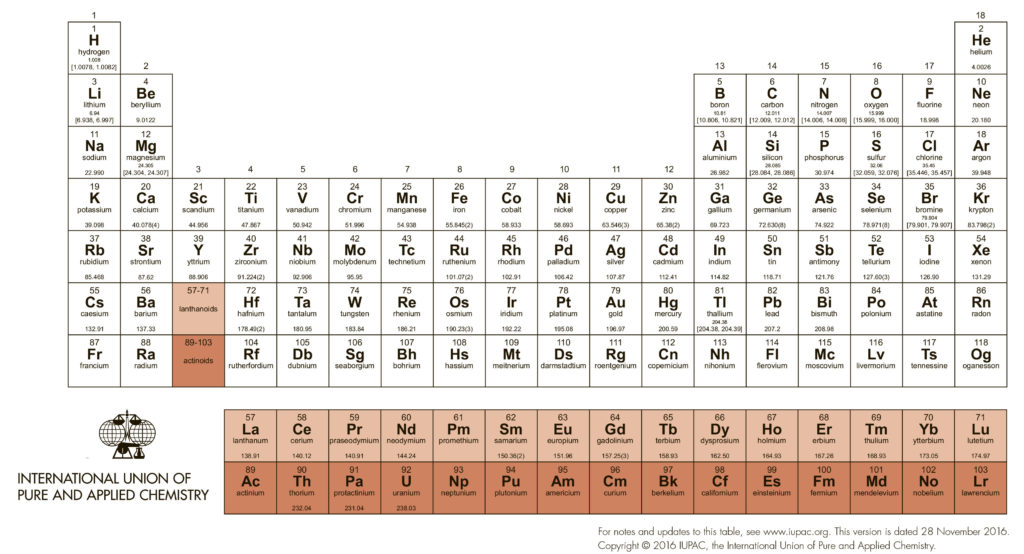
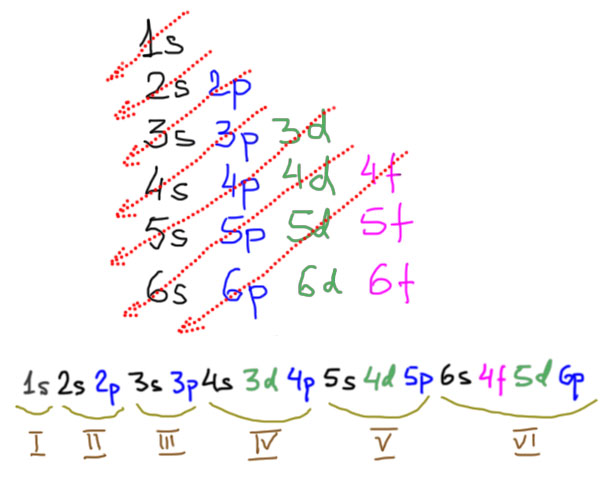
В длиннопериодной Таблице элементы расположены строго по мере заполнения валентных уровней, участвующих в образовании химических связей и вообще в любой химической деятельности. Напомню, что заполнение уровней атомов элементов происходит в соответствии с их относительной энергией снизу вверх (это называется принципом Aufbau, в разных формулировках также называется принципом Маделунга-Клечковского), причем эмпирически (спектроскопически) установлен порядок заполнения, удобно представляемый простой диаграммой: выписываем все уровни в порядке появления, и дальше снимаем слоями по диагонали. Получаем сразу и принцип заполнения оболочек, и то, как происходит комплектование периодов в Таблице. Только в первых трех периодах уровни заполняются просто и скучно – по номеру оболочки (точнее, значению главного квантового числа n). В четвертом и пятом d-уровни из предыдущей оболочки выплывают и встают между очередными s и p-уровнями. Это очень важно, так как в значительной степени определяет место интересующих нас элементов, переходных металлов, в Таблице – они нагло влезают между s- и р-элементами, то есть между самыми металлическими металлами (щелочными и щелочноземельными) и неметаллами вместе с примкнувшими к ним металлоидами и горсткой непереходных металлов. Валентные оболочки в этих двух периодах содержат s, p, d уровни, то есть в сумме могут принять 18 электронов. Как увидим скоро, это священное число химии переходных металлов. В шестом периоде происходит следующий сюрприз – влезает “забытый” f-уровень с на две единицы меньшим номером, причем до d-уровня, и его неспешное заполнение дает семейство f-элементов, лантанидов. А уж дальше идут нормальные d-элементы, но сильно отличающиеся от родственников с верхних этажей как раз наличием этого уже заполненного f-уровня. Можно было бы ожидать, что в этом ряду произойдет и расширение числа электронов на валентной оболочке на 14 f-электронов, но это не так – заполненный f-уровень становится внутренним, и напрямую в образовании связей не участвует, валентная оболочка по-прежнему остается sdp-типа и вмещает 18 электронов, а на особые свойства этих элементов довесок в виде полного f-уровня влияет косвенно, в основном через эффект сильно потяжелевшего и несущего очень большой дополнительный положительный заряд ядра. Про следующий период говорить ничего не будем, там все радиоактивное и малостабильное, кроме самого начала очередной порции f-элементов, но мы договорились, что f-элементами заниматься не будем вообще. Пока не сбылось древнее пророчество о наличии “островка стабильности” среди трансурановых элементов, пополнения семейства переходных металлов чем-то осязаемым ждать не приходится. В 7 периоде ничего не появилось, хотя он полностью заполнен и даже названия все даны. Подождем восьмого.
Электроны на d-уровне
Посмотрим теперь на d-элементы повнимательнее. Есть три полных ряда таких элементов. В каждом последовательно заполняется соответствующий d-уровень. Всего d-орбиталей пять, а d-электронов, соответственно, десять. Поэтому и в каждом ряду есть десять элементов, располагающихся в группах от 3 до 12. Номера групп с 3 по 7 соответствуют исторической Таблице Менделеева, только там используется понятие “побочная подгруппа”, а в длиннопериодной Таблице все группы равноправны (хотя термин main group elements, элементы главных (под)групп, очень широко распространен для обозначения s- и p-элементов и не собирается сдавать позиции). При заполнении оболочек у атома каждого элемента, к сожалению, наблюдаются достаточно серьезные отклонения от простого порядка, когда каждый следующий электрон просто занимал бы следующее свободное место. Электроны вообще очень капризные ребята, их квантовые привычки непросто понять и запомнить. В первом ряду все еще достаточно просто, достаточно усвоить, что при возможности полностью заполнить (в каждой ячейке по два спаренных) или полузаполнить (в каждой ячейке по одному неспаренному) d-уровень, все остальное уходит на второй план, и выбивающуюся из ряда конфигурацию атомов хрома или меди, заимствующих электрон с уже заполненного s-уровня, запомнить несложно. Но во втором или третьем ряду даже эти простые идеи как-то перестают работать однозначно.
К счастью, в реальной химии редко имеют дело с одиночными атомами, а когда образуется коодинационное соединение, комплекс, картина просто радикально упрощается. Считается, что так как в образовании связей с лигандами в первую очередь участвуют именно d-орбитали, то в комплексах они стабилизируются и опускаются ниже s-орбиталей.
А если это объяснение кажется несколько натянутым и неубедительным, то можно просто подумать о том, что в комплексах металлов все равно из валентных орбиталей металла и орбиталей лигандов образуются новые орбитали комплекса, металл все равно отдает на это все, что у него есть, и электроны придется переразмещать заново, снизу вверх, уже на орбиталях комплекса, далеко не все из которых сохранят чистый d-характер как в исходном атоме металла. Поэтому то, что называется d-электронной конфигурацией атома металла в комплексе, на самом деле совершенная формальность, а раз так, то нет смысла это усложнять и лучше воспользоваться самым простым вариантом из возможных – берем все, что есть, и для удобства считаем размещенным на d-орбиталях металла.
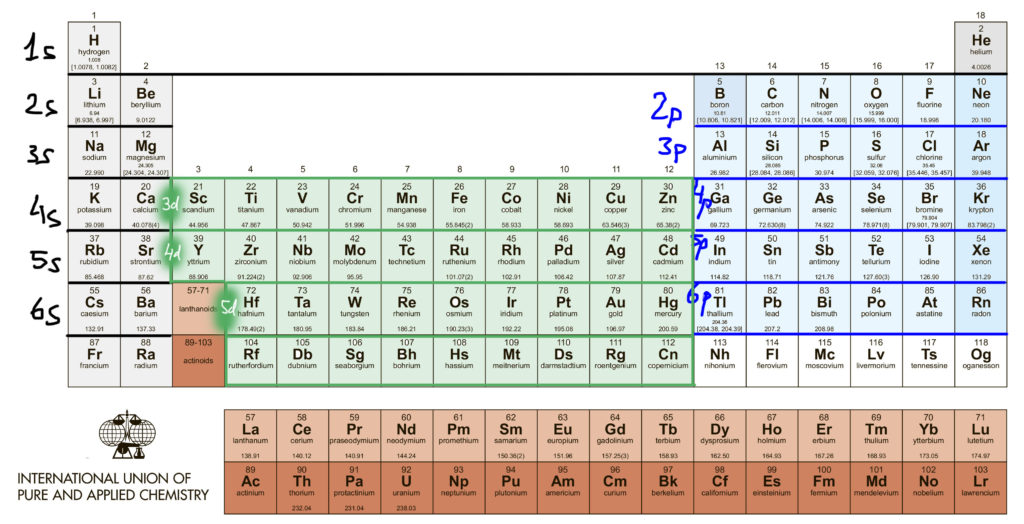
Иными словами, для целей координационной химии электроны на атомах металлов в степени окисления 0 (что это означает, скоро обсудим, а пока примем просто за точку отсчета) размещаются на d-орбиталях, пока уровень не будет заполнен полностью. Это невероятно удобно, потому что число d-электронов становится равным номеру группы в длиннопериодной Таблице. Сколько валентных электронов, скажем, у ниобия? – ниобий в 5 группе, значит пять. А у иридия? – в 9-й группе, значит девять.
Так и будет до 10 группы (никель-палладий-платина), когда d-уровень полностью заполнится, и настанет черед s-уровня, того самого, который в изолированном атоме был ниже d-уровня. Теперь он выше и берет первый следующий электрон в 11 группе (медь-серебро-золото), образуя конфигурацию с полностью заполненным d-уровнем, который поэтому сразу становится внутренним, и полузаполненным s-уровнем. О, так значит металлы этой группы не переходные металлы, а s-элементы, и права была историческая таблица Менделеева, когда помещала их в одну группу с щелочными металлами? Права, но не совсем, и в следующем слайде мы увидим, что претензии металлов группы меди на то, чтобы на полных основаниях примыкать к семье переходных металлов, очень основательны. А вот в 12 группе положение, на первый взгляд, похожее, но на самом деле радикально другое – там второй электрон попадает на s-уровень, а d-уровень окончательно становится внутренним.
Валентные состояния d-элементов. Переходные металлы.
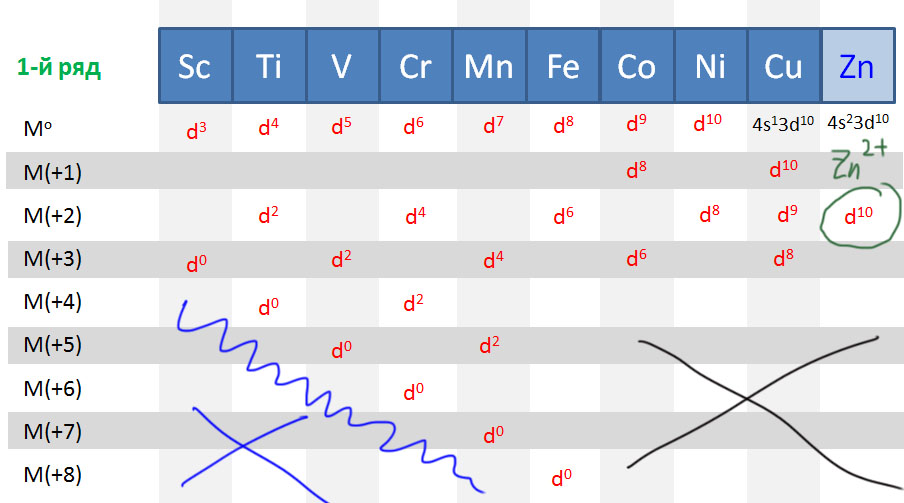
Легко определить и число электронов на атомах металлов в разных степенях окисления. Для металлов характерны положительные степени окисления (есть и отрицательные, но об этом после). Так как положительная степень окисления – это просто недостаток электронов до числа, положенного каждому элементу, берем нульвалентный элемент и вычитаем. Вот что получается для первого ряда (для остальных будет то же самое). Очевидно, что отнять у атома больше, чем у него есть, невозможно. Поэтому максимальная положительная степень окисления не может быть больше номера группы, но не больше восьми. В этом одна из причин деления переходных металлов на ранние и поздние. Ранние – это те, которых можно достаточно легко ободрать до нитки (до d 0 ), а поздние – те, которые этому успешно сопротивляются. Железо – поздний переходный металл, хотя у него есть степень окисления +8, но достичь ее очень трудно и она очень неустойчива. Во втором и третьем ряду металлы легче расстаются с электронами, и степени окисления +8 для рутения и особенно осмия намного проще достигаются (недавняя история с радиоактивным загрязнением изотопом рутения этим и объясняется), но все равно эти элементы классифицируются как поздние переходные металлы. Вообще, группы 7 и 8 иногда обзывают как ни то, ни се (middle transition metals), но это скверная привычка. Чуть позже уточним эту странную классификацию (ранние-поздние), так как она играет значительную роль в химии переходных металлов.
Так что же такое “переходный металл” и одно ли это и то же, что d-элемент. Не совсем. D-элементы – это более формальное понятие, так как число каждого из типов элементов в периоде соответствует предельной емкости оболочки: s-элеметов два, p-элементов шесть, d-элементов десять, ну и все – отсчитываем от скандия десять, приезжаем в цинк, вопрос закрыт. А вот термин “ переходный металл ” имеет более существенное наполнение, хотя оно и менялось с течением времени. Более-менее устоявшийся подход состоит в том, что элемент имеет право так называться, если у него есть валентные состояния, в которых d-оболочка неполна (имеет меньше 10 электронов), в этом случае d-электроны точно участвуют в образовании связей . Если d-оболочка либо всегда пустая, либо всегда полная, участие d-электронов в образовании связей не очевидно и долго являлось предметом споров. Это старая проблема, связанная с так называемыми гипервалентными состояниями p-элементов, которым прописан валентный октет, но которые, начиная с 3 периода, как это следует из общепринятых структурных формул, умеют образовывать больше ковалентных связей, чем этот октет позволяет. Когда структурная химия была еще очень молода, и еще не совсем освоила электронную теорию химической связи, такие состояния (например, сера и другие халькогены в шестивалентном состоянии, или фосфор и его аналоги в пятивалентном состоянии) часто приписывались участию вакантных d-орбиталей, которые таким образом неявно становились валентными. В современной химии так делать не принято, считается анахронизмом, признаком приверженности преданиям далекой старины, а правило октета Льюиса считается в химии непереходных элементов незыблемым, а поэтому такие элементы не имеют право называться d-элементами.
Следовательно, элементы 12 группы (цинк-кадмий-ртуть) не являются переходными металлами, d-оболочка у них всегда заполнена и спрятана очень глубоко – в комплексах этих металлов граничные орбитали всегда сидят только на лигандах, почти никогда не бывает смещения электронной плотности металл-лиганд и других атрибутов электронной структуры комплексов настоящих переходных металлов. Эти металлы очень похожи на обычные непереходные p-элементы, следующие прямо за ними: цинк-галлий, кадмий-индий и особенно ртуть-таллий-свинец.
Или ничего, или всё: ранние и поздние переходные металлы
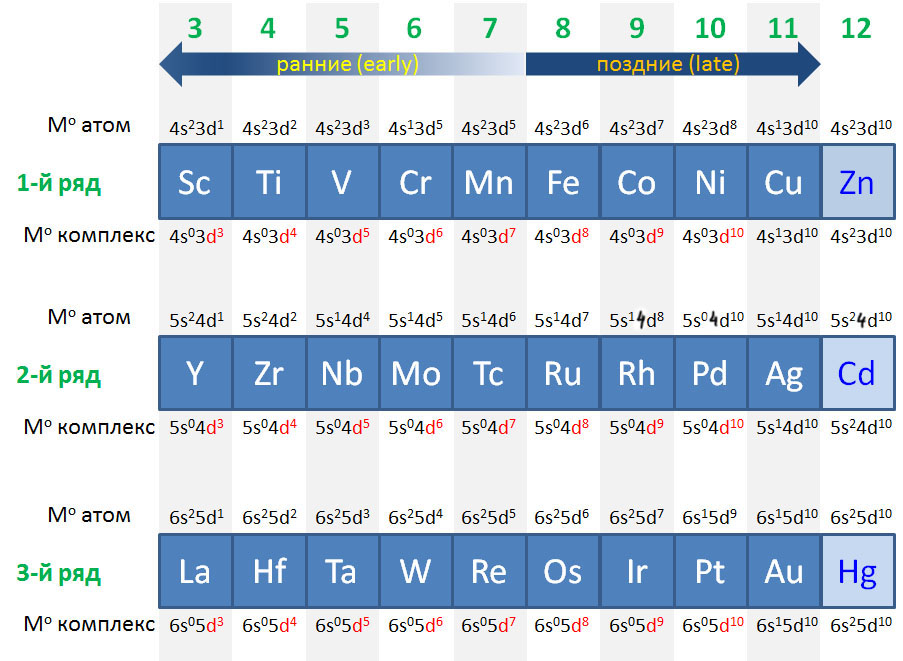
Деление переходных металлов на ранние и поздние очень популярно и часто используется, но точного определения не имеет. Это деление связано с одной очень понятной тенденцией в заполнении валентных оболочек и устойчивости валентных состояний разных элементов. Аналогия довольно прозрачная: где в таблице находятся самые металлические (наиболее электроположительные или наименее электроотрицательные) металлы (щелочные и щелочноземельные)? Слева, в начале периодов. А где находятся самые неметаллические (самые электроотрицательные) неметаллы (галогены и кислород)? Справа, в конце периодов. У первых очень мало электронов, проще их отдать, образуя катионы с зарядом, соответствующим номеру группы. У вторых, наоборот, почти полный комплект, и хочется получить недостающее.
Очень похожая картина наблюдается и в рядах переходных металлов. Те, что ближе к началу, предпочитают отдавать электроны. Их любимые степени окисления соответствуют конфигурациям d 0 и d 2 , то есть высокие степени окисления от +3 и выше, соответствующие номеру группы, что роднит их с непереходными металлами. В реакциях они часто проявляют льюисову кислотность и электрофильность, в состоянии d 0 имеют много общего с непереходными металлами, в частности высокую степень ионности связей с лигандами. Что все это значит, мы подробно разберем дальше, пока просто отметим эти особенности. К ранним переходным металлам почти всегда относят группы с 3-ей по 6-ю, и довольно часто присоединяют и седьмую.
С другой стороны, металлы в конце уже имеют много d-электронов, настолько много, что отдать их все всё равно невозможно. Тогда проще или сохранить имеющееся, или даже приобрести недостающие до полного комплекта. Эти металлы не любят высокие степени окисления, которые редко превышают +4, а наиболее распространенными являются +1 и +2. Самые популярные конфигурации d 8 и d 10 . Им свойственны так называемые низковалентные состояния (степени окисления 0 и +1), и даже небольшие отрицательные степени окисления -1 и -2, а в реакциях они часто проявляют нуклеофильность.
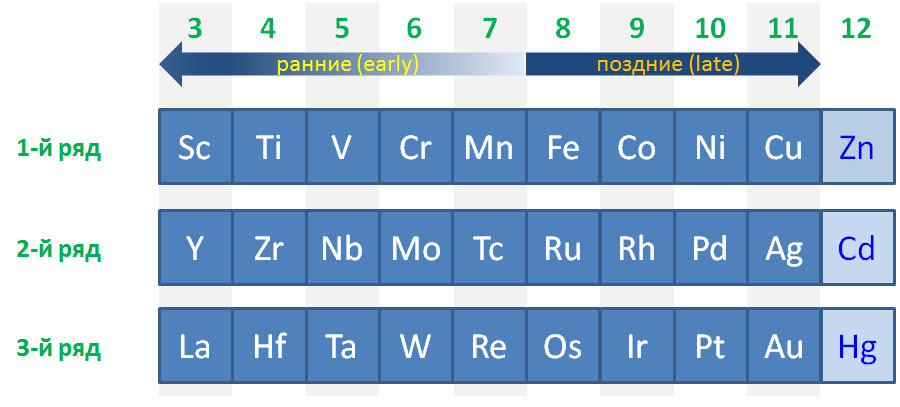
В заключение подчеркнем, что деление переходных металлов на ранние и поздние – просто удобное упрощение, позволяющее грубо классифицировать элементы и в самых общих чертах понимать, какой химии мы ожидаем от представителей групп. Сказать точно, где кончаются первые и начинаются вторые, и наоборот, точно невозможно и не имеет никакого смысла. Собственно как и в химии непереходных элементов, где совершенно нет четкого представления о том, где кончаются неметаллы и начинаются металлы, из-за чего в той химии даже появляется пограничная группа металлоидов, столь же нечеткая. Тем более не имеет смысла выделение в особую группу каких-то средних переходных металлов, хотя этот термин встретить можно, но крайне трудно понять, что же он может означать, и зачем его вводить. Один средневековый христианский мыслитель, брат Вильям Оккамский, советовал в любой мыслительной деятельности не умножать сущностей сверх необходимого, то есть не вводить избыточных и нечетких понятий там, где уже существуют более осмысленные и определенные понятия. Вот и мы не будем, и обойдемся ранними и поздними переходными металлами. К тому же не стоит забывать, что в действительности каждый – каждый! – металл уникален, ни один не повторяет свойства другого хотя бы на 10%, и каждый имеет свою уникальную роль, свои реакции, свое применение, ни один нельзя заменить на другой, а все вместе они создают фантастическое разнообразие молекул и взаимодействий.
Переходный металл и металл
Видео: Тема 1.6 Металлы и неметаллы
Переходные металлы против металлов
Элементы в периодической таблице можно разделить в основном на два; как металлы, так и неметаллы. Среди них большинство составляют металлы, а количество неметаллических элементов в p-блоке меньше.
Металлы
Металлы известны человеку очень давно. Есть свидетельства, подтверждающие использование металла еще в 6000 году до нашей эры. Золото и медь были первыми открытыми металлами. Они использовались для изготовления инструментов, украшений, статуй и т. Д. С тех пор в течение более длительного периода было обнаружено лишь несколько других металлов (17). Теперь мы знакомы с 86 различными типами металлов. Металлы очень важны из-за их уникальных характеристик. Обычно металлы твердые и прочные (есть исключения, например, натрий. Натрий можно разрезать ножом). Ртуть - это металл, находящийся в жидком состоянии. Помимо ртути, все другие металлы находятся в твердом состоянии, и их трудно сломать или изменить форму по сравнению с другими неметаллическими элементами. Металлы имеют блестящий вид. Большинство из них имеют серебристый блеск (кроме золота и меди). Поскольку некоторые металлы очень реактивны с атмосферными газами, такими как кислород, со временем они имеют тенденцию становиться тусклыми. В основном это связано с образованием слоев оксида металла. С другой стороны, такие металлы, как золото и платина, очень стабильны и инертны. Металлы податливы и пластичны, что позволяет использовать их для изготовления определенных инструментов. Металлы - это атомы, которые могут образовывать катионы, удаляя электроны. Итак, они электро-положительные. Тип связи, образованной между атомами металла, называется металлической связью. Металлы высвобождают электроны в своих внешних оболочках, и эти электроны распределяются между катионами металлов. Поэтому они известны как море делокализованных электронов. Электростатические взаимодействия между электронами и катионами называются металлической связью. Электроны могут двигаться; следовательно, металлы обладают способностью проводить электричество. Кроме того, они являются хорошими проводниками тепла. Благодаря металлической связи металлы имеют упорядоченную структуру. Высокие температуры плавления и кипения металлов также являются следствием этой прочной металлической связи. Более того, металлы имеют более высокую плотность, чем вода. Элементы IA и IIA группы - легкие металлы. Они имеют некоторые отличия от описанных выше общих свойств металла.
Переходные металлы
Согласно определению ИЮПАК, переходный металл - это элемент, атом которого имеет неполную d-подоболочку или который может давать катионы с неполной d-подоболочкой ». Обычно мы рассматриваем элементы d-блока в периодической таблице как переходные металлы. Все они имеют характеристики металла, но немного отличаются от металлов в блоке s и p. Причина этих различий в основном связана с d-электронами. Переходные металлы могут иметь различные степени окисления в соединениях. Часто их реакционная способность ниже по сравнению с другими металлами (например, металлами в s-блоке). Переходные металлы обладают способностью образовывать окрашенные соединения за счет d-d электронных переходов. Более того, они могут образовывать парамагнитные соединения. Помимо этих свойств, они обладают общими металлическими свойствами благодаря металлической связи. Они хорошо проводят электричество и тепло, имеют высокие температуры плавления, кипения и плотности и т. Д.
В чем разница между переходными металлами и металлами?
• Переходные металлы относятся к группе металлов.
• Элементы d-блока, как правило, известны как переходные металлы.
• Переходные металлы менее химически активны по сравнению с другими металлами.
• Переходные металлы могут образовывать окрашенные соединения.
• Переходные металлы могут иметь различные степени окисления в составе соединений, но другие металлы могут иметь ограниченное количество степеней окисления (чаще всего одно состояние).
Переходный металл: свойства и список
Элементы в периодической таблице часто делятся на четыре категории: элементы основной группы, переходные металлы, лантаноиды и актиноиды. В основные элементы группы включают активные металлы в двух колонках по крайней левой части таблицы Менделеева и металлов, полуметаллов и неметаллов в шести колонках на крайней правой. Эти переходные металлы являются металлическими элементами, которые выступают в качестве своего рода моста или перехода между частями сторонами периодической таблицы.
Что это такое
Вам будет интересно: Эвентуальный — это какой?
Из всех групп химических элементов переходные металлы могут быть наиболее сложными для идентификации, потому что существуют различные мнения относительно того, что именно туда должно быть включено. Согласно одному из определений, к ним относят любые вещества с частично заполненной d-электронной подоболочкой (обиталью). Это описание относится к группам с 3-й по 12-ю в периодической таблице, хотя элементы f-блока (лантаноиды и актиноиды, расположенные ниже основной части периодической таблицы) также являются переходными металлами.
Их название связано с именем английского химика Чарльза Бери, который использовал его в 1921 году.

Место в периодической таблице
Переходными являются все металлы рядов, расположенных в группах от IB до VIIIB периодической таблицы:
- с 21-го (скандий) по 29-й (медь);
- с 39-го (иттрий) по 47-й (серебро);
- с 57-го (лантан) до 79-го (золото);
- с 89-го (актиний) до 112-й (коперник).
Последняя группа включает лантаноиды и актиноиды(так называемые f-элементы, которые представляют собой их особую группу, все остальные относятся к d-элементам).
Переходные металлы: список
Перечень этих элементов представлен:
- скандием;
- титаном;
- ванадием;
- хромом;
- марганцем;
- железом;
- кобальтом;
- никелем;
- медью;
- цинком;
- иттрием;
- цирконием;
- ниобием;
- молибденом;
- технецием;
- рутением;
- родием;
- палладием;
- серебром;
- кадмием;
- гафнием;
- танталом;
- вольфрамом;
- рением;
- осмием;
- иридием;
- платиной;
- золотом;
- ртутью;
- резерфодием;
- дубнием;
- сиборгием;
- борием;
- хассием;
- мейтнерием;
- дармштадтием;
- рентгением;
- унунбием.

Группа лантаноидов представлена:
- лантаном;
- церием;
- празеодимом;
- неодимом;
- прометием;
- самарием;
- европием;
- гадолинием;
- тербием;
- диспрозием;
- гольмием;
- эрбием;
- тулием;
- иттербием;
- лютецием.
- актинием;
- торием;
- протактинием;
- ураном;
- нептунием;
- плутонием;
- америцием;
- кюрием;
- берклием;
- калифорнием;
- эйнштейнием;
- фермием;
- менделевием;
- нобелием;
- лоуренсием.
Особенности
В процессе образования соединений атомы металлов могут использоваться как валентные s- и p-электроны, так и d-электроны. Поэтому d-элементы в большинстве случаев характеризуются переменной валентностью, в отличие от элементов главных подгрупп. Это свойство обуславливает их способность к образованию комплексных соединений.
Наличие определенных свойств обуславливает название этих элементов. Все переходные металлы ряда являются твердыми с высокими температурами плавления и кипения. При перемещении слева направо по периодической таблице пять d-орбиталей становятся более заполненными. Их электроны слабо связаны, что способствует высокой электропроводности и податливости переходных элементов. Им свойственна также низкая энергия ионизации (она требуется при удалении электрона от свободного атома).

Химические свойства
Переходные металлы проявляют широкий спектр состояний окисления или положительно заряженных форм. В свою очередь, они позволяют переходным элементам образовывать много различных ионных и частично ионных соединений. Образование комплексов приводит к расщеплению d-орбиталей на два энергетических подуровня, что позволяет многим из них поглощать определенные частоты света. Таким образом, образуются характерные окрашенные растворы и соединения. Эти реакции иногда усиливают относительно низкую растворимость некоторых соединений.
Переходные металлы характеризуются высокой электропроводностью и теплопроводностью. Они податливы. Обычно образуют парамагнитные соединения из-за неспаренных d-электронов. Также им свойственна высокая каталитическая активность.
Следует также отметить, что существует некоторая полемика о классификации элементов на границе между основной группой и элементами переходного металла в правой части таблицы. Этими элементами являются цинк (Zn), кадмий (Cd) и ртуть (Hg).

Проблемы систематизации
Разногласия относительно того, следует ли классифицировать их как относящиеся к основной группе или переходные металлы, свидетельствуют о том, что различия между этими категориями не ясны. Между ними есть определенное сходство: они выглядят как металлы, они податливы и пластичны, они проводят тепло и электричество и образуют положительные ионы. Тот факт, что двумя лучшими проводниками электричества являются переходный металл (медь) и элемент, относящийся к основной группе (алюминий), показывает степень, в которой физические свойства элементов двух этих групп перекрываются.

Сравнительная характеристика
Существуют также различия между основными и переходными металлами. Например, последние являются более электроотрицательными, чем представители основной группы. Поэтому они с большей вероятностью образуют ковалентные соединения.
Другое различие между металлами основной группы и переходными металлами можно увидеть в формулах соединений, которые они образуют. Первые имеют тенденцию образовывать соли (такие как NaCl, Mg 3 N 2 и CaS), в которых достаточно только отрицательных ионов, чтобы уравновесить заряд на положительных ионах. Переходные металлы образуют аналогичные соединения, такие как FeCl3, HgI2 или Cd (OH)2. Однако они чаще, чем металлы основной группы, образуют комплексы, такие как FeCl4- , HgI42- и Cd (ОН)42-, имеющие избыточное количество отрицательных ионов.
Еще одно отличие между основной группой и ионами переходных металлов заключается в легкости, с которой они образуют стабильные соединения с нейтральными молекулами, такими как вода или аммиак.
Видео: Переходные металлы. Видеоурок по химии 11 класс
Содержание
Основное отличие - переходные металлы от внутренних переходных металлов
Периодическая таблица элементов состоит из металлов, неметаллов и металлоидов. Химические элементы классифицируются как металлы, если они обладают металлическими свойствами, такими как пластичность, хорошая электропроводность, легко удаляют электроны и т. Д. Переходные металлы и внутренние переходные металлы также являются металлическими элементами, которые классифицируются как таковые, учитывая их электронную конфигурацию. Большинство элементов d-блока рассматриваются как переходные металлы. Элементы блока F рассматриваются как внутренние переходные металлы. Основное различие между переходными металлами и внутренними переходными металлами состоит в том, что Атомы переходного металла имеют свои валентные электроны на самой внешней орбите, тогда как внутренние атомы переходного металла имеют свои валентные электроны на орбитали внутренней предпоследней электронной оболочки.
Ключевые области покрыты
1. Что такое переходные металлы
- Определение, свойства по отношению к электронной конфигурации
2. Что такое металлы внутреннего перехода
- Определение, свойства по отношению к электронной конфигурации
3. В чем разница между переходными металлами и внутренними переходными металлами
- Сравнение основных различий
Ключевые слова: актиниды, D-орбиталь, F-орбиталь, внутренний переходный металл, лантаноиды, переходный металл

Что такое переходные металлы
Переходные металлы - это химические элементы, состоящие из атомов с неспаренными d-электронами; даже стабильные катионы этих элементов имеют неспаренные d-электроны. Большинство элементов d-блока являются переходными металлами. Однако Скандий (Sc) и Цинк (Zn) не рассматриваются как переходные металлы, поскольку у них нет неспаренных d-электронов даже в стабильных катионах, которые они образуют. Скандий формы Sc +3 как единственный стабильный катион, и он не имеет d электронов. Zn образует Zn +2 катион как единственный стабильный катион. У него есть d электронов, но все они спарены.
В периодической таблице элементов все переходные металлы находятся среди элементов d-блока. Эти элементы d-блока расположены между элементами s-блока и элементами p-блока. Элементами блока S являются металлы. Элементы блока P являются неметаллами. Поэтому элементы d-блока показывают переход металлов в неметаллы и называются переходными металлами.
Переходные металлы могут образовывать разные соединения в разных степенях окисления. Все катионы, образованные переходными металлами, являются красочными. Поэтому составы, сделанные этими металлами, также очень красочны. Соединения, образованные одним и тем же элементом переходного металла, встречаются в разных цветах. Это потому, что разные степени окисления одного и того же элемента показывают разные цвета.
Рисунок 1: Цвета различных никелевых комплексов
Переходные металлы могут образовывать сложные соединения. Они называются координационными соединениями. Атом переходного металла центрируется несколькими лигандами, которые отдают свои неподеленные электронные пары центральному атому металлов.
Что такое металлы внутреннего перехода
Внутренние переходные металлы - это химические элементы, которые состоят из валентных электронов на их орбиталях предпоследней электронной оболочки. Элементы F-блока известны как внутренние переходные металлы, так как они состоят из валентных электронов на своих f-орбиталях, и эти f-орбитали окружены другими атомными орбиталями.
Ряды лантаноидов и рядов актинидов являются двумя периодами блока f. Ряд лантаноидов состоит из химических элементов, которые имеют валентные электроны на своей 4f-орбитали. Ряд актинидов состоит из химических элементов, которые имеют свои валентные электроны на 5f-орбитали.

Рисунок 2: блоки в периодической таблице
Внутренние переходные металлы состоят из очень больших атомов, поскольку они имеют большое количество оболочек. Поэтому большинство из них нестабильны и радиоактивны. Почти все актиниды являются радиоактивными элементами, но лантаноиды являются нерадиоактивными за некоторыми исключениями.
Наиболее заметное состояние окисления внутренних переходных металлов +3. Но актиниды могут иметь степень окисления до +6. Внутренние переходные металлы показывают атомные номера в диапазоне от 57 до 103.
Разница между переходными металлами и внутренними переходными металлами
Определение
Переходные металлы: Переходные металлы - это химические элементы, которые состоят из атомов, имеющих неспаренные d-электроны, даже их стабильные катионы имеют неспаренные d-электроны.
Внутренние переходные металлы: Внутренние переходные металлы - это химические элементы, которые имеют валентные электроны на своих орбиталях предпоследней электронной оболочки.
Расположение в периодической таблице
Переходные металлы: Переходные металлы находятся в блоке d периодической таблицы.
Внутренние переходные металлы: Внутренние переходные металлы находятся в блоке f периодической таблицы.
Атомные номера
Переходные металлы: Переходные металлы имеют атомные номера в диапазоне от 21 до 112.
Внутренние переходные металлы: Внутренние переходные металлы имеют атомные номера от 57 до 103.
изобилие
Переходные металлы: Переходные металлы в изобилии на земле.
Внутренние переходные металлы: Внутренние переходные металлы менее распространены на земле.
Наиболее заметное состояние окисления
Переходные металлы: Наиболее заметное состояние окисления переходных металлов составляет +2.
Внутренние переходные металлы: Наиболее заметное состояние окисления внутренних переходных металлов +3.
Заключение
Переходные металлы и внутренние переходные металлы являются химическими элементами, которые имеют более высокий атомный номер и большие атомные размеры. Поэтому большинство из них считаются тяжелыми металлами. Основное различие между переходными металлами и внутренними переходными металлами состоит в том, что атомы переходных металлов имеют свои валентные электроны на самой внешней орбите, тогда как внутренние атомы переходных металлов имеют свои валентные электроны на орбитали внутренней предпоследней электронной оболочки.
Рекомендации:
1. «Элементы перехода». Элементы перехода, внутренние элементы перехода | [электронная почта защищена],
Переходные металлы - характеристика, свойства и строение
В периодической таблице все элементы подразделяются на 4 категории: основная, переходная, лантаноиды и актиноиды. К основным в группе относятся активные металлы в 2 колонках по крайней левой части таблицы Менделеева и металлы, полуметаллы и неметаллы в 6 столбцах крайней правой. Переходные металлы — это металлические элементы, являющиеся своеобразным мостом между сторонами системы. Все они применяются в качестве катализаторов.

Общее понятие
Переходные металлы образуют соединения, в которых проявляют положительные степени окисления. Наиболее заметно различие свойств в IV-VIII подгруппах, где побочные составляют металлы, а главные — неметаллы. Находящиеся в самой таблице символы обозначаются — d, а буквой f — лантаноиды и актиноиды. Самые выраженные из этой категории: Cr, Mn, Fe, Cu, Zn, и Ag. История открытия указывает на то, что все они в свободном состоянии являются металлами. Внешний номер электронной оболочки совпадает с номером периода.

К самым известным на Земле d-металлам относится железо, следующее сразу после алюминия. Большая часть представлена оксидами или сульфидами. В свободном виде встречается лишь медь. Соединения d-металлов также обнаружены на Луне.
Из всех групп химических элементов переходные достаточно трудно идентифицировать из-за разногласий по поводу того, что именно должно быть в них включено. По одной версии переходными считаются вещества с не полностью заполненной d-электронной подоболочкой.
Переходные металлы расположены в группах от IB до VIIIB с:
- 21 (скандия) — по (29 медь).
- 39 (иттрия) — по 47 (серебро).
- 57 (лантана) — до 79 (золота).
- 89 (актиния) — до 112 (коперниция).
Последние представлены лантаноидами и актиноидами — f-элементами, входящими в особую группу. Остальные составляют d-элементы.
В соединениях атомы используются как валентные s- и p, так и d-электроны. Исходя из этого, d-элементы обладают переменной валентностью, что не наблюдается в основных подгруппах. По этой причине они могут образовывать комплексные соединения.
Все переходные металлы по структуре твердые, имеют высокую температуру плавления и кипения.
При перемещении слева направо в таблице у 5 d-орбиталей обнаруживается большая заполняемость. Из-за слабой связи электронов увеличивается электропроводность и гибкость.
Всем им присуща низкая энергия ионизации, необходимая при удалении электрона от свободного атома. До сих пор ученые спорят относительно классификации элементов на границе между основной группой и переходными металлами, размещенными в правой части таблицы. Ими являются цинк (Zn), кадмий (Cd) и ртуть (Hg). Внешне они напоминают металлы:
- Податливы и пластичны.
- Проводят тепло и электричество.
- Образуют положительные ионы.
Схожесть физических свойств элементов двух этих групп проявляется в том, что лучше всего электричество проводят переходный металл медь и относящийся к основной группе алюминий. Особенность — элементы основной группы легко образуют стабильные соединения с нейтральными молекулами воды или аммиака.
Значение переходных элементов
В жизнедеятельности человека они выполняют важную функцию. Без них организм не может существовать:
- Железо — главный источник гемоглобина.
- Цинк — вырабатывает инсулин.
- Кобальт — основной компонент витамина В12.
- Медь, марганец и молибден — входят в состав ферментов.
Яркие представители — чугун и сталь, используемые в тяжелой промышленности.

В черной металлургии их получают из железной руды. Вначале выплавляется чугун, а затем из него — сталь. Углерода в чугуне больше 1,7%, а в стали — меньше этого значения.
Благодаря добавкам — хрому, марганцу и никелю — стали обретают другие качества. Так, хром повышает прочность и устойчивость к действию кислот. Наиболее употребительные сплавы на основе меди: бронза, латунь и мельхиор. Особенно широкое применение нашли: сталь, чугун и бронза. Велика значимость железа, неслучайно по его содержанию сплавы подразделяются на черные и цветные.
Характеристики железа
Этот элемент представляет наибольший интерес, поскольку составляет важные соединения, среди которых железная кислота и соли. Чаще всего не используется как чистое вещество, а в виде сплавов с углеродом и другими элементами. Взаимодействует с:

- Неметаллами — при нагревании, преимущественно в виде порошка.
- Кислородом — образование оксидов.
- Водой — при большой температуре. При повышенной влажности вступает в реакцию с водяными парами и кислородом, что служит возникновению ржавчины.
- Кислотами — с выделением водорода.
- Растворами солей — вытесняет менее активные металлы.
Переходные металлы играют огромную роль в жизни людей.
По этой причине их изучение включено в обязательный курс школьной программы. Наиболее подробно о свойствах рассказывается на уроках химии в старших классах при проведении лабораторных работ.
Читайте также:
