Пирометаллургический метод получения металлов отражает реакция
Обновлено: 19.05.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Начать тест Способы получения металлов
Задание № 1 Реакция возможна между Mg и SnCl 2 (р-р) Ag и K 2 SO 4 ( р - р ) Zn и KCl (р-р)
Задание № 2 Какой из металлов вытесняет железо из сульфата железа (II) Zn Cu Hg
Задание № 3 Какой из металлов вытесняет медь из сульфата меди ( II ) Zn Ag Hg
Задание № 4 Формула вещества, восстанавливающего оксид меди ( II ), - это H 2 CO 2 HNO 3
Задание № 5 Формула вещества, не восстанавливающего оксид железа( III ) HCl Al H 2
Задание № 6 Для осуществления превращений в соответствии со схемой: Al ( OH ) 3 → AlCl 3 → Al необходимо последовательно использовать соляную кислоту и калий хлор и водород хлороводород и цинк
Задание № 7 Пирометаллургический метод получения металлов отражает реакция HgS + O 2 → Hg + SO 2 CuSO 4 + Fe → FeSO 4 + Cu CuSO 4 + Zn → ZnSO 4 + Cu
Задание № 8 Гидрометаллургический метод получения металлов отражает реакция CuSO 4 + Fe → FeSO 4 + Cu AlCl 3 + 3K → Al + 3KCl Эл - из 2NaCl ------→ 2Na + Cl 2
Задание № 9 В качестве восстановителя при выплавке железа в промышленности наиболее часто используют кокс натрий водород
По теме: методические разработки, презентации и конспекты

презентация по теме "Способы получения металлов. Сплавы"
Презентация "Способы получения металлов"
Материал даёт возможность рассмотреть все способы получения металлов.
Урок по теме "Общие способы получения металлов"
Урок в курсе химии 9 класса к учебнику О.С.Габриеляна.

Урок в 9 классе "Общие способы получения металлов"
В помощь учителю материал можно использовать для подготовки отрытого урока.

Диагностика №10 "Способы получения металлов" 11 класс
Диагностика из 4-х заданий, два варианта, базовый уровень.

Урок химии в 11 классе по теме: «Металлы в природе. Общие способы получения металлов»
"Человек не может обойтись без металлов. Если бы не было металлов, люди влачили бы самую жалкую жизнь среди диких зверей. ".

Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт.
Готовься к ЕГЭ в Тик-Ток формате
"Незнайка" и "Решу ЕГЭ" запускают свои курсы подготовки. Короткие видео, много практики и нереальная польза!

Вариант 7
Часть 1.
Электронная конфигурация 1s 2 2s 2 2p 6 отвечает
Кислотные свойства в ряду высших оксидов углерода — кремния — фосфора
3. сначала возрастают, затем ослабевают
4. сначала ослабевают, затем возрастают
Одна из связей образована по донорно-акцепторному механизму в
1. молекуле водорода
2. молекуле пероксида водорода
4. молекуле аммиака
Степень окисления +2, а валентность IV атом углерода имеет в соединении
Ионную кристаллическую решётку имеет
В перечне веществ к гидроксидам относятся вещества:
И медь, и алюминий
1. реагируют с раствором гидроксида натрия
2. взаимодействуют при обычных условиях с азотом
3. растворяются в разбавленной соляной кислоте
4. могут взаимодействовать с кислородом
Оксид хрома (VI) взаимодействует с каждым из двух веществ:
1. оксидом кремния и углекислым газом
2. водой и углекислым газом
3. водой и гидроксидом натрия
4. кислородом и водородом
1. относится к довольно слабым электролитам
2. разлагается при хранении и при нагревании
3. не растворяет металлическую медь
4. получается в промышленности из нитратов
Для получения дигидрофосфата кальция средний фосфат следует обработать
1. серной кислотой
2. угольной кислотой
4. гидроксидом кальция
В схеме превращений
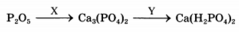
веществами X и Y соответственно являются:
Не является изомером гексена-2
Два моля водорода может присоединить один моль
Метанол проявляет двойственные свойства, реагируя с
1. натрием и калием
2. натрием и бромоводородом
3. бромоводородом и хлороводородом
4. кислородом и фтором
1. сладкие на вкус
2. растворяются в воде
3. являются электролитами
4. твёрдые вещества
Бутан может быть получен при
1. дегидратации бутанола-1
2. взаимодействии 1,2-дихлорбутана с цинком
3. взаимодействии хлорэтана с натрием
4. взаимодействии метана с пропаном
2-Аминопропионовая кислота не реагирует с
3. гидроксидом кальция
4. оксидом бария
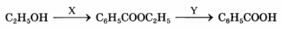
К окислительно-восстановительным реакциям не относится взаимодействие
1. пропана и хлора
2. хлора и водорода
3. метанола и уксусной кислоты
4. кальция и хлоруксусной кислоты
Для увеличения скорости взаимодействия железа с кислородом следует
1. уменьшить давление кислорода
2. измельчить железо
3. взять несколько брусков железа
4. уменьшить температуру
Слабым электролитом является
Верны ли следующие суждения о качественных реакциях на белки?
А. С солями свинца белки дают оранжевое окрашивание.
Б. При действии азотной кислоты на белок появляется жёлтое окрашивание.
1. Верно только А
2. Верно только Б
3. верны оба суждения
4. оба суждения неверны
Пирометаллургический метод получения металлов отражает реакция
3. 2NaCl → (электролиз) 2Na + Cl2
Смешали 200 г 11%-ного раствора нашатыря и 350 г 17%-ного раствора этой же соли. Какова массовая доля нашатыря в полученном растворе?
(Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
выделилось 968 кДж теплоты. Вычислите объём (н.у.) водорода, вступившего в реакцию.
Рассчитайте массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н.у.) хлора.
Ответ: _______ г.
(Запишите число с точностью до целых.)
В заданиях 27–35 к каждому элементу подберите соответствующий элемент и запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между формулой органического соединения и его названием.
Установите соответствие между схемой реакции и формулой окислителя в ней.
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
5) углекислый газ
Установите соответствие между названием соли и средой ее водного раствора.
А) хлорид хрома (III)
Б) сульфат хрома (II)
В) сульфид натрия
Г) сульфат цезия
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
А) N2(г) + 3H2(г) 3(г)
Б) 2H2(г) + O2(г) 2O(г)
В) 2HCl(г) 2(г) + Cl2(г)
Г) SO2Br2(г) 2(г) + Br2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Установите соответствие между исходными веществами и продуктами их взаимодействия.
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
А) пентанол и фенол
Б) пропанол-1 и глицерин
В) муравьиная кислота и уксусная кислота
Г) стеариновая и олеиновая кислоты
2) аммиачный р-р оксида серебра (I)
4) гидроксид меди (II)
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
А) этан и азотная кислота
Б) этан и соляная кислота
5) взаимодействие невозможно
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
А) ацетон и водород
Б) пропен и вода
В) пропаналь и водород
Г) пропионовая кислота и натрий
4) пропановая кислота
5) пропионат натрия
6) пропилат натрия
Часть 2.
Запишите сначала номер задания (36, 37 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
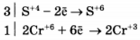
Сера в степени окисления +4 является восстановителем, а хром +6 (или дихромат калия за счет хрома +6) - окислителем.
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем его полное растворение. Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом.
Запишите уравнения описанных реакций.
3) 2HIO3 2O5 + H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
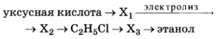
При написании уравнений реакций используйте структурные формулы органических соединений.
2) 2CH3COONa + 2H2O 2H6 ↑ + 2CO2 ↑ + H2 ↑ + 2NaOH
3) C2H5 + Cl2 3—CH2—Cl + HCl
4) CH3—CH2—Cl + KOH (спиртов.) 2C = CH2 ↑ KCl + H2O
5) H2C = CH2 + H2O 3—CH2—OH
Какую массу оксида серы (VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить ее массовую долю вдвое?
Некоторое органическое вещество, взаимодействуя с гидроксидом натрия, образует продукт, содержащий 33,82% металла. Известно, что это вещество может реагировать с этанолом и оксидом магния, а также окрашивает метилоранж в розовый цвет. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с оксидом магния.
2) молекулярная формула CH2O2
3) структурная формула4) уравнение реакции 2HCOOH + MgO → (HCOO)2Mg + H2O
Конспект урока по теме "Щелочные металлы"
Урок химии в 9 классе. «____»________________ 20___ г.
Щелочные металлы.
Цель. Дать общую характеристику металлов главной подгруппы 1 группы.
Образовательные: определить положение ЩМ в ПСХЭ Д.И. Менделеева, определить характерные физические и химические свойства.
Развивающие: развивать умения проводить анализ и синтез учебного материала; активное включение учащихся в самостоятельный поиск знаний.
Воспитательные: формировать научную картину мира.
1. Орг. момент.
2. Повторение изученного материала.
1. Реакция возможна
А) Ag и K2SO4 (р-р) Б) Mg и SnCl2 (р-р) В)Zn и KCl (р-р)
2. Какой из металлов вытесняет железо из сульфата железа (II)
А) Cu Б) Zn В)Hg
3. Какой из металлов вытесняет медь из сульфата меди (II)
А) Ag Б) Zn В)Hg
4. Формула вещества, восстанавливающего оксид меди (II), - это
5. Для осуществления превращений в соответствии со схемой: Al(OH)3 → AlCl3 → Al необходимо последовательно использовать
А) соляную кислоту и калий
Б) хлор и водород
В) хлороводород и цинк
6. Пирометаллургический метод получения металлов отражает реакция
А) CuSO4 + Fe → FeSO4 + Cu
Б) CuSO 4 + Zn → ZnSO 4 + Cu
В) HgS + O 2 → Hg + SO 2
7. Гидрометаллургический метод получения металлов отражает реакция
А) AlCl3 + 3K → Al + 3KCl
Б) CuSO4 + Fe → FeSO4 + Cu
В) 2NaCl → 2Na + Cl 2
8. Формула вещества, не восстанавливающего оксид железа(III)
А) HCl Б)Al В) H2
9. В качестве восстановителя при выплавке железа в промышленности наиболее часто используют
А) кокс Б) натрийВ) водород
3. Изучение новой темы.
Составить опорный конспект по теме.
Данный конспект разделен на три уровня:
Вариант 1 предлагается учащимся, занимающиеся на «3»
Вариант 2 предлагается учащимся, занимающимся на «4»
Вариант 3 предлагается учащимся, занимающимся на «5».
Конспект в общем виде.
1. Щелочные металлы – это элементы __1__ группы,__главной_ подгруппы, к ним относятся _ Li , Na , K , Rb , Cs , Fr __.
2. Заполните таблицу «Характеристика элементов 1 группы, главной подгруппы в ПСХЭ Д.И. Менделеева»
Положение в периодической системе
Состав ядра атома
Строение электронной оболочки
Характерные степени окисления
2 пер., 1 группа, глав
3 пер., 1 группа, глав
1 s 2 2 s 2 2р 6 3 s 1
4 пер., 1 группа, глав
1 s 2 2 s 2 2р 6 3 s 2 3р 6 4 s 1
3. Дайте характеристику калию, на основании его положения в ПСХЭ.
4. Дополните предложения:
1) С увеличением порядкового номера элементов щелочных металлов радиус атомов ___увеличивается_____
2) С увеличением порядкового номера элементов щелочных металлов способность атомов отдавать электроны ______увеличивается _____ .
3) С увеличением порядкового номера элементов щелочных металлов температура плавления ____ уменьшается_______ .
4) С увеличением порядкового номера элементов щелочных металлов плотность ______увеличивается ______ .
5) Для щелочных металлов характерна ____металлическая__химическая связь и __металлическая_______ кристаллическая решетка.
5. Используя схемы на стр.54 составьте уравнения реакций химических свойств на примере натрия.
6. Охарактеризуйте химические свойства щелочных металлов – простых веществ: назовите наиболее активный и самый малоактивный щелочной металлы. Запишите уравнения химических реакций, происходящих между литием и а)кислородом, б) серой, в) хлором, г) водой. Разберите уравнения с окислительно – восстановительной точки зрения.
Дайте характеристику реакции а :
1) по числу и составу исходных веществ и продуктов реакции - ____соединения___;
2) по изменению степеней окисления атомов - _______ОВР_______;
3) по направлению - ________необратимая________________ ;
4) по тепловому эффекту - __________экзотермическая____________ .
4. Закрепление.
1. Впишите знак < , >или = вместо *:
б) число электронных слоев: Li < Rb , Na = Al , Ca = K
в) число электронов на внешнем уровне: Li = Rb , Na < Al , Ca >K
г) радиус атома: Li < Rb , Na >Al , Ca < K
д) восстановительные свойства: Li < Rb , Na >Al , Ca < K
2. Верны ли следующие утверждения о щелочных металлах?
1) При взаимодействии с галогенами щелочные металлы образуют соли.
2) С водой щелочные металлы вступают в реакции замещения .
3) Общим для лития и калия является наличие двух электронов на внешнем
электронном слое в их атомах.
4) Щелочные металлы хранят под слоем керосина.
5) Литий взаимодействует с H 2 O , Fe 2 O 3 , KOH .
6) В ряду калий натрий литий усиливаются металлические свойства.
7) При взаимодействии лития с водой образуется щелочь.
5. Домашнее задание.
Тест. (6 баллов)
Выберите один правильный ответ.
3. Формула вещества, восстанавливающего оксид меди (II), - это
4. Пирометаллургический метод получения металлов отражает реакция
5. Гидрометаллургический метод получения металлов отражает реакция
6. Формула вещества, не восстанавливающего оксид железа(III)
Изучение новой темы.
1. Щелочные металлы – это __________________________________________________, к ним относятся ___________________________________________________. (1 балл)
2. Заполните таблицу «Характеристика элементов 1 группы, главной подгруппы в ПСХЭ Д.И. Менделеева»(12 баллов)
3. Используя схемы на стр.54 составьте уравнения реакций химических свойств на примере калия.(4 балла)
4. (5 баллов) Впишите знак или = вместо *:
а) заряд ядра: Li * Rb , Na * Al , Ca * K
б) число электронных слоев: Li * Rb , Na * Al , Ca * K
в) число электронов на внешнем уровне: Li * Rb , Na * Al , Ca * K
г) радиус атома: Li * Rb , Na * Al , Ca * K
д) восстановительные свойства: Li * Rb , Na * Al , Ca * K
«5» - 22- 28 баллов
«4» -17 - 21 баллов
«3»- 13 - 16 баллов
«Щелочные металлы»
Тест. (9 баллов)
А) соляную кислоту и калий
В) 2NaCl - → 2Na + Cl 2
А) коксБ) натрийВ) водород
1. Щелочные металлы – это __________________________________________________,
к ним относятся ___________________________________________________.(1 балл)
2. Дайте характеристику литию, на основании его положения в ПСХЭ.(2 балла)
3. (5 баллов) Дополните предложения:
1) С увеличением порядкового номера элементов щелочных металлов радиус атомов ______________________
2) С увеличением порядкового номера элементов щелочных металлов способность атомов отдавать электроны ______________________________ .
3) С увеличением порядкового номера элементов щелочных металлов температура плавления ______________________________ .
4) С увеличением порядкового номера элементов щелочных металлов плотность __________________________ .
5) Для щелочных металлов характерна _____________________ химическая связь и _______________________ кристаллическая решетка.
4. (4 балла) Используя схемы на стр.54 составьте уравнения реакций химических свойств на примере натрия.
5. ( 5 баллов) Впишите знак или = вместо *:
6.(4 балла) Верны ли следующие утверждения о щелочных металлах?
1) При взаимодействии с галогенами щелочные металлы образуют соли.
2) С водой щелочные металлы вступают в реакции замещения.
4) Щелочные металлы хранят под слоем керосина.
7) При взаимодействии лития с водой образуется щелочь.
«5» - 26- 30 баллов
«4» - 20- 25 баллов
1. Щелочные металлы – это __________________________________________________, к ним относятся ____________________________________________________________.(1 балл)
2. Дайте характеристику калию, на основании его положения в ПСХЭ. (2 балла)
4. ( 12 баллов) Охарактеризуйте химические свойства щелочных металлов – простых веществ: назовите наиболее активный и самый малоактивный щелочной металлы. Запишите уравнения химических реакций, происходящих между литием и а)кислородом, б) серой, в) хлором, г) водой. Разберите уравнения с окислительно – восстановительной точки зрения.
1) по числу и составу исходных веществ и продуктов реакции - ________________;
2) по изменению степеней окисления атомов - _______________________________;
3) по направлению - ______________________________________________________ ;
4) по тепловому эффекту - _________________________________________________ .
5. (5 баллов) Впишите знак или = вместо *:
6. (4 балла)Верны ли следующие утверждения о щелочных металлах?
Тест по теме "Получение веществ"
тест по химии (11 класс) на тему
Тест содержит вопросы, касающиеся способов получения неорганических веществ.
| Вложение | Размер |
|---|---|
| poluchenie_veshchestv.doc | 33.5 КБ |
Подтяните оценки и знания с репетитором Учи.ру
Предварительный просмотр:
Тест «Получение веществ»
1. Пирометаллургический метод получения металлов отражает реакция: 1) HgS + O 2 → Hg + SO 2 2) CuSO 4 + Fe = FeSO 4 + Cu 3) 2NaCl = 2Na + Cl 2 4) CuSO 4 + Zn = ZnSO 4 + Cu
2. Промышленное получение аммиака основано на реакции, схема которой: 1) Ca(OH) 2 + NH 4 Cl 2) Mg 3 N 2 + H 2 O = 3) H 2 + N 2 =
3. Гидрометаллургический метод получения металлов отражает реакция, схема которой: 1) HgS + O 2 → Hg + SO 2 2) CuSO 4 + Fe = FeSO 4 + Cu
3) 2NaCl = 2Na + Cl 2 4) AlCl 3 + 3K = Al + 3KCl
4. Свободный фтор получают: 1) окислением HF газообразным хлором 2) электролизом раствора KCl 3) электролизом расплава KF 4) электролизом кислородсодержащих солей фтора
5. В лабораторных условиях азот может быть получен нагреванием: 1) нитрита аммония 2) нитрата серебра 3) хлорида аммония 4) фосфата аммония
6. При электролизе раствора Na 2 SO 4 на аноде выделяется: 1) натрий 2) оксид серы (VI) 3) водород 4) кислород
7. В лаборатории хлор получают из: 1) сульфида натрия и соляной кислоты 2) соляной кислоты и перманганата калия 3) перманганата калия и оксида хлора(VII) 4) фтора и хлорида натрия
8. Водород получают взаимодействием: 1) HCl + Mg, Cu + H 2 SO 4 2) Hg + HCl, Al + KOH, 3) MgO + H 3 PO 4 , Ca + H 2 O, 4) Zn + H 2 SO 4 , Zn + NaOH
9. Кислород получают реакцией разложения: 1) HNO 3 2) H 2 CrO 4 3) KNO 3 4) CuSO 4
10. В какой последовательности восстанавливаются данные металлы при электролизе растворов их солей: 1) Au, Fe, Cu, Ag 2) Cu, Ag, Fe, Au 3) Fe, Cu, Ag, Au 5) Au, Ag, Cu, Fe
11. При электролизе хлорида цинка на аноде происходит: 1) восстановление цинка 2) восстановление воды 3) восстановление воды и цинка 4) окисление анионов хлора
12. Для получения аммиака в лабораторных условиях используют оба вещества группы: 1) N 2 и H 2 2) NH 4 Cl (тв) и Ca(OH) 2 (ТВ) 3) NH 4 Cl(р-р) и Ca(OH) 2 (р-р) 4) NH 4 NO 3(р-р) и NaOH (р-р)
13. При электролизе раствора хлорида натрия образуются: 1) Na, Cl 2 2) NaOH, Cl 2 , H 2 3) Na, Cl 2 4) Na, Cl 2 , HCl
14. При электролизе расплава NaOH на аноде выделяется: 1) Na 2) H 2 3) O 2 4) H 2 O
15. В промышленности повышение выхода аммиака обеспечивается: 1) действием высоких температур 2) проведением процесса при низких давлениях 3) использованием активных катализаторов 4) циркуляцией азотно-водородной смеси
16. Сырье для промышленного производства серной кислоты: 1) сернистая кислота 2) олеум 3) сульфат железа(II) 4) сера
17. Алюмотермия используется для: 1) алкилирования аренов 2) получения металлов из их оксидов 3) нагревания алюминия 4) получения водорода из алюминия
18. При нагревании какого вещества можно получить кислород: 1) CuO 2) CaCO 3 3) KMnO 4 4) KOH
19. Промышленное производство азотной кислоты основано на процессах, которые отражает схема: 1) NH 3 → N 2 → NO → NO 2 → HNO 3 2) N 2 → NO → NO 2 → N 2 O 5 → HNO 3 3) NH 3 → NO → NO 2 → HNO 3 4) N 2 → N 2 O → NO → NO 2 → HNO 3
20. Сплавлением соды, известняка и кремнезема получают: 1) цемент 2) стекло 3) фарфор 4) керамику
21. Метод «кипящего» слоя не используется при: 1) производстве серной кислоты 2) каталитическом крекинге нефтепродуктов 3) синтезе метанола 4) обжиге пирита
22. Колонна синтеза – это промышленный аппарат, который используется для: 1) производства чугуна 2) производства серной кислоты 3) очистки газов от примесей 4) перегонки нефти
23. В производстве серной кислоты контактным способом оксид серы(IV) осушают, пропуская через: 1) серную кислоту 2) оксид кальция 3) гидроксид натрия 4) азотную кислоту
24. Промышленным способом получения хлора является: 1) электролиз раствора хлорида натрия 2) окисление соляной кислоты перманганатом калия 3) термическое разложение хлороводорода 4) окисление соляной кислоты бертолетовой солью
25. Среди перечисленных веществ укажите те, которые можно получить из аммиака в одну стадию: 1) HNO 3 2) NH 4 Cl 3) NO 4) N 2 5) N 2 O 5
26. Среди перечисленных веществ укажите те, которые можно получить из сероводорода в одну стадию: 1) S 2) Na 2 SO 3 3) NaHS 4) SO 2 5) CuS
27. Среди перечисленных веществ укажите те, которые можно получить из нитрата аммония в одну стадию: 1) HN 3 2) NH 4 Cl 3 ) N 2 O 4) NO 5) KNO 3
28. Продуктами разложения нитрата аммония являются: 1) NO 2) H 2 O 3) NO 2 4) N 2 5) N 2 O
29. Продуктами разложения азотной кислоты являются: 1) O 2 2) H 2 O 3) NO 2 4) NН 3 5) N 2 O 5
30. Продуктами разложения нитрата свинца являются: 1) Pb 2) PbO 3) Pb(NO 3 ) 2 4) NO 2 5) O 2

Тест "Классификация неорганических веществ" ЕГЭ 3.1. РЕЖИМ ОБУЧАЮЩИЙ 11 класс

Тест "Кислородсодержащие органические вещества"
Мини-тест расчитан на промежуточный конторль знаний учащихся, изучающих химию на базовом уровне в ОУ НПО.
Тест Азотсодержащие органические вещества
Тест состоит из заданий типа А и В, как в материалах ЕГЭ. В тесте представлены 1 и 2 вариант.

Тест агрегатное состояние веществ
Тест агрегатное состояние веществ. 2 варианта.
тест по состояниям вещества 8 класс
Тест включает в себя вопросы по кристализации, строению вещества, плавлению.

Дистанционная форма обучения. Тест №2 "Обмен веществ и энергии"
Тест для проверки усвоения материала по теме : "Обмен веществ и энергии".
Тест предназначен для проверки знаний учащихся при изучении химии базового уровня. Он включает вопросу по следующим темам: "Спирты", "Фенолы", "Альдегиды", Карбоновые кислоты", "Сложные эфиры".
Пирометаллургия — определение и способы получения металлов
Современная металлургия обладает большим количеством способов получения чистого металла. Одним из них является пирометаллургия. Она включает целую совокупность технологических процессов, которые протекают при высоких температурах. С его помощью получают различные металлы: чёрные (сталь, чугун) и цветные (медь, никель, титан и многие другие).

Описание
Основу технологического процесса пирометаллургии составляет плавка, которая протекает при достаточно высоких температурах. Необходимая величина температуры зависит от степени плавления элемента, который необходимо получить. Они делят на три большие категории:
- легкоплавкие (с температурой плавления до 600 °С);
- среднеплавкие (не более 1600 °С, к ним относятся: никель сурьма, кальций);
- тугоплавкие (их температура плавления превышает 1600 °С).
Сырьём в пирометаллургии служит: руда, содержащая необходимый металл, концентраты, различные добавки. При обработке первичного сырья получают два компонента: металл и шлак. В некоторых процессах получают так называемый штейн и шлак. Получение необходимой температуры обеспечивается за счёт применения естественного топлива (угля, газа, продуктов нефтепереработки), температуры химических реакций, электрического нагрева.

В черной пирометаллургии характерным примером получения стали служит доменная плавка. С её помощью получают сталь различных марок.
В цветной металлургии каждый металл обладает своими специфическими особенностями. Поэтому для получения используют свои специфические приёмы, которые подходят только для конкретного элемента. Например, для получения меди или никеля предварительно производят плавку на штейн. Потом из него получают черновой материал.
Современная пирометаллургия обладает большим количеством разнообразных конструкций плавильных печей. Они бывают вертикальные и горизонтальные, периодические и непрерывные, с различным способом нагрева, со специфическими процессами (ликвация, электроннолучевая плавка, зонная и другие)
Большую популярность такие процессы получили для получения многих тугоплавких металлов: молибдена, титана, ванадия.

На завершающем этапе пирометаллургии выделяют чистый материал различными приёмами. Получения алюминия осуществляется проведением электролиза. В качестве сырья применяется глинозём. Процесс протекает при температуре,более 1000 °С. Чистый элемент собирают на угольном катоде. Для этой технологической операции существует специальная ванна. Приведенный пример показывает, что у цветных металлов проведение электролиза необходимо для выделения чистой фракции.
Пирометаллургические методы
Основными методами (способам) такого извлечения металлов является восстановление. К ним относятся:
- металлотермия;
- силикатотермия;
- восстановление различными элементами или химическими соединениями.
Любой пирометаллургический метод предполагает высокотемпературное протекание процесса. Первый из перечисленных пирометаллургических способов предполагает ускорение реакции восстановления за счёт свойств более активных металлов. Например, алюминия, магния, натрия.

Второй метод пирометаллургии – это восстановление необходимого элемента с помощью кремния. Остальные способы реализовываются за счёт применения различных химических элементов (например, водорода,углерода) или соединениями (например, гидритами различных металлов, монооксидом углерода).
Применение углерода и его монооксида в пирометаллургии считается целесообразным, когда отсутствуют высокие требования к чистоте получаемого материала и не допускаются высокие затраты на проведение реакции.
Обычно углеродом восстанавливают следующие элементы:
- железо из двух его соединений с кислородом: оксид железа (III) и четырёхмерного оксида железа (магнетита);
- олова из касситерита;
- меди из куприта.

Методы с применением углерода объединяются одним термином – карбометрия. Кроме перечисленных технологий к современной пирометаллургии относят так называемую хлорную металлургию. Она обеспечивает выделение материала при хлорировании сырья с добавлением, так называемого восстановителя. На завершающем этапе производят переработку полученных хлоридов. Этот метод обладает определёнными преимуществами перед классической пирометаллургией. К ним относятся: практически полное извлечение необходимого содержимого, более высокая скорость реакции.
Читайте также:
