Плотность металлов и неметаллов
Обновлено: 21.09.2024
Плотность – это скалярная физическая величина, которая определяется как отношение массы тела к занимаемому им объему.
Данную величину обычно обозначают греческой буквой r или латинскими D и d. Единицей измерения плотности в системе СИ принято считать кг/м 3 , а в СГС – г/см 3 .
Плотность можно вычислить по формуле:
Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Как рассчитать плотность вещества
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO2) = 2 × 22 = 44 г/моль.
Примеры решения задач
| Задание | Вычислите объем воды и массу поваренной соли NaCl, которые потребуются для приготовления 250 мл 0,7 М раствора. Плотность раствора принять равной 1 г/см . Какова массовая доля хлорида натрия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,7 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 250 мл этого раствора: |
n(NaCl) = 250 × 0,7 / 1000 = 0,175 моль.
Найдем массу 0,175 моль хлорида натрия:
M(NaCl) = Ar(Na) + Ar(Cl) = 23 + 35,5 = 58,5 г/моль.
m(NaCl) = n(NaCl) × M(NaCl);
m(NaCl) = 0,175 × 58,5 = 10,2375 г.
Вычислим массу воды, необходимую для получения 250 мл 0,7 М раствора поваренной соли:
msolution = V ×r = 250 × 1 = 250 г.
m(H2O) = 250 – 10,2375 = 239,7625 г.
| Задание | Вычислите объем воды и массу нитрата калия KNO3, которые потребуются для приготовления 150 мл 0,5 М раствора. Плотность раствора принять равной 1 г/см . Какова массовая доля нитрата калия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,5 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 150 мл этого раствора: |
n(KNO3) = 150 × 0,5 / 1000 = 0,075 моль.
Найдем массу 0,075 моль нитрата калия:
M(KNO3) = Ar(K) + Ar(N) + 3×Ar(O) = 39 + 14 + 3×16 = 53 + 48 = 154 г/моль.
m(KNO3) = 0,075 ×154 = 11,55 г.
Вычислим массу воды, необходимую для получения 150 мл 0,5 М раствора нитрата калия:
Плотность металлов
Металлы – химические элементы, расположенные в левой и нижней части Периодической системы Д.И. Менделеева.
Особое строение кристаллических решеток металлов придает им ряд общих свойств.
К одним из наиболее важных физических свойств металлов относятся плотность, твердость и температура плавления. Эти свойства у металлов весьма различны.
Например, наименьшую плотность имеют щелочные металлы, а наибольшую – осмий. Металлы, плотность которых меньше пяти, условно принято называть легкими металлами, а металлы с плотностью больше пяти – тяжелыми.
По твердости металлы сравнивают с алмазом, твердость которого принята за 10. Самыми мягкими являются щелочные металлы, а самым твердым – хром.
Все металлы обладают металлическим блеском. Это свойство объясняется тем, что металлы хорошо отражают от своей поверхности световые лучи. Металлы отражают также радиоволны, что используется в радиотелескопах, улавливающих радиоизлучения искусственных спутников Земли, и в радиолокаторах, обнаруживающих самолеты на больших расстояниях.
Металлы – хорошие проводники электричества и теплоты. Это зависит от наличия в металлических решетках свободных электронов, которые в электрическом поле перемещаются от отрицательного к положительному полюсу. Электрическая проводимость и теплопроводность металлов неодинакова. Она увеличивается от ртути к серебру.
Из наиболее доступных металлов хорошей электрической проводимостью обладают медь и алюминий, поэтому они используются в качестве проводников электрического тока.
Многие металлы пластичны и обладают хорошей ковкостью, что также объясняется особенностью металлической связи. Так как ионы в металлической решетке друг с другом непосредственно не связаны, отдельные слои их могут свободно перемещаться один относительно другого. Самые хрупкие металлы находятся в V, VI и VII группах Периодической системы Д.И. Менделеева.
Распространенность металлов в природе
Самым распространенным металлом в земной коре является алюминий. За ним следуют железо, кальций, натрий, калий, магний и титан. Содержание остальных металлов незначительно. Так, например, хрома в земной коре всего лишь 0,3, никеля – 0,2, а меди – 0,01%.
Металлы встречаются в природе как в свободном, так и в виде различных соединений.
Краткая характеристика химических свойств и плотность металлов
Наиболее общими химическими свойствами металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы.
Наиболее энергично металлы реагируют с кислородом и серой, электроотрицательность которых велика:
В этих реакциях окислителем является соответствующий неметалл.
Металлы могут окисляться также ионами водорода и ионами других металлов. Например, в ходе реакций взаимодействия металлов с водой, с кислотами и растворами солей:
Zn + 2HCl = Zn + H2;
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [26,4 / 44]×12 = 7,2г;
m(H) = 2×16,2 / 18 ×1= 1,8 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z = 7,2/12 :1,8/1 : 4,8/16;
x:y:z = 0,6 : 1,8 : 0,3 = 2 : 6 : 1.
Значит простейшая формула соединения C2H6O, а его молярная масса равна 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O)= 2×12 + 1×6 + 16 = 24 + 6 + 16 = 46 г / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 23 = 46 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит молекулярная формула вещества будет иметь вид C2H6O.
| Задание | Массовая доля фосфора в одном из его оксидов равна 56,4%. Плотность паров оксида по воздуху равна 7,59. Установите молекулярную формулу оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
ω (O) = 100% – ω (P) = 100% – 56,4% = 43,6%.
Обозначим число атомов фосфора в молекуле через «х», число атомов кислорода через «у».
Найдем соответствующие относительные атомные массы элементов азота и водорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = ω(P)/Ar(P) : ω (O)/Ar(O);
x:y = 56,4/31 : 43,6/16;
x:y = 1,82 : 2,725 = 1 : 1,5 = 2 : 3.
Значит простейшая формула соединения фосфора и кислорода имеет вид P2O3.
Значение молярной массы газа можно определить при помощи его плотности по воздуху:
Mgas = 29 × 7,59 = 220 г/моль.
Чтобы найти истинную формулу соединения фосфора и кислорода найдем отношение полученных молярных масс:
M(P2O3) = 2 ×Ar(P) + 3 × Ar(O) = 2 ×31 + 3 × 16 = 62 + 48 = 110г/моль.
Значит индексы атомов фосфора и кислорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид P4O6.
Плотность, температура плавления и кипения простых веществ

В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
Указаны плотность и температуры плавления и кипения следующих простых веществ: азот N2, актиний Ac, алюминий Al, америций Am, аргон Ar, астат At, барий Ba, бериллий Be, бор B, бром Br, ванадий V, висмут Bi, водород H2, вольфрам W, гадолиний Gd, галлий Ga, гафний Hf, гелий He, германий Ge, гольмий Ho, диспрозий Dy, европий Eu, железо Fe, золото Au, индий In, йод (иод) J, иридий Ir, иттербий Yb, иттрий Y, кадмий Cd, калий K, кальций Ca, кислород O2, озон O3, кобальт Co, кремний Si, криптон Kr, ксенон Xe, кюрий Cm, лантан La, литий Li, лютеций Lu, магний Mg, марганец Mn, медь Cu, молибден Mo, мышьяк As, натрий Na, неодим Nd, неон Ne, нептуний Np, никель Ni, ниобий Nb, олово Sn, осмий Os, палладий Pd, платина Pt, плутоний Pu, полоний Po, празеодим Pr, прометий Pm, протактиний Pa, радий Ra, радон Rn, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, самарий Sm, свинец Pb, селен Se, сера S, серебро Ag, скандий Sc, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, тербий Tb, технеций Tc, титан Ti, торий Th, тулий Tu, углерод C (алмаз, графит), уран U, фосфор P (белый, красный), франций Fr, фтор F, хлор Cl, хром Cr, цезий Cs, церий Ce, цинк Zn, цирконий Zr, эрбий Er.
Следует отметить, что плотность веществ в таблице выражена в размерности кг/м 3 со множителем 10 3 . В таблице можно выделить вещества (химические элементы) с минимальной и максимальной плотностью. Наименьшей плотностью из химических элементов обладают газы — например, плотность водорода равна всего 0,089 кг/м 3 — это самый легкий газ на планете. Из тяжелых элементов высокой плотностью отличаются вольфрам — его плотность 19,3·10 3 кг/м 3 , уран, нептуний, осмий и другие металлы.
Цифры в скобках означают, что вещество при данной температуре разлагается. Сокращения: г. — газ, ж. — жидкость, тв. — твердое вещество, возг. — возгоняется, ромб. — ромбическая структура.
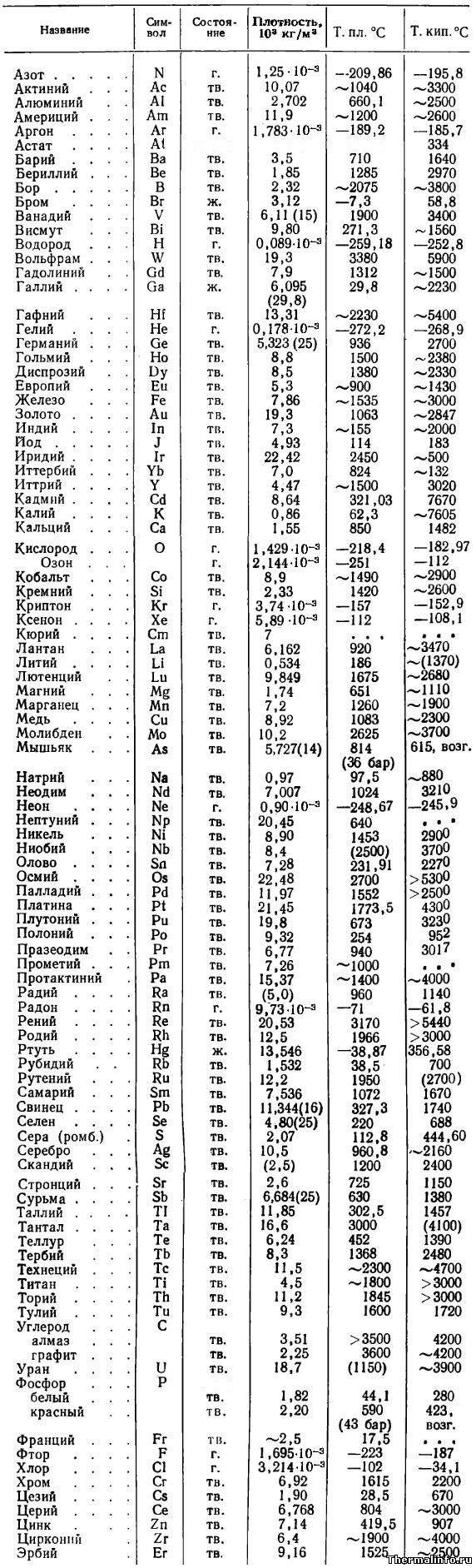
По данным таблицы можно выделить вещества, обладающие минимальной и максимальной температурой плавления и кипения. Самую низкую температуру плавления имеет химический элемент гелий — его температура плавления равна минус 272,2 °С. Гелий также обладает и самой низкой температурой кипения.
Самую высокую температуру плавления среди простых веществ имеет такой химический элемент, как углерод в виде графита. Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Самую высокую температуру кипения имеет элемент кадмий, он кипит при температуре не ниже 7670°С, хотя начинает плавиться всего лишь при 321°С.
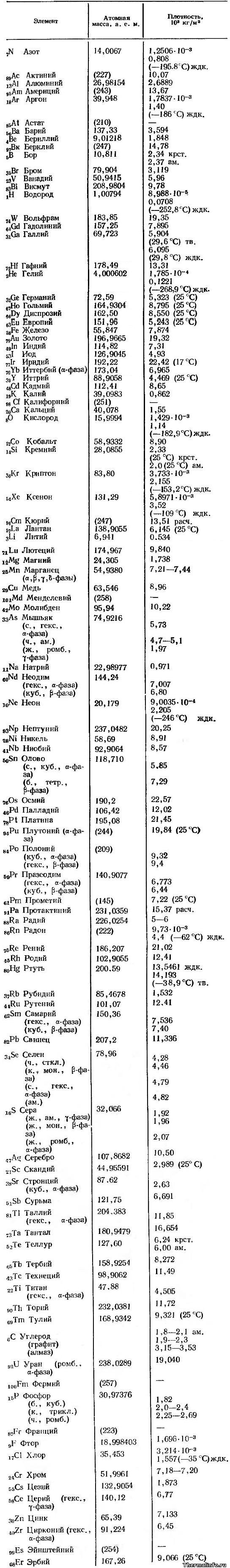
Атомная масса и плотность простых веществ
В таблице приведена атомная масса и плотность следующих химических элементов: азот ,актиний, алюминий, америций, аргон, астат, барий, бериллий, берклий, бор, бром, ванадий, висмут, водород, вольфрам, гадолиний, галлий, гафний, гелий, германий, гольмий, диспрозий, европий, железо, золото, индий, йод, иридий, иттербий, иттрий, кадмий, калий, калифорний, кальций, кислород, кобальт, кремний, криптон, ксенон, кюрий, лантан, литий, лютеций, магний, марганец, медь, менделевий, молибден, мышьяк, натрий, неодим, неон, нептуний, никель, ниобий, олово, осмий, палладий, платина, плутоний, полоний, празеодим, прометий, протактиний, радий, радон, рений, родий, ртуть, рубидий, рутений, самарий, свинец, селен, сера, серебро, скандий, стронций, сурьма, таллий, тантал, теллур, тербий, технеций, титан, торий, тулий, углерод (графит, алмаз), уран, фермий, фосфор, франций, фтор, хлор, хром, цезий, церий, цинк, цирконий, эйнштейний, эрбий.
Указанные значения плотности соответствуют плотности веществ при температуре 20°С и атмосферном давлении, за исключением тех случаев, когда в скобках указана другая температура.
Плотность элементов дана в размерности тонна на кубометр. Например, плотность жидкого азота при температуре -195,8°С равна 0,808 т/м 3 или 808 кг/м 3 ; плотность хлора в газообразном состоянии равна 3,214 кг/м 3 , жидкого — 1557 кг/м 3 . Значения плотности веществ приведены для их естественного молекулярного и агрегатного состояний при указанной температуре.
Источники:
1. Писаренко В.В. Справочник лаборанта-химика. Справ. пособие для проф.-техн. учебн. заведений. М., «Высшая школа», 1970. — 192 стр. с илл.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов)
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов).
Плотность — скалярная физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму.
Для обозначения плотности обычно используется греческая буква ρ.
ρ = m / V , где m – масса тела, V – его объём.
Плотность измеряется в г/см 3 или кг/м 3 .
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов) (1 часть):
8,99·10 -5 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – газ),
0,07 г/см 3 (при -252 °C и иных стандартных условиях, состояние вещества – жидкость),
1,785·10 -4 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – газ),
0,125 г/см 3 (при температуре кипения -268,928 °C и иных стандартных условиях, состояние вещества – жидкость),
0,512 г/см 3 (при температуре плавления 180,50 °C и иных стандартных условиях, состояние вещества – жидкость),
0,507 г/см 3 (при 200 °C и иных стандартных условиях, состояние вещества – жидкость),
0,49 г/см 3 (при 400 °C и иных стандартных условиях, состояние вещества – жидкость),
0,474 г/см 3 (при 600 °C и иных стандартных условиях, состояние вещества – жидкость),
0,457 г/см 3 (при 800 °C и иных стандартных условиях, состояние вещества – жидкость),
2,46 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) — α-R-бор,
2,35 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) — β-R-бор,
2,36 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) — β-Т-бор,
2,52 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) — γ-бор,
2,267 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – графит,
0,808 г/см 3 (при -196 °C/-195,8 °C и иных стандартных условиях, состояние вещества – жидкость),
0,00142897 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – газ),
1,141 г/см³ (при -183 °C и иных стандартных условиях, состояние вещества – жидкость),
1,505 г/см 3 (при температуре кипения -188,11 °C и иных стандартных условиях, состояние вещества – жидкость),
1,587 г/см³ (при -218 °C и иных стандартных условиях, состояние вещества – жидкость),
1,81 г/см 3 (при -225 °C и иных стандартных условиях, состояние вещества – твердое тело),
1,7 г/см 3 (при -228 °C и иных стандартных условиях, состояние вещества – твердое тело),
0,00090035 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – газ),
1,204 г/см 3 (при температуре кипения -246 °C и иных стандартных условиях, состояние вещества – жидкость),
0,968 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело),
0,956 г/см 3 (при 77 °C и иных стандартных условиях, состояние вещества – твердое тело),
0,927 г/см 3 (при температуре плавления 97,794 °C и иных стандартных условиях, состояние вещества – жидкость),
0,926 г/см 3 (при 100 °C и иных стандартных условиях, состояние вещества – жидкость),
0,921 г/см 3 (при 127 °C и иных стандартных условиях, состояние вещества – жидкость),
0,897 г/см 3 (при 227 °C и иных стандартных условиях, состояние вещества – жидкость),
0,826 г/см 3 (при 527 °C и иных стандартных условиях, состояние вещества – жидкость),
0,778 г/см 3 (при 727 °C и иных стандартных условиях, состояние вещества – жидкость),
1,584 г/см 3 (при температуре плавления 650 °C и иных стандартных условиях, состояние вещества – жидкость),
2,375 г/см 3 (при температуре плавления 660,32 °C и иных стандартных условиях, состояние вещества – жидкость),
2,57 г/см 3 (при температуре плавления 1414 °C и иных стандартных условиях, состояние вещества – жидкость) – кристаллический кремний,
≈2,2-2,34г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – красный фосфор,
2,36 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – фиолетовый фосфор,
2,07 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – ромбическая сера (α-сера),
2,209 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – ромбоэдрическая сера,
1,5625 г/см 3 (при температуре кипения -34,04 °C и иных стандартных условиях, состояние вещества – жидкость),
1,6552 г/см 3 (при -70 °C и иных стандартных условиях, состояние вещества – жидкость),
1,3954 г/см 3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость),
6,98 г/см 3 (при температуре плавления 1538 °C и иных стандартных условиях, состояние вещества – жидкость),
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость),
7,881 г/см 3 (при 1227 °C и иных стандартных условиях, состояние вещества – жидкость),
7,799 г/см 3 (при 1327 °C и иных стандартных условиях, состояние вещества – жидкость),
7,471 г/см 3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость),
7,307 г/см 3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость),
7,225 г/см 3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость),
6,57 г/см 3 (при температуре плавления 419,53 °C и иных стандартных условиях, состояние вещества – жидкость),
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов) (2 часть):
6,095 г/см 3 (при температуре плавления 29,7646 °C / 29,8 °C и иных стандартных условиях, состояние вещества – жидкость),
6,08 г/см 3 (при 52,9 °C и иных стандартных условиях, состояние вещества – жидкость),
6,041 г/см 3 (при 102 °C и иных стандартных условиях, состояние вещества – жидкость),
6,005 г/см 3 (при 149 °C и иных стандартных условиях, состояние вещества – жидкость),
5,972 г/см 3 (при 200 °C и иных стандартных условиях, состояние вещества – жидкость),
5,905 г/см 3 (при 301 °C и иных стандартных условиях, состояние вещества – жидкость),
5,84 г/см 3 (при 402 °C и иных стандартных условиях, состояние вещества – жидкость),
5,779 г/см 3 (при 500 °C и иных стандартных условиях, состояние вещества – жидкость),
5,72 г/см 3 (при 600 °C и иных стандартных условиях, состояние вещества – жидкость),
5,604 г/см 3 (при 800 °C и иных стандартных условиях, состояние вещества — жидкость),
5,492 г/см 3 (при 1010 °C и иных стандартных условиях, состояние вещества – жидкость),
4,9 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – чёрный мышьяк,
3,1193 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – жидкость),
3,102 г/см 3 (при 25 °C и иных стандартных условиях, состояние вещества – жидкость),
1,475 г/см 3 (при 39 °C и иных стандартных условиях, состояние вещества – твердое тело),
5,769 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – α-олово (серое олово),
1,887 г/см 3 (при температуре плавления 28,5°C и иных стандартных условиях, состояние вещества – твердое тело),
1,843 г/см 3 (при температуре плавления 28,5 °C и иных стандартных условиях, состояние вещества – жидкость),
1,78 г/см 3 (при 127 °C и иных стандартных условиях, состояние вещества – жидкость),
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов) (3 часть):
| 61 | Прометий | Pm | 7,26 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 62* | Самарий * | Sm | 7,52 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
13,5954 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – жидкость),
13,534 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – жидкость),
10,05 г/см 3 (при температуре плавления 271,5 °C и иных стандартных условиях, состояние вещества – жидкость),
Таблица плотности химических элементов (газов, жидкостей, твердых веществ, металлов и неметаллов, веществ и материалов) (4 часть):
| 91 | Протактиний | Pa | 15,37 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 92* | Уран * | U | 19,1 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
19,36 г/см 3 (при 313 °C и иных стандартных условиях, состояние вещества – твердое тело) – β-нептуний,
Читайте также:
