Почему большинство металлов плотные
Обновлено: 04.10.2024
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду - Ag, Cu, Al, Fe уменьшается. При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло) ; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Все металлы являются восстановителями. Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево. Например, Натрий и кальций вытесняют водород из воды уже при обычных условиях:
Ca + 2H2O Ca(OH)2 + H2¬ ; 2Na + 2H2O 2NaOH + H20
А магний при повышении температуры:
Mg + H2O –t MgO + H2
Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе окисляется, а золото нет; медь вытесняет серебро из его соли) :
Cu + 2AgNO3 → 2Ag ↓ + Cu(NO3)2
Cu0 -2 ē → Cu+2 1 О. О. В.
Ag+ + ē → Ag0 2 В. В. О.
Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородосодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4).
Свойства оксидов металлов слева направо по периоду и снизу вверх по группе изменяются от основных к амфотерным для металлов главных подгрупп (Na2O и MgO – основные оксиды, Al2O3 и BeO – амфотерные) . Для металлов побочных подгрупп свойства оксидов, в которых металлы проявляют свою высшую степень окисления, изменяются от основных через амфотерные к кислотным ( CuO - основной, ZnO - амфотерный, CrO3 - кислотный) .
Сила оснований, образуемых металлами главных подгрупп увеличивается справа налево по периоду и сверху вниз по группе ( Be(OH)2 и Al(OH)3– амфотерные гидроксиды, Mg(OH)2 - слабое основание, NaOHи – Ca(OH)2 сильные основания) . Гидраты оксидов металлов побочных подгрупп с высшими степенями окисления металла вдоль периода слева направо меняют свои свойства от оснований через амфотерные гидроксиды к кислотам ( Cu(OH)2 - основание, Zn(OH)2 - амфотерный гидроксид, H2CrO4 - кислота) .
В природе металлы встречаются в основном в виде соединений – оксидов или солей. Исключение составляют такие малоактивные металлы, как серебро, золото, платина, которые встречаются в самородном состоянии.
Все способы получения металлов основаны на процессах их восстановления из природных соединений.
Физические свойства
Для металлов наиболее характерны следующие свойства: металлический блеск, твердость, пластичность, ковкость и хорошая проводимость тепла и электричества.
Для всех металлов характерна металлическая кристаллическая решетка: в ее узлах находятся положительно заряженные ионы, а между ними свободно перемещаются электроны. Наличие последних объясняет высокую электропроводность и теплопроводность, а также способность поддаваться механической обработке.
Теплопроводность и электропроводность уменьшается в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Все металлы делятся на две большие группы:
Черные металлы
Имеют темно-серый цвет, большую плотность, высокую температуру плавления и относительно высокую твердость.
Типичным представителем черных металлов является железо.
Цветные металлы
Имеют характерную окраску: красную, желтую, белую; обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления.
Типичным представителем цветных металлов является медь.
В зависимости от своей плотности металлы делятся на:
Легкие (плотность не более 5 г/см )
К легким металлам относятся: литий, натрий, калий, магний, кальций, цезий, алюминий, барий.
Самый легкий металл — литий 1л, плотность 0.534 г/см3.
Тяжелые (плотность больше 5 г/см3).
К тяжелым металлам относятся: цинк, медь, железо, олово, свинец, серебро, золото, ртуть и др.
Самый тяжелый металл — осмий, плотность 22,5 г/см3.
Металлы различаются по своей твердости:
— мягкие: режутся даже ножом (натрий, калий, индий );
— твердые: металлы сравниваются по твердости с алмазом, твердость которого равна 10. Хром — самый твердый металл, режет стекло.
В зависимости от температуры плавления металлы условно делятся на:
1. Легкоплавкие (температура плавления до 1539°С) .
К легкоплавким металлам относятся: ртуть — температура плавления —38,9°С; галлий — температура плавления 29,78°С; цезий — температура плавления 28,5°С; и другие металлы.
2. Тугоплавкие (температура плавления выше 1539 С) .
К тугоплавким металлам относятся: хром — температура плавления 1890°С; молибден — температура плавления 2620°С; ванадий — температура плавления 1900°С; тантал — температура плавления 3015°С; и многие другие металлы.
Самый тугоплавкий металл вольфрам — температура плавления 3420°С.
Общие свойства металлов
Цель урока: сформировать понятие о металлах как группе элементов, вещества которых проявляют общие свойства, обусловленные сходством строения.
1) закрепить знания о положении металлов в периодической системе, характерных особенностях строения атомов больших и малых периодов;
2) познакомить с металлической связью, типами кристаллических решеток металлов и на основании этого выяснить причину особых физических свойств металлов;
3) познакомить со способностью металлов образовывать сплавы, рассмотреть свойства отдельных сплавов и их отличия от чистых металлов.
Развивающие: развить умения делать выводы о свойствах на основе строения, а также развитие способности анализировать и сравнивать.
Воспитательные: вызвать интерес у учащихся к огромной роли металлов в жизни человека и в развитии народного хозяйства.
Оборудование: образцы различных металлов и изделия из них.
- коллекция “металлы и сплавы”.
- компьютер, проектор, экран.
Основные понятия: окислитель, восстановитель, элемент, простое вещество, степень окисления, период, ряд, группа, подгруппа, типы химической связи, металлическая связь, кристаллические решетки металлов.
1. Организационный момент.
Сегодня на уроке ребята мы с вами начнем изучение нового материала, а именно рассмотрим положение металлов в периодической системе, рассмотрим особенности строения их атомов и кристаллических решеток, а также поговорим о физических свойствах металлов и рассмотрим понятие сплавы.
2. Краткая вступительная беседа о практической важности металлов в жизни человека. Огромное значение металлов в нашей жизни. Георг Агрикола (ученый 16 века) писал: Человек не может обойтись без металлов….если бы не металлы человек влачил бы самую омерзительную и жалкую жизнь среди диких зверей. Ломоносов также посвятил металлам вдохновенные строки: металлы подают укрепление и красоту важнейшим вещам, в обществе потребным. Ими защищаемся от нападения неприятеля, ими утверждаются корабли и силою их связаны. Металлы служат нам в уловлении земных и морских животных для пропитания нашего… и кратко сказать ни едино художество, ни едино ремесло простое употребление металлов миновать не может. Давайте же познакомимся с ними поближе и взглянем на периодическую систему Менделеева.
І. Положение металлов в периодической системе Менделеева.
На экране таблица размещения неметаллов в периодической системе химических элементов .
Получается, что металлов в периодической системе больше, чем неметаллов. С чем же это связано спросите вы у меня, и я отвечу, что это связано с особенностями строения атомов металлов.
У атомов металлов на внешнем энергетическом уровне обычно находится от 1 до 3-4 электронов. С 4-го периода начинается заполнение предвнешнего d – подуровня, начиная со скандия (Sc), при этом на внешнем уровне остается 2 электрона, реже 1, если наблюдается провал электрона .
Значит, делаем вывод, что свойства металлов у этих элементов присутствуют. Такая же закономерность наблюдается и у атомов 6 периода. Таким образом, все элементы побочной подгруппы это металлы, причем четный ряд в больших периодах – металлы, а нечетный ряд – неметаллы.
Особенностью строения атомов металлов является небольшое число электронов на внешнем энергетическом уровне (от одного до трех). Следовательно, атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны, т.е. являются сильными восстановителями, они проявляют только положительные степени окисления от +1 до +3. Давайте посмотрим, как изменяются свойства металлов в периодах и группах. Итак, в группе сверху вниз R атома увеличивается, следовательно, способность притягивать электроны меньше, а металлические свойства усиливаются. В периоде R атома уменьшается, следовательно, способность притягивать к себе электроны выше и металлические свойства ослабевают. Таким образом, наибольшие металлические свойства выражены у щелочных металлов, у которых радиус наибольший. Как вы думаете, почему у неметаллов больше различия в свойствах, чем у металлов?
ІІ. Нахождение металлов в природе.
На экране таблица. Металлы содержатся в ядре Земли и в земной коре, в воде рек, озер, океанов, в организмах животных и растений. Самым распространенным металлом в земной коре является AI, за ним следует Fe, Ca, Na, K, Mg, Ti. Содержимое остальных металлов незначительно. Так, например, в земной коре хрома Cr всего лишь 0,3%; Ni – 0,2%, Cu – 0,01%. Металлы встречаются как в свободном виде, как и в виде соединений. В свободном виде существуют химически малоактивные металлы (Cu, Ag, Au, Pt). Это так называемые самородные металлы, которые встречаются в виде отдельных кусков, зерен, вкраплений в горные породы. Но в основном металлы встречаются в виде солей (NaCI, Na NO3, CaCO3), а металлы средней активности в виде оксидов и сульфидов .
ІІІ. Металлы – простые вещества. Металлическая связь. Кристаллическое строение атомов.
Металлов в природе больше оттого, что у них у всех одинаковое строение кристаллической решетки и один тип химической связи. Это и придает им ряд общих свойств. Это отличает металлы от неметаллов, которым присуще больше различие свойств, чем их общность. В виде простого вещества атомы металлов связаны между собой, так называемой металлической связью. У металлов, особенно щелочных, валентные электроны связаны с атомами слабо и при отрыве затрачивается сравнительно немного энергии. При этом возникают ионы, имеющие устойчивый электронный слой из 8 электронов. Поэтому металлы как в твердом, таки в жидком состоянии существуют в виде ионов, между которыми в хаотичном движении находятся электроны, получившие условное название электронного газа. Ионы при столкновении с электронами на некоторое время превращаются в атомы. Таким образом, твердый металл представляет собой каркас из положительных ионов, атомов, погруженных в море подвижных электронов .
Металлическая связь – это химическая связь, образующаяся в результате электростатического притяжения между ионами и обобществленными электронами, принадлежащим не отдельным атомам, а всему кристаллу в целом.
А теперь давайте вспомним, какие виды химической связи вам уже известны. В чем суть ковалентной и ионной связи, рисуем электронные формулы молекул хлора и хлороводорода. Подведем итоги: что общего и в чем отличие металлической связи от ковалентной?
Сходство: валентные электроны находятся во взаимном пользовании атомов.
Различие: металлическая связь не является локализованной, электроны связывают не пару атомов, а принадлежат одновременно всем атомам данного металлического тела. На экране схема по различным типам связи (на дискете).
- Кубическая объемно-центрированная решетка. Атомы металла находятся в вершинах и центре куба. Каждый атом окружен восьмью атомами. Такую решетку имеют: Na, K, Li, Ba, Cr, Mo, W, V .
- Кубическая гранецентрированная. Атомы металла расположены по вершинам и граням куба: Ca, Cu, Sr, Ag, Fe, Co, Al, Au, Pt, Sb, Ni, Pb .
- Гексагональная (шестиугольная) плотно упакованная решетка. Она встречается у Zn, Mg, Be, Ti, Cd .
В зависимости от типа решетки атомы занимают в ней больше или меньше места. Например, в кубической объемно-центрированной решетки атомы занимают 68% пространства, а в кубической гранецентрированной 74 %. На экране схемы кристаллических решеток. Некоторые металлы Fe, Sn могут существовать в разных кристаллических решетках в зависимости от условий (явлений полиморфизма).
ІV. Физические свойства металлов.
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
1. Агрегатное состояние. Все металлы твердые вещества, за исключением ртути и франция. А как вы думаете, почему так? Если не могут ответить сразу, на вопрос можно предложить ответить дома, используя дополнительную литературу.
В ртути присутствует некоторое количество молекул Hg с ковалентными связями, между собой они связаны слабыми вандерваальсовыми силами.
2. Металлический блеск. Электроны, заполняющие межатомное пространство, отражают лучи видимого спектра. Это вызывает непрозрачность и блеск металла. Как вы думаете, у какого элемента эта способность наибольшая и где она применяется?
В наибольшей степени эта способность проявляется у серебра и индия, поэтому эти металлы нашли применение при изготовлении зеркал. Металлы имеют блеск только в компактной форме, а в мелкораздробленном виде все металлы, кроме Mg u Al, черного или серого цвета. У немногих неметаллов (Si, I, Se, Te) также имеется некоторый блеск, напоминающий металлический, что связано с наличием некоторого количества электронов.
3. Цвет. Большинство металлов, почти полностью отражая лучи видимого спектра, приобретают серебристо – белый (Ni, Al) или серебристо – серый оттенки (Fe, Pb). Как вы думаете, почему золото желтое, а медь красная? Медь, золото, висмут, поглощают больше зеленые и голубые лучи светового спектра, а потому приобретают соответственно розово – красный, желтый и розовый цвет.
4. Тепло и электропроводность. Случай: пошли всем классом в поход и взяли с собой алюминиевую посуду, чтоб не разбилась, налили в нее чай и решили посидеть у костра, а удержать ее голыми руками не удается. Почему? Быстро нагрелась, как объяснить? Для металлов характерна большая теплопроводность. Свободные электроны, находящиеся в постоянном движении, все время сталкиваются с колеблющимися ионами, обмениваются с ними энергией. Следствием чего является быстрое выравнивание температуры по всей массе тела.
Электропроводность объясняется присутствием в металлах свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного к положительному полюсу. Электрическая проводимость и теплопроводность неодинакова: Как вы думаете, у какого из известных вам металлов электропроводность самая высокая? В ряду Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag она увеличивается.
Электропроводность зависит от температуры: с повышением температуры она понижается. Это объясняется тем, что при повышении температуры колебательное движение ионов, атомов усиливается, и это мешает направленному движению электронов. При температуре абсолютного нуля сопротивление металлов исчезает. Это явление называется сверхпроводимостью. У некоторых неметаллов, относящихся к полупроводникам, электропроводимость с повышением температуры увеличивается, т.к. увеличивается количество свободных электронов вследствие разрыва ковалентных связей. Например, при нагревании бора от комнатной температуры до 800° С его эл. проводимость увеличивается в 2 млн. раз. При снижении температуры, нарушенные ковалентные связи восстанавливаются и, следовательно, количество свободных электронов уменьшается. При низких температурах неметаллы не проводят электрического тока, т.к. у них отсутствуют свободные электроны. В этом коренное отличие между физическими свойствами металлов и неметаллов.
5. Пластичность и ковкость.
Пластичность – это способность тела легко изменять форму под действием внешних сил и сохранять полученную форму, кода эти силы перестают действовать. Пластичность сводится к сдвигу атомно-ионных слоев в решетке металлов относительно друг друга. Поскольку слои связаны между собой электронным газом, то при сдвиге связь не рвется и кристалл не разрушается. Ребята, как вы думаете, какой наиболее пластичный металл?
Наибольшей пластичностью обладает золото. Из него можно раскатать фольгу толщиной 0,001 мм, что в 500 раз тоньше человеческого волоса.
Ковкость – это способность не рассыпаться при ударе. Чем же объясняется ковкость многих металлов (щелочные, золото, медь). И почему некоторые металлы (сурьма, висмут) очень хрупкие? Самые хрупкие металлы находятся в V, VІ, VІІ гр. периодической системы. У атомов этих элементов от 5 до 7 свободных электронов (кроме наружных валентных электронов в электронный газ поступают электроны предвнешнего слоя). Такое большое число электронов сильнее связывает отдельные слои ионов и препятствует их свободному скольжению, пластичность металлов уменьшается.
6. Несмотря на одинаковый вид связи, различные металлы обладают характерными для каждого из них свойствами: температурой плавления, плотностью, твердостью. Эти свойства обусловлены строением атомов, зарядностью, размерами ион-атомов в кристаллической решетке, а также плотностью их упаковки. Давайте вспомним, как изменяется атомная масса и радиус в таблице?
Плотность металлов определяется атомной массой и размерами атома (радиус). Чем больше атомная масса и меньше радиус, тем плотнее металл. Поскольку атомная масса возрастает в периодической системе сверху вниз, а радиусы атомов уменьшаются при движении по ряду в больших периодах, наиболее плотными должны быть металлы побочных подгрупп І и VІІ гр. Действительно к наиболее тяжелым относятся золото, платина, осмий, а к наиболее легким – литий, калий, натрий. Можно сравнить щелочной металл Na и металл побочной группы хром. Металлы имеют один и тот же тип кристаллической решетки (кубическая объемно-центрированная), в наружном слое находится по 1 электрону, но натрий и хром имеют различные атомные массы, радиус, и заряды ионов. В отличие от натрия у хрома в образовании металлической связи, принимают участие еще 5 d - электронов предвнешнего уровня. В связи с этим свойства, указанных металлов резко различны. Na – мягок, легкоплавок, плотность его невелика, Cr – тверд, плотен, имеет высокую температуру плавления. Наименьшую плотность имеют щелочные металлы, например, р лития 0,53 г/см 3 , а наиболее плотными являются металлы VІІІ гр. Плотность осмия 22,6 г/см 3 . Металлы, плотность которых меньше пяти, называются легкими, а больше пяти – тяжелыми .
Металлы обладают различной твердостью. По степени твердости металлы сравнивают с алмазом, твердость которого принята за 10. Наиболее твердым является хром, а наиболее мягкими – щелочные металлы (легко режутся ножом) .
Сильно отличаются металлы и по температуре плавления. Самый легкоплавкий металл – ртуть (температура плавления – 38,8°С, самый тугоплавкий – вольфрам (3380°С). Металлы, плавящиеся при температуре выше 1000°С, называются тугоплавкими, ниже – легкоплавкими .
Чем же объясняется большое различие в плотности, твердости и температуре плавления? Установлено, что чем выше концентрация свободных электронов, тем ярче выражены перечисленные свойства.
В промышленности сложилось разделение металлов на черные и цветные. К черным относятся железо и его сплавы. К цветным: Cu, Zn, Pb, Sn. Особую группу цветных металлов составляют благородные металлы: серебро, золото, рутений, платина, палладий. Эти металлы не окисляются на воздухе даже при повышенной температуре и не разрушаются при действии многих химических веществ. Таким образом, мы рассмотрели основные физические свойства металлов.
С самых древних времен человечество имеет дело не с чистыми металлами, а с их сплавами, обладающими часто такими свойствами, которые не имеют образующие их металлы. Как вы думаете почему? Например, Fe, Al, сравнительно мягкие, а их сплавы с металлами обладают достаточной твердостью. Получение сплавов основано на способности расплавленных металлов растворяться друг в друге, при этом почти всегда они свободно перемешиваются и образуют жидкие системы. При охлаждении расплавленные смеси затвердевают, образуются металлические сплавы с нужными свойствами: легкоплавкие, жаростойкие, кислотостойкие. Сплавы различают по составу и строению. Характер взаимодействия в сплаве зависит от их положения в периодической системе. Составные части могут образовывать либо твердый раствор, либо механическую смесь, либо химическое соединение. Твердые растворы: образуются между металлами одной группы или металлами, радиусы атомов которых мало различаются по размерам (Au-Ag, Ag-Cu, Cu-Ni, Fe-Mn). Чем дальше отстоят элементы друг от друга в таблице, тем меньше их взаимная растворимость, в этом случае образуется механические смеси. Такие смеси неоднородны. Расплавленные металлы при смешивании взаимодействуют друг с другом, образуя химические соединения, называемые интерметаллическими. Эти соединения не прочны, и в них не соблюдается стехиометрическое соотношение компонентов (CaAl5, AlCu3).
Таким образом, способность металлов в расплавленном состоянии не только механически смешиваться, но и образовывать между собой различные соединения – одна из причин, объясняющая, почему сплавы по физическим свойствам так резко отличаются от свойств, составляющих их металлов. Так, например, сплав, состоящий из одной части свинца и двух частей олова, плавится при температуре 180°С, тогда как свинец плавится при 328°С, а олово при 231°С. У бронзы прочность выше, чем у составляющих ее меди и олова. Сталь и чугун прочнее чистого железа. Помимо большой прочности многие сплавы обладают большой коррозийной стойкостью и твердостью. Также компонентами сплавов могут быть и неметаллы. Например, в состав чугуна входят C, Si, P, S. Помимо понятия сплав вы должны отличать понятие сталь. Различают два вида стали: углеродистая (Fe+ C, S, P, Si) и легированная (Fe, C+ Cr, Ni, W, Mo). Минус углеродистой в том, что она подвергается коррозии, поэтому стали получать легированную, нержавеющую и устойчивую к действию кислот.
Латунь – сплав меди и цинка. Мельхиор – сплав, содержащий около 80% меди и 20% никеля. Дюралюминий – сплав на основе алюминия, содержащей медь, магний, марганец и никель.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Может ли металл быть газом?

Да, металлы могут быть газами, в зависимости от того, насколько высока их температура кипения. Но действительно ли газообразные металлы считаются металлами?
Закройте на мгновение глаза и позвольте слову "металл" всплыть в вашей голове. А теперь ответьте: какой первый образ приходит вам на ум, когда вы думаете о "металле"?
Большинство из вас увидят твердый, блестящий твердый предмет - может быть, блестящий меч, гладкую машину или чистую посуду?
Слово "металл" ассоциируется у нас с твердыми объектами, потому что большинство металлов вокруг нас - это твердые тела. Но ограничиваются ли металлы только твердым телом? Могут ли они быть газом?
Да, конечно! Хотя металлы обычно находятся в твердом состоянии при комнатной температуре (вероятно, поэтому мы ассоциируем слово "металл" с твердыми объектами), металлы также могут быть газами.
Дело в том, что состояния вещества универсальны: металл может быть твердым, жидким или газообразным. Но это состояние определяется на основе правильных условий температуры и давления.
Например, металл, скажем, свинец, имеет температуру кипения 1740 градусов по Цельсию. Теперь вы знаете, что свинец в своем «естественном состоянии» представляет собой твердое вещество. Но когда вы начнете его нагревать, он сначала превратится в жидкость при 327 градусах Цельсия, а если вы продолжите подавать больше тепла, он превратится в газ при 1740 градусах Цельсия.

Свинец превращается в пар при 1740 градусах Цельсия.
Другой отличный пример - ртуть. Фактически, это металл с самой низкой температурой кипения (356,7 °C), что означает, что из всех металлов он превращается в газ при относительно более низкой температуре.
Но учтите, что пары ртути очень вредны. По данным Всемирной организации здравоохранения, "вдыхание паров ртути может оказывать вредное воздействие на нервную, пищеварительную и иммунную системы, легкие и почки и может быть фатальным. Неорганические соли ртути разъедают кожу, глаза и желудочно-кишечный тракт, а при попадании внутрь могут вызывать токсическое воздействие на почки".

Ртуть весьма примечательна - это металл, который существует в жидком виде при комнатной температуре, а затем закипает при небольшой температуре.
А теперь давайте обсудим еще один аспект этой саги о превращении металла в газ.
Остается ли металл металлом, когда он превращается в газ?
Мы установили, что металлы могут превращаться в газы, если их нагреть до точки кипения. Но если металл нагревается до точки кипения и становится газом, остается ли он металлом? Другими словами, может ли металл находиться в газообразном состоянии и при этом оставаться металлом?
Газообразные металлы не сохраняют свойств своих твердых аналогов, включая металлические связи, металлическую проводимость, пластичность, блеск или другие металлические свойства. Вот почему металлы больше не считаются металлами, когда они переходят в газообразное состояние - это просто газ с определенными характерными свойствами "родительского" элемента. (тогда чем же они считаются? - В ЭТОЙ ТОЧКЕ ОНИ ЯВЛЯЮТСЯ ПРОСТО ГАЗОМ. РТУТЬ ЯВЛЯЕТСЯ МЕТАЛЛОМ, НО КОГДА ОНА КИПИТСЯ, ЕЕ ПАР НАЗЫВАЕТСЯ РТУТНЫМ ГАЗОМ/ПАРАМИ)
Но почему металлы твердые? Что в них такого особенного, что делает их твердыми?
Почему металлы вообще твердые?
Металлы твердые при комнатной температуре из-за того, как их последовательные атомы упаковываются внутри.
Видите ли, вся материя состоит из атомов. Состояние вещества зависит от того, насколько близко или далеко друг от друга находятся эти атомы.
Если составляющие атомы вещества находятся далеко друг от друга, то это вещество будет существовать в виде газа при комнатной температуре. Атомы в жидком состоянии относительно ближе друг к другу, но в твердых телах атомы упакованы вместе в плотные кристаллы.
Из-за сильных сил, которые удерживают эти атомы близко друг к другу, твердые тела жесткие и имеют определенную форму и размер (в отличие от жидкости и газа).
Металлы твердые при комнатной температуре, потому что входящие в их состав атомы металлов упаковываются близко друг к другу, придавая им жесткий или "затвердевший" внешний вид. Это также является причиной того, что металлы имеют высокую температуру плавления и не существуют в жидком состоянии при комнатной температуре.
В целом, металлы могут превращаться в газ, но как только они превращаются в газ, они не сохраняют своих металлических свойств.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
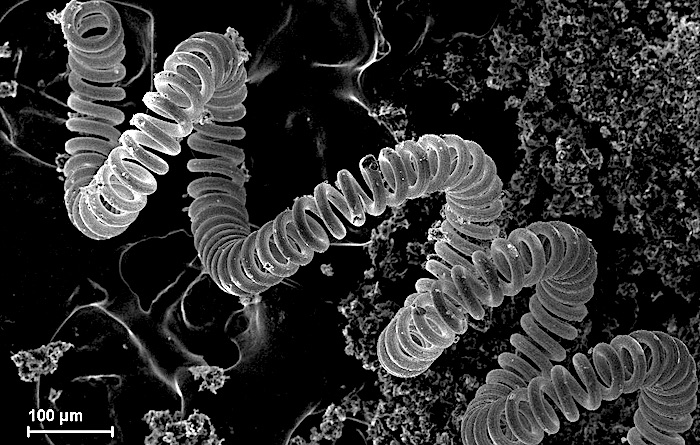
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
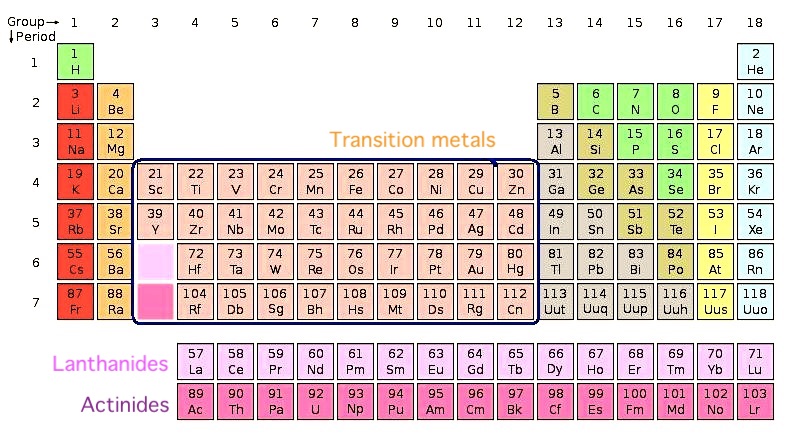
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Читайте также:
