Почему кислота разъедает металл
Обновлено: 17.05.2024
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Что такое ржавчина и как с ней бороться: оксиды железа

Как показывает практика, ржавчина (коррозия) поражает почти 12% производимого в мире железа. В связи с тем, что окружающая среда становится все более агрессивной, в том числе из-за ее загрязнения, металлы эксплуатируются все в более сложных условиях. Оксиды серы или азота, выделяемые из атмосферы, образуют микрокапли азотной или серной кислоты, что приводит к существенному возрастанию скорости появления ржавчины.
Химические основы процесса коррозии железа
Железо является химически активным металлом. Оно в присутствии кислорода и воды подвергается окислению, при этом образуя разнообразные соединения: оксиды, гидроксиды, гидраты оксидов. Химки констатируют, что определенной формулы ржавчины нет. Что такое ржавчина? Это коррозия, которая образуется вследствие окисления железа. Она обладает переменным составом, который зависит от окружающей среды.

Ржавчина поражает железо по его всей поверхности. Однако самыми уязвимыми являются внутренние и внешние узлы изделий, сварочные швы, резьбовые соединения. Структуры ржавого железа отличаются значительной степенью рыхлости. У ржавчины отсутствует какое-либо сцепление с металлом. Вследствие того, что поверхность высокопористой коррозии свободно удерживает в себе атмосферную влагу, создаются оптимальные условия для дальнейшего разрушения железа.
Обычно цвет ржавчины - красно-бурый, коричневый, который не позволяет оценить состояние железа под слоем коррозии. Под ржавчиной металл может быть окончательно разрушен. Если не принимать меры для предотвращения ее распространения, то результаты воздействия коррозии на железо могут оказаться катастрофическими, привести к полному разрушению конструкций. Это особенно опасно, если ржавчина разъела опоры ЛЭП или дно морского судна. Что такое ржавчина для автомобиля, и какой вред она несет, известно каждому автомобилисту.

Причины появления ржавчины
Ржавчина начинает появляться тогда, когда металл контактирует с кислородом, водой, окислителями либо кислотами. Одним из условий того, что металл подвергается ржавчине, является наличие в нем примесей либо добавок. Если имеет место контакт железа с внешними раздражителями в присутствии соли (соленая вода), то коррозия разрушает его значительно быстрее в виду начала электрохимических реакций.
Если железо является чистым, без примесей, то оно к воздействиям кислорода и воды значительно устойчивее. Так же, как и у них металлов, таких как алюминий, на его поверхности образуется плотное оксидное покрытие (слой пассивации), который обеспечивает защиту основной массы железа от более глубокого окисления. Однако и этот слой может быть разрушен, если начинается взаимодействие железа с кислородом и водой совместно.

Иными факторами, которые активно разрушают железо, являются углекислый газ в воде и серный диоксид. При их воздействии очень активно образуются разнообразные типы гидроксида железа. Они, в отличие от оксидов железа, не могут защитить металл. Гидроксид, формируясь, начинает отслаиваться от поверхности железа, после чего негативному воздействию подвергается нижний слой, который также отслаивается. И этот процесс длится до того времени, пока весь металл не будет уничтожен, либо в окружающей среде не останется кислорода, диоксида углерода, серы и воды.
Если железо, подвергаясь сгоранию на воздухе, контактирует с кислородом, то имеет место образование оксида железа ii.
При сгорании в чистом кислороде — оксид IV.
Оксид железа iii образуется тогда, когда через металл, находящийся в расплавленном состоянии, проходит воздух или кислород.
Состав ржавчины
Ржавчина, которая образуется в обычных условиях, является как правило смесью 3 оксидов железа. Они образуются не в один момент и имеют разные физико-механические свойства. Железные оксиды с самого нижнего слоя по направлению к поверхности представляют собой сочетание следующих составляющих:
- Вюстит (оксид железа) - мягкая структура, зависящая от условий, в которых находится металл. Если температура хранение высокая, то этот слой наибольший.
- магнетит (магнитный железняк) – окись-закись железа, обладающая более высокой пористостью, чем вюстидный слой, и меньшей твердостью. Это структура имеет выраженные магнитные свойства.
- Гематит (красный железняк) – обычно это структура красно-серого цвета, твердое абразивное вещество. Гематит обладает более высокой плотностью, разъедает металл и увеличивает коэффициент трения при соприкосновении с поверхностями.

Перед тем, как заняться работами по ликвидации ржавчины, необходимо узнать состав металла, особенно на его поверхности, а также установить условия, которые способствовали ее появлению. Располагая такой информацией, достаточно просто найти оптимальный вариант для удаления оксида железа и выбрать наиболее эффективные средства для борьбы с ржавчиной.
Классификация способов борьбы с коррозией
С учетом основных составляющих коррозии, способы, как вывести ржавчину, делятся на следующие:
- Механический - ликвидация оксидного слоя осуществляется посредством жестких металлических щеток, наждачной бумаги и т. п.
- Тепловой - осуществляется посредством воздействия на коррозию высоких температур, обычно в сочетании с водяным и (или) воздушным потоками.
- химический - удаление оксидов железа осуществляется вследствие воздействия на них специальными средствами, растворяющими ржавчину, при нанесении их на поверхность металла.
Необходимо учитывать, что эффективность вышеуказанных методов различна. Так, если процесс образования коррозии установлен своевременно, и это небольшое пятно, то поверхность железа можно эффективно обработать стальной щеткой, наждачный крупнозернистой бумагой, угловой шлифовальной машиной с соответствующей насадкой.
Однако если установлено, что ржавчина захватила большие поверхности, то тогда оптимальными методами будут химические.
Если площади ржавого металла очень большие, их невозможно транспортировать, то тогда оптимальным считается тепловая обработка, но она связана с высокой трудоемкостью.
Обычно обработка металла для удаления ржавчины осуществляется комбинированными способами, при которых различные методы применяют в определенной последовательности.
Механические способы
Выбор определенного способа механической обработки зависит от вида поверхности железа. Так для мотков стальной проволоки применяют ее перематывание с одного носителя на другой. В этом случае при перегибах ржавчина отделяется от поверхности металла.

При удалении коррозии механическим способом обычно используют жесткие щетки из стальной щетины или наждачную бумагу (крупнозернистую).
К недостаткам механических способов избавления от ржавчины относится тот факт, что на поверхности железа остаются следы, образованные очистительным инструментом. Поэтому рекомендуется поверхность очищенного железа подвергать полировке для придания ей прежнего внешнего вида.
Тепловая очистка
Для удаления ржавчины тепловыми методами необходимы специальные установки (промышленные парогенераторы либо строительные фены). Способ очистки от оксидов железа основан на том, что контакт ржавчины с основным металлом не прочен. Воздействие повышенной температуры и горячей влаги при большом скоростном воздушном потоке такое, что ржавчина удаляется практически полностью.
Наиболее эффективен этот метод тогда, когда на обрабатываемую поверхность подается и горячий пар. Паровоздушная смесь в струе, которая подается на металлическую поверхность под давлением, приводит к размягчению ржавчины, дроблению на отдельные фрагменты, которые удаляются с поверхности железа воздушным потоком.
Эти методы особенно эффективны, когда необходимо удалить ржавчину со стальных дверей, вентиляционных конструкций, металлических структур, демонтировать которые невозможно либо затруднительно.
Химическая очистка
В настоящее время методы химической очистки металлических поверхностей от ржавчины очень разнообразны. Однако у всех в основе лежит один процесс - удаление коррозии посредством химического воздействия на нее растворами кислот.
К наиболее эффективным способам избавления от окислов железа относят воздействие на ржавчину соляной кислотой, особенно когда ее концентрация в растворе составляет не менее 15%. Если концентрация меньше, то растворение ржавчины существенно замедляется.
Кислотные составы, сделанные на основе серной кислоты, применять не следует, так как в результате воздействия на поверхности железа образуется слой гидридов, которые повышают хрупкость металла.

Если необходимо осуществить химическую очистку металла в домашних условиях, то возможно применение неагрессивных веществ, таких как лимон, уксус и т.п. Принцип воздействия на коррозию такой же. Эти вещества достаточно хорошо растворяют ржавчину, которая потом легко удаляется ветошью. Что такое ржавчина и как ее удалить, вероятно, знает большинство домохозяек.
Применение иного оборудования для удаления коррозии металла
Механические методы борьбы со ржавчиной возможно использовать далеко не всегда, особенно если металлические изделия имеют сложные формы.
Химические методы имеют также определенные недостатки. Если не соблюдать технику безопасности, то можно получить химический ожог либо отравление. Есть сложности с утилизацией отработанных растворов.

Вследствие этого наиболее оптимальным является применение способа так называемого мягкого бластинга. Его принцип состоит в том, что на поверхность металла, поврежденного ржавчиной, направляется струя сжатого воздуха, которая содержит в себе абразивные составляющие.
Изменяя давление в струе, можно регулировать глубину слоя, который снимается. Это приводит к тому, что удаляется только ржавчина, тогда как сам металл остается сохранным. Гранулы, которые действуют на коррозию, состоят из мелкодисперсной соды и мела, можно применять и очень мелкий песок.
Коррозия металлов в кислотах
Коррозия металла в кислотах – это его разрушение при взаимодействии с концентрированными или разведенными кислотами. Часто такие разрушения встречаются на химических производствах и других сферах деятельности человека. Слабые кислотные растворы могут создавать даже некоторые продукты питания, и непокрытый металл, соприкасающийся с ними, будет коррозировать. То, как себя поведет металлический предмет при контакте с кислотой, зависит от его способности пассивироваться. Процесс коррозии металлов в кислотах проходит с выделением водорода.
Рассмотрим более подробно случаи коррозии металла в кислотах разного происхождения.
Коррозия металлов в соляной кислоте
Соляная кислота является очень агрессивной по отношению к металлам. В большей степени это обуславливается содержанием в ней ионов Cl - . Даже коррозионно-стойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
Коррозия никеля в серной кислоте не протекает даже в случаях, когда достигается температура кипения. В присутствии трехвалентного железа, хлоридов, других окислителей никель и его сплавы начинают разрушаться.
Низколегированная аустенитная сталь при комнатной температуре и концентрации соляной кислоты в 0,2 – 1% подвергается коррозии со скоростью 24 г/(м 2 •сут).
Коррозия металлов в органических кислотах
Самой сильной среди органических кислот является уксусная. В яблочной, бензойной, пикриновой, олеиновой, винной, стеариновой кислотах даже при больших температурах (выше 100°С) коррозионно-стойкие стали отличаются высокой устойчивостью. При контакте металлов с муравьиной кислотой образуются питтинги (особенно при увеличении температуры). Глубина их даже больше, чем в уксусной кислоте.
В органических кислотах высокой устойчивостью обладает алюминий, т.к. на его поверхности присутствует защитная пленка труднорастворимых окислов.
Щавелевая, себациновая, лимонная и молочная кислоты вызывают коррозию сталей только при больших концентрациях. В них устойчивы хромистые стали с добавками молибдена.
Коррозия металлов в азотной кислоте
Азотная кислота обладает агрессивным воздействием по отношению ко многим металлам. Малоуглеродистые стали не обладают достаточной устойчивостью в растворах азотной кислоты. Кроме того, при повышении концентрации HNO3 до 35 – 40% (при данных концентрациях сталь переходит в пассивное состояние) коррозия малоуглеродистых сталей в азотной кислоте увеличивается. При концентрации азотной кислоты близкой к 100% пассивное состояние нарушается. Азотная кислота является окислителем. При коррозии железа катодными деполяризаторами являются молекулы азотной кислоты и нитрат-ионы. Устойчивость в азотной кислоте хромистых сталей повышается, если в их состав вводить никель и молибден. Коррозионное разрушение сталей в азотной кислоте происходит по границам зерен. На алюминий слабое влияние оказывают пары азотной кислоты или растворы с концентрацией более 80%. При нормальной температуре алюминий обладает высокой коррозионной стойкостью в азотной кислоте. Скорость коррозии алюминия в азотной кислоте возрастает при постоянном перемешивании и присутствии в растворе хлорид-ионов.
Коррозия металлов в серной кислоте
При концентрации серной кислоты около 50 – 55% поверхность железа переходит в пассивное состояние. Далее с повышением температуры и концентрации серной кислоты поверхность железа становится активной (наблюдается коррозия железа в серной кислоте).
В растворах серной кислоты, как и в других кислотах, на скорость коррозии железа большое влияние оказывает природа анионов. Это связано с торможением катодного и анодного процессов и их адсорбцией на поверхности металла.
Я.М. Колотыркин развил представления, что на анодное растворение железа оказывают влияние анионы. Это связано с образование комплекса:
Из вышеперечисленных уравнений понятно, что скорость анодного процесса возрастает с увеличением концентрации ионов HSO4 - и SO4 2- . С поверхности железа сульфат ионы вытесняются хлорид ионами, но до определенной концентрации ионов хлора, скорость протекания анодного процесса замедляется.
В 95 – 98% серной кислоте при нормальной температуре хорошей устойчивостью обладают хромистые стали (с содержанием хрома около 17%) с небольшой добавкой молибдена или без него. В таких условиях (при большой концентрации серной кислоты) стоек также алюминий и углеродистые стали. Чистый алюминий (99,5%) более устойчив в серной кислоте, чем его сплавы, в состав которых не входит медь. Скорость коррозии алюминия в серной кислоте (и его сплавов) при повышении температуры с 20°С до 98°С увеличивается с 8 до 24 г/(м 2 •сут). Коррозионно-стойкие стали в 5-ти или 20-% растворе при температуре кипения серной кислоты устойчивы только в присутствии ингибиторов коррозии.
При обычной температуре в серной кислоте коррозия меди практически не наблюдается. А при повышении температуры до 100°С процесс разрушения интенсифицируется. В 25% растворе серной кислоты, повышенном давлении и температуре близкой к 200°С медь быстро разрушается.
Латунь не обладает коррозионной стойкостью в растворах серной кислоты любых концентраций даже при комнатной температуре. Устойчивость латуней к разрушению в серной кислоте можно только повысить введением в раствор 30% соли CuSO4•5H2O.
Коррозия металлов в фосфорной кислоте
Наибольшей стойкостью к коррозии в фосфорной кислоте отличаются молибденовые стали. Алюминий и его сплавы (в состав которых не входит медь, магний) устойчивы в фосфорной кислоте. При обычной температуре не поддаются также разрушениям хромоникелевые аустенитные стали (в растворах фосфорной кислоты любой концентрации). В концентрированной технической фосфорной кислоте при температуре не выше 50°С стойки малоуглеродистые стали. Если сталь с 17% хрома поместить в раствор фосфорной кислоты, концентрацией от 1 до 10%, то она будет обладать высокой устойчивостью даже при температуре кипения.
Медь практически не подвергается коррозии в фосфорной кислоте при температуре от 20 до 95°С. Но если в систему вводить окислитель и повышать температуру – скорость коррозии меди в фосфорной кислоте значительно увеличивается. Бронзы и латуни в фосфорной кислоте ведут себя аналогично.
Коррозия металлов во фтористоводородной кислоте
Чугун, малоуглеродистая сталь и железо во фтористоводородной кислоте быстро разрушаются. В 10-% фтористоводородной кислоте при нормальной температуре обладают хорошей устойчивостью хромистые стали (с содержанием хрома 17%). В 20-% кислоте при температуре до 50°С устойчивы аустенитные высоколегированные стали. Латуни не разрушаются в 40-60-% фтористоводородной кислоте при 20°С. Магниевые сплавы устойчивы при температурах до 65°С в 45-% растворе.
8 сильнейших кислот, известных нам

Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа - это количественно выраженная сила кислоты в водном растворе. С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [H3O +] в растворе.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
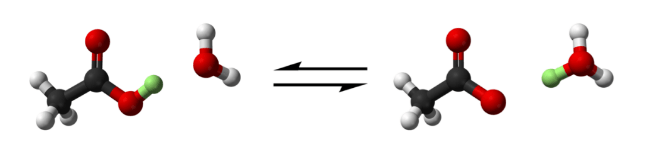
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота. Суперкислота - это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота

Серная кислота (98%) на листе бумаги
Химическая формула: H2SO4
pKa значение: -3
Ho значение: 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота

Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота

Химическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота - нет.
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
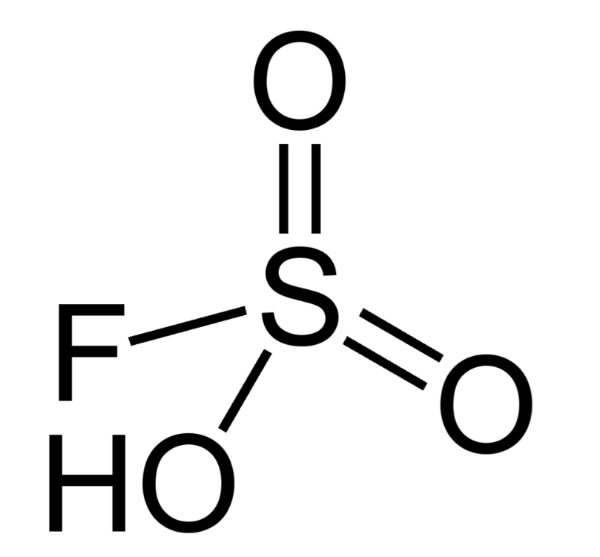
Химическая формула: HSO 3 F
H O значение: -15.1
pK A значение: -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота

Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
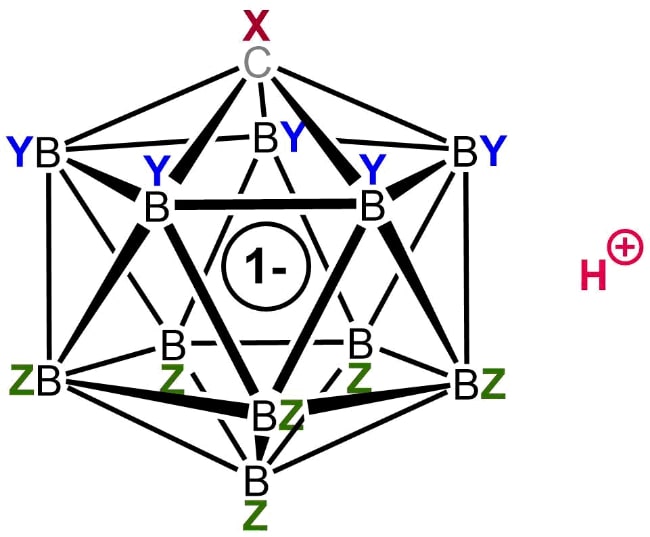
Общая структура карбоновой кислоты
Химическая формула: H (CHB 11 F 11)
H o значение: -18
pK a значение: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
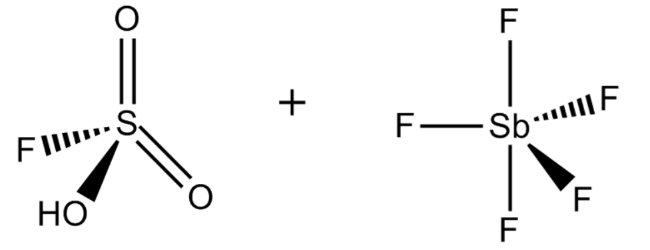
Химическая формула: FSO 3 H · SbF 5
H o значение: -23
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
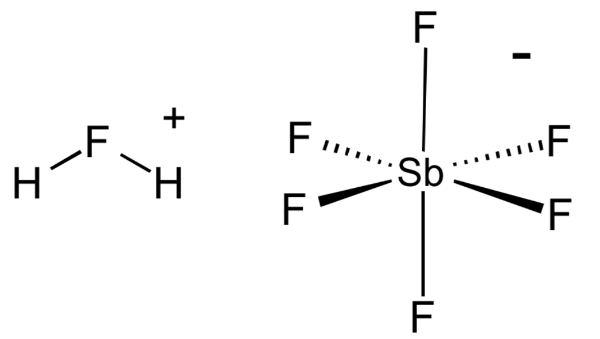
Химическая формула: H 2 FSbF 6
H o значение: -15 (в чистом виде), -28 (с> 50 мол.%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Серная и соляная кислоты: какая сильнее?
Вещество серная кислота – токсичный и смертельно опасный реагент. Но без него современное человечество обойтись не может. используют при производстве лекарственных препаратов, химической продукции, металлургии, удобрений, нефтепродуктов. Вещество не имеет особого запаха, бесцветно, вязкой консистенции, но имеет привкус меди. Отлично взаимодействует с водой в любых пропорциях. Из-за хорошего взаимодействия с другими веществами и водой имеет неофициальное название «кровь химии».

Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
- Соляная кислота — неорганическое вещество, одноосновная кислота, одна из самых сильных кислот. Используются также другие названия: хлористый водород, кислота хлороводородная, кислота хлористоводородная.Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман. Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, глутамината натрия, хлоридов металлов, например, хлорида цинка, хлорида марганца, хлорида железа; синтеза хлорорганических веществ; катализатор в органических синтезах.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.— Обрабатывают кожу перед дублением.— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.

Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
- Возникает лишь покраснение и боль.
- Появляются пузыри с прозрачной жидкостью и отек.
- Формируется некроз верхних слоев кожи. Пузыри заполняются кровью или мутным содержимым.
- Поражение достигает сухожилий и мышц.
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие — тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь — это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Коррозия металла в кислотах – это его разрушение при взаимодействии с концентрированными или разведенными кислотами. Часто такие разрушения встречаются на химических производствах и других сферах деятельности человека.
Слабые кислотные растворы могут создавать даже некоторые продукты питания, и непокрытый металл, соприкасающийся с ними, будет коррозировать. То, как себя поведет металлический предмет при контакте с кислотой, зависит от его способности пассивироваться.
Процесс коррозии металлов в кислотах проходит с выделением водорода.
Коррозия металлов в соляной кислоте
Соляная кислота является очень агрессивной по отношению к металлам. В большей степени это обуславливается содержанием в ней ионов Cl-. Даже коррозионно-стойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
Низколегированная аустенитная сталь при комнатной температуре и концентрации соляной кислоты в 0,2 – 1% подвергается коррозии со скоростью 24 г/(м2•сут).
Коррозия металлов в органических кислотах
Коррозия металлов в азотной кислоте
Азотная кислота обладает агрессивным воздействием по отношению ко многим металлам. Малоуглеродистые стали не обладают достаточной устойчивостью в растворах азотной кислоты.
Кроме того, при повышении концентрации HNO3 до 35 – 40% (при данных концентрациях сталь переходит в пассивное состояние) коррозия малоуглеродистых сталей в азотной кислоте увеличивается. При концентрации азотной кислоты близкой к 100% пассивное состояние нарушается. Азотная кислота является окислителем.
При коррозии железа катодными деполяризаторами являются молекулы азотной кислоты и нитрат-ионы. Устойчивость в азотной кислоте хромистых сталей повышается, если в их состав вводить никель и молибден. Коррозионное разрушение сталей в азотной кислоте происходит по границам зерен.
На алюминий слабое влияние оказывают пары азотной кислоты или растворы с концентрацией более 80%. При нормальной температуре алюминий обладает высокой коррозионной стойкостью в азотной кислоте. Скорость коррозии алюминия в азотной кислоте возрастает при постоянном перемешивании и присутствии в растворе хлорид-ионов.
Коррозия металлов в серной кислоте
Fe + H2O ↔ Fe(OH-)адс. + H+;
Fe(OH-)адс ↔ Fe(OH)адс + e-;
Fe(OH)адс + HSO4- →FeSO4 + H2O + e-;
Fe(OH)адс + SO42- → FeSO4 + OH- + e-;
FeSO4 = Fe2+ + SO42-.
Из вышеперечисленных уравнений понятно, что скорость анодного процесса возрастает с увеличением концентрации ионов HSO4- и SO42-. С поверхности железа сульфат ионы вытесняются хлорид ионами, но до определенной концентрации ионов хлора, скорость протекания анодного процесса замедляется.
В 95 – 98% серной кислоте при нормальной температуре хорошей устойчивостью обладают хромистые стали (с содержанием хрома около 17%) с небольшой добавкой молибдена или без него. В таких условиях (при большой концентрации серной кислоты) стоек также алюминий и углеродистые стали.
Чистый алюминий (99,5%) более устойчив в серной кислоте, чем его сплавы, в состав которых не входит медь. Скорость коррозии алюминия в серной кислоте (и его сплавов) при повышении температуры с 20°С до 98°С увеличивается с 8 до 24 г/(м2•сут).
Коррозионно-стойкие стали в 5-ти или 20-% растворе при температуре кипения серной кислоты устойчивы только в присутствии ингибиторов коррозии.
Латунь не обладает коррозионной стойкостью в растворах серной кислоты любых концентраций даже при комнатной температуре. Устойчивость латуней к разрушению в серной кислоте можно только повысить введением в раствор 30% соли CuSO4•5H2O.
Коррозия металлов в фосфорной кислоте
Наибольшей стойкостью к коррозии в фосфорной кислоте отличаются молибденовые стали. Алюминий и его сплавы (в состав которых не входит медь, магний) устойчивы в фосфорной кислоте.
При обычной температуре не поддаются также разрушениям хромоникелевые аустенитные стали (в растворах фосфорной кислоты любой концентрации). В концентрированной технической фосфорной кислоте при температуре не выше 50°С стойки малоуглеродистые стали.
Если сталь с 17% хрома поместить в раствор фосфорной кислоты, концентрацией от 1 до 10%, то она будет обладать высокой устойчивостью даже при температуре кипения.
Коррозия металлов во фтористоводородной кислоте
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
- Металлургии. Применение при паянии, лужении и зачистке металлов.
- Пищевая промышленность. Применение при производстве пищевых регуляторов кислотности, к примеру, Е507.
- Гальванопластика. Используется при травлении.
- Медицине. Находит свое применение при производстве искусственного желудочного сока.
Что разъедает ржавчину
Ржавчина на металле – часто встречающийся факт, огорчающий хозяев и поставщиков металлопроката. Небольшой налет на кругах, уголках, швеллерах, толстых листах считается вполне допустимым явлением и не влияет на цену проката. Он будет удален при обработке и шлифовке металлопроката. Если коррозия появляется на готовых металлических изделиях, трубах, радиаторах отопления, инструментах, автомобильных деталях, предметах обихода, то с ней можно бороться разными методами.
Химические и физические способы борьбы со ржавчиной металла
На рынке имеется множество специальных химических средств, позволяющих убрать ржавые пятна или потеки (ф.2, 2а, 2б, 2в). В их составе включены щелочи и кислоты. Перед нанесением химических растворителей, проржавевшее место протирается жесткой щеткой.
Затем на него наносится растворитель на срок, указанный на этикетке. После этого, место протирается тряпкой, и на него наносят средство с антикоррозийной пропиткой (если это целесообразно).
Физический метод сопряжен с применением силы путем очищения металлической щеткой или электроинструментом со специальной насадкой (ф.3).
фото 2-2в, химических средств, позволяющих убрать ржавчину
удаление ржавчины электроинструментом со специальной насадкой (фото 3)
Химический растворитель применяют на небольших деталях, заготовках, инструменте. Очистка хрупких деталей требует наличия в его составе ингибиторов, уменьшающих влияние кислоты.
Благодаря преобразователям ржавчины (ф.4), можно остановить процесс развития и удалить ржавчину с металла. Преобразователь ржавчины в виде спрея, суспензии, раствора преобразует металлическую поверхность в химически чистое железо. При этом цвет изношенной детали становится сине-фиолетовым. Такая поверхность требует покраски (если это возможно).
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент — газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это — химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.
Читайте также:
