Почему металлы щелочноземельные металлы
Обновлено: 21.09.2024
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.

Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.

Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Щелочноземельными эти металлы называют, т.к. они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию.
Строение электронных оболочек
Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 2 электрона на s-подуровне:
n S 2
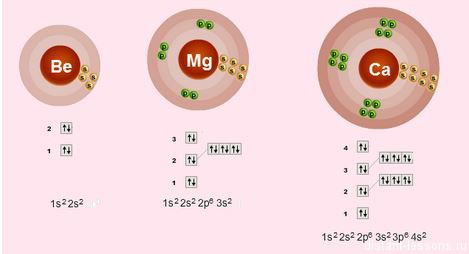
Что это означает?
- Валентности элементов = 2, т.е. каждый атом может образовывать 2 связи.
- Степень окисления элементов = +2 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Ba более сильный металл, чем Be.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства щелочно-земельных металлов

Общие характеристики:
- все металлы сероватого цвета,
- твердые, ножом, как щелочные металлы, их уже, конечно, не порежешь 🙂
- плотность больше 1,
- на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой,
- окрашивают пламя в разный цвет (это используют для получения разных цветов пламени в пиротехнике):
Ca — в кирпично-красный
Химические свойства металлов
Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
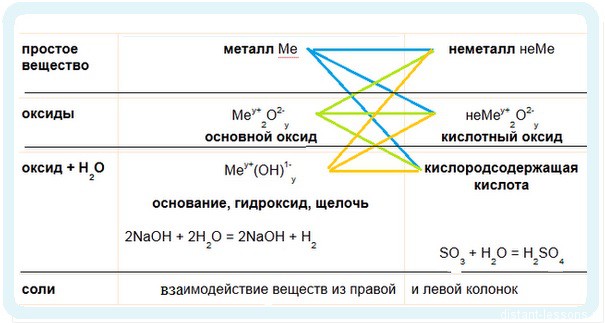
1. Идем по синим стрелочкам — взаимодействие металлов:
Металлы традиционно проявляют металлические — восстановительные свойства.

2. Идем по зеленым стрелочкам — реакции для оксидов

3. Идем по оранжевым стрелочкам

Обратите внимание, что гидроксиды щелочноземельных металлов либо малорастворимы, либо нерастворимые, поэтому их образование может служить качественной реакцией.
Be(OH)2 — амфотерный гидроксид, он может реагировать как с основаниями, так и с кислотами!
3. Щелочноземельные металлы с водородом также образуют гидриды.
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочноземельными металлами будет проявлять отрицательную степень окисления.
Как определить качественные реакции? Загляните в таблицу растворимости!
Be(OH)2 — гелеобразный белый осадок;
Сa(OH)2 — белый осадок;
Mg(OH)2 — белесый осадок;
Фториды — белесо-бесцветные осадки;
Сульфиты и сульфаты — белые осадки.
Как видите, цвета осадков не отличаются цветовым разнообразием 🙂
Получение щелочно-земельных металлов
Обычно щелочноземельные металлы получают электролизом расплавов их солей:
Щёлочноземельные металлы - основные свойства, характеристика и список элементов
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
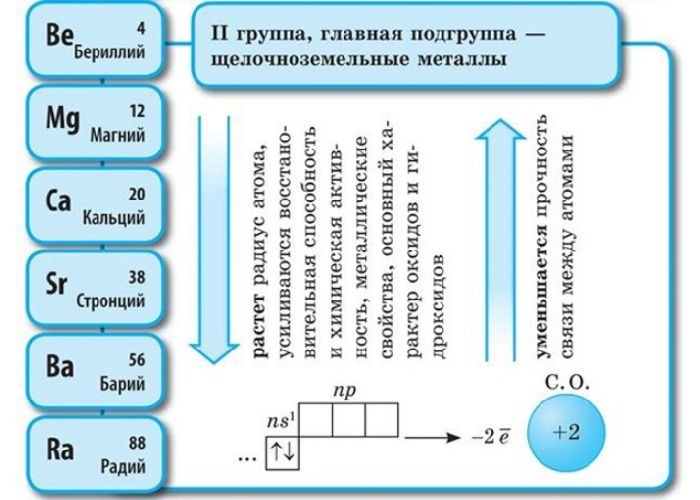
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS 2 :

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
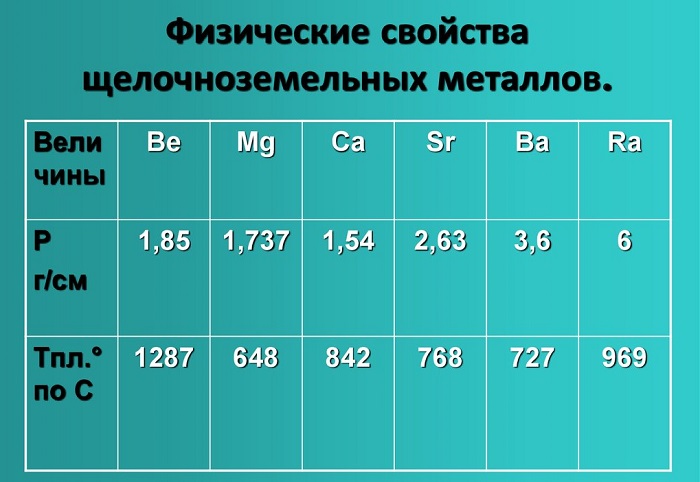
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
С кислородом образуют реакцию горения и оксид:
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2 — хлорид бериллия;
Ca + Br2 = CaBr2 — бромид кальция;
Sr + H2 = SrH2 — гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
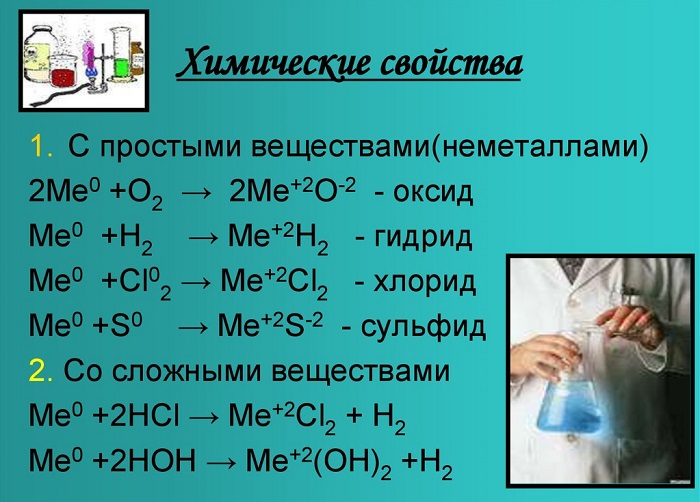
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Sr — насыщенный красный;
Ba - светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Щёлочноземельные металлы - основные свойства, характеристика и строение элементов
Название «щелочноземельные металлы» происходит из времен, когда химия только начинала развиваться, и связано со старинным названием оксидов — их называли «земли». Гидроксиды металлов этого семейства являются щелочами. Отсюда и такое комбинированное название — щелочноземельные, то есть металлы, способные образовывать гидроксиды (щёлочи) и оксиды (земли).

Описание группы веществ
Все элементы этой группы твердые, за исключением разве что стронция (его можно разрезать ножом). Цвет щелочноземельные металлы имеют серый с серебристым оттенком. Все они обладают электропроводностью и теплопроводностью, которые являются классическими свойствами металлов. Согласно современной классификации, к этому классу веществ относятся соединения из следующего списка:

- бериллий;
- барий;
- кальций;
- магний;
- стронций;
- радий;
- унбинилий.
Ранее магний и бериллий, несмотря на то что они располагаются в том же столбце таблицы Менделеева, к этой группе не относили, так как щелочами их гидроксиды не являются. Кроме того, с водой магний реагирует очень медленно, а бериллий не реагирует вообще.
Взаимодействие с другими соединениями

Щелочные и щелочноземельные металлы характеризуются выраженными восстановительными свойствами (выражены они у щелочных металлов в большей степени, чем у щелочноземельных. Запомнить легко: какой столбец левее в таблице Менделеева, там вещества активнее. Хотя по сравнению с щелочными металлами они несколько слабее.
Во избежание окисления на воздухе, хранить вещества этой группы в лабораторных условиях и кабинетах химии предписывается под слоем жира, почему в обычных, «комнатных», условиях их хранить нельзя. Они должны находиться в нейтральной среде. Щелочноземельные металлы способны взаимодействовать со следующими веществами:
- неметаллами;
- кислородом (с образованием оксидов);
- водой (при взаимодействии образуется щелочный раствор и происходит выделение водорода);
- кислотами.
Получение щелочноземельных металлов
Получают вещества этого класса, чтобы использовать их в дальнейшем в промышленных целях. Образование веществ этого класса можно рассмотреть на следующих примерах:
- Результатом электролиза расплава солей соответствующих металлов и является выделение чистых кальция и стронция. Наиболее часто для этой цели используют хлориды.
- Чтобы получить чистый барий, используется реакция, где при взаимодействии оксида бария с алюминием и нагревании образуется оксид алюминия и барий высокой чистоты. Этот способ называется алюмотермическим.
Лидером по распространённости в окружающем мире является кальций. Напротив, наименьшую распространение в природе имеет радиоактивный элемент радий.

Следует отметить, что в природе щелочноземельные металлы встречаются в виде составных частей минералов. Отсутствие в природе этих элементов в чистом виде связано с их высокой химической активностью. В частности, кальциевыми солями насыщены граниты, мраморы и известняки.
Бериллий обнаруживается в составе аквамарина, изумруда и гелиодора.
Соли магния определяют жесткость воды. В большом количестве этот элемент содержится в морской воде (в виде солей).
А обнаружение солей радия является сигналом о близости урановых руд.
Эти соединения встречаются не только в так называемый неживой природе. В частности, кальций и магний — биогенные элементы; они необходимы для нормального функционирования живых организмов.
Кальций в виде солей в изобилии содержится в клетках животных, их зубах и других тканях. Необходим он и для работы мышц, а также свертываемости крови.
Магний — важнейший внутриклеточный элемент. Он регулирует целый ряд жизненно важных процессов:
- синтез нуклеиновых кислот;
- работу нервной системы;
- функционирование ферментативных систем.
Практическое применение
Применение щелочноземельным металлам нашла не только природа. Научились это делать и люди.

Бериллий нашел применение в производстве ракетного топлива, а также сплавов, в том числе для атомных станций. Кальций, хорошо зарекомендовавший себя в качестве основы скелетов живых существ, нашел свое применение и при производстве строительных материалов. Кроме того, этот элемент используется при получении топлива, а также в фармацевтической промышленности.
Магний, основные свойства которого —это легкость и пластичность, хорошо поддаётся прокату и ковке. Из сплавов, содержащих этот металл, изготавливают детали и предметы, для которых важен низкий вес:
- металлические листы и профили;
- корпуса электронной техники.
Такие сплавы востребованы во многих отраслях промышленности (военной, электронной, космической, авиационной, автомобильной, приборостроительной).
Основные сферы применения солей стронция:
- радиоэлектрическая;
- металлургическая;
- пиротехническая;
- энергетическая;
- производство урана;
- производство магнитных материалов;
- изготовление керамики;
- медицинская промышленность, где изотоп этого вещества используется в качестве противоопухолевого средства.
Барий нашёл место это в атомной энергетике, оптики, в производстве вакуумных приборов. Благодаря свойству не растворяется в воде, сульфат этого металла используется в медицине в качестве контрастного вещества при рентгенографии и рентгеноскопии.
Люди нашли применение и редкому элементу радию. Используется он как при исследованиях в ядерной сфере, так и в медицине для лечения опухолей. От изготовления светящейся краски на основе радия пришлось отказаться в связи с опасностью этого вещества для людей.
Читайте также:
