Почему щелочные металлы встречаются в природе только в виде соединений
Обновлено: 04.10.2024
Цель урока: рассмотреть положение щелочных металлов в ПСХЭ, их нахождение в природе, физические и химические свойства; развивать умение наблюдать, сравнивать, анализировать, делать предположения и выводы; воспитывать ответственное отношение к учебе.
Задачи урока:
Образовательные:
- создать условия для получения учащимися знаний о положении щелочных металлов в периодической системе химических элементов Д.И. Менделеева, физических и химических свойствах щелочных металлов, нахождении в природе и значимости металлов в жизни человека.
Развивающие:
- способствовать развитию у учащихся логического мышления, умения анализировать и сравнивать, работать с дополнительной информацией.
Воспитательные:
- содействовать формированию представлений о причинно-следственных связях и отношениях, вырабатывать стремление к коллективизму, формировать мировоззренческое понятие о познаваемости природы.
Планируемые результаты
- знать нахождение щелочных металлов в природе;
- знать физические и химические свойства щелочных металлов;
- уметь составлять уравнения реакций в соответствие с химическими свойствами щелочных металлов.
- формировать уважительное отношение к чужому мнению;
- формировать ответственное отношение к учению.
Метапредметные:
Коммуникативные:
- уметь слушать собеседника и вести диалог; уметь признавать возможность существования различных точек зрения.
Регулятивные:
- продолжить развитие умения планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели.
Познавательные:
- умение определять понятия, устанавливать аналогии, строить логические заключения и делать выводы.
Тип урока: урок изучения нового материала
Оборудование: спиртовка, ложки для сжигания веществ.
Реактивы: соли Na и K
I Организационный момент
II Актуализация опорных знаний учащихся.
III Мотивация учебной деятельности
1. Как называются элементы 1 группы главной подгруппы. Перечислите их. (Щелочные металлы; Li; Na; K; Rb; Cs; Fr)
Fr - радиоактивный металл, наиболее долгоживущий изотоп его имеет период полураспада 22 минуты.
2.Составьте электронные и графические формулы щелочных металлов? Li; Na; K( Na )2)8)1 K )2)8)8)1)
3.Чем отличаются и что общего в строении этих элементов?
(Разный атомный радиус; одинаковое число валентных электронов на последнем слое – 1 e ).
4. Какую степень окисления будут иметь щелочные металлы? (+1).
5. Какими свойствами обладают все металлы (восстановители).
Какова цель нашего урока?
IV Изложение нового материала
1.Положение щелочных металлов в ПСХЭ
К щелочным металлам относятся элементы первой группы, главной подгруппы: литий, натрий, калий, рубидий, цезий, франций.
Происхождение названий щелочных металлов
Li (1817) лат. " литос" - камень
Na (1807) араб. "натрум" -сода
К (1807) араб. "алкали" - щелочь
Rb (1861) лат. "рубидус" - темно-красный
Cs (1860) лат. "цезиус" - небесно-голубой
Fr (1939) от названия страны Франция.
Все они имеют одинаковое строение внешнего энергетического уровня, а, следовательно, сходные физические и химические свойства. В соединениях всегда одновалентны.
С увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны увеличивается и восстановительная активность увеличивается.
2.Нахождение в природе
Щелочные металлы в природе встречаются только в виде соединений.
Na-2,64% (по массе), K-2,5% (по массе), Li, Rb, Cs - значительно меньше, Fr- искусственно полученный элемент.
Самостоятельная работа учащихся с учебником (стр.152, таблица 30)
NaCl – поваренная соль (каменная соль), галит
KCl • NaCl – сильвинит
Na2SO4 • 10H2O – глауберова соль (мирабилит)
KCl • MgCl2 • 6H2O – карналлит
NaNO3 – чилийская селитра
3. Натрий и калий – их биологическая роль и применение соединений натрия и калия в медицине.
Натрий и калий являются биогенными элементами, т.е. элементами, играющими важную роль в живых организмах, в частности, в организме человека.
Na+ – главный внеклеточный катион, участвует в создании мембранных потенциалов клеток, входит в состав плазмы крови. Общая масса его в организме - 100 г.
K+ – главный внутриклеточный катион, участвует в создании мембранных потенциалов клеток, участвует в поддержании сердечного ритма, регулирует водный режим. Общая масса в организме - 250 г.
В медицине находят широкое применение следующие соединения натрия и калия:
А) 0,9%-ный раствор NaCL является физиологическим раствором, используется для инъекций;
Б) пищевая сода NaНСO ₃ применяется как средство для понижения кислотности желудочного сока;
В) глауберова соль Na ₂ SO ₄ - известное слабительное средство.;
Г) раствор перманганата калия КМnО ₄ имеет способность убивать болезнетворные организмы, обладает антисептическими свойствами. Используют для полоскания слизистых оболочек горла, промывания желудка при пищевых отравлениях;
Д) соли калия входят в состав лекарственных препаратов, нормализующих сердечную деятельность.
3. Физические свойства
Щелочные металлы представляют собой вещества серебристо-белого цвета, которые быстро тускнеют на воздухе вследствие окисления. Для предотвращения контакта с воздухом и влагой во избежание взрывов и пожаров щелочные металлы хранят под слоем керосина в герметически закрытых сосудах, а литий в вазелине. Значит, эти вещества взрывоопасны. ЩМ хорошо проводят электрический ток, пластичны. Все щелочные металлы кроме лития очень мягкие, легко режутся ножом. Плотность металлов увеличивается с 0,53 г/см³ у лития до 2,44г/см³ у цезия. Плотность Li; Na; K меньше 1 г/см³, поэтому при внесении в воду они плавают на ее поверхности. Щелочные металлы легкоплавки: температура плавления понижается в подгруппе от 180 ⁰ С у лития до 28 ⁰ С у цезия.
Физкультминутка
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Плавно производим. (Повороты туловища влево и вправо)
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)
4.Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла. Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды. Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
2 Na + 2 H 2 O → 2 NaOH + H 2
Б) Взаимодействие с кислотами:
2Na + 2HCl → 2NaCl + H2
В) Взаимодействие с кислородом:
4 Li + O 2 → 2 Li 2 O (оксид лития)
K + O2 → KO2 ( надпероксид калия )
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
Г) Взаимодействие с неметаллами
2Li + Cl2 → 2LiCl ( галогениды )
2Na + S → Na2S ( сульфиды )
2Na + H2 → 2NaH ( гидриды )
ЛО № 10
Распознавание ионов натрия и калия.
Характерной для щелочных металлов является окраска, придаваемая каждым из них бесцветному пламени:
5. Получение
Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей:
2NaCl=2Na+Cl2
6. Применение щелочных металлов
Литий - подшипниковые сплавы, катализатор
Натрий - газоразрядные лампы, теплоноситель в ядерных реакторах
Рубидий - научно-исследовательские работы
VI Закрепление
1. Выполните тестовые задания стр.155
2. Выполните упр. 5 стр. 155
VII Домашнее задание
Изучить § 43, выполнить упр. 4 стр. 155
VIII Рефлексия:
C какими трудностями вы столкнулись при изучении этой темы и как вы решили эту проблему?
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
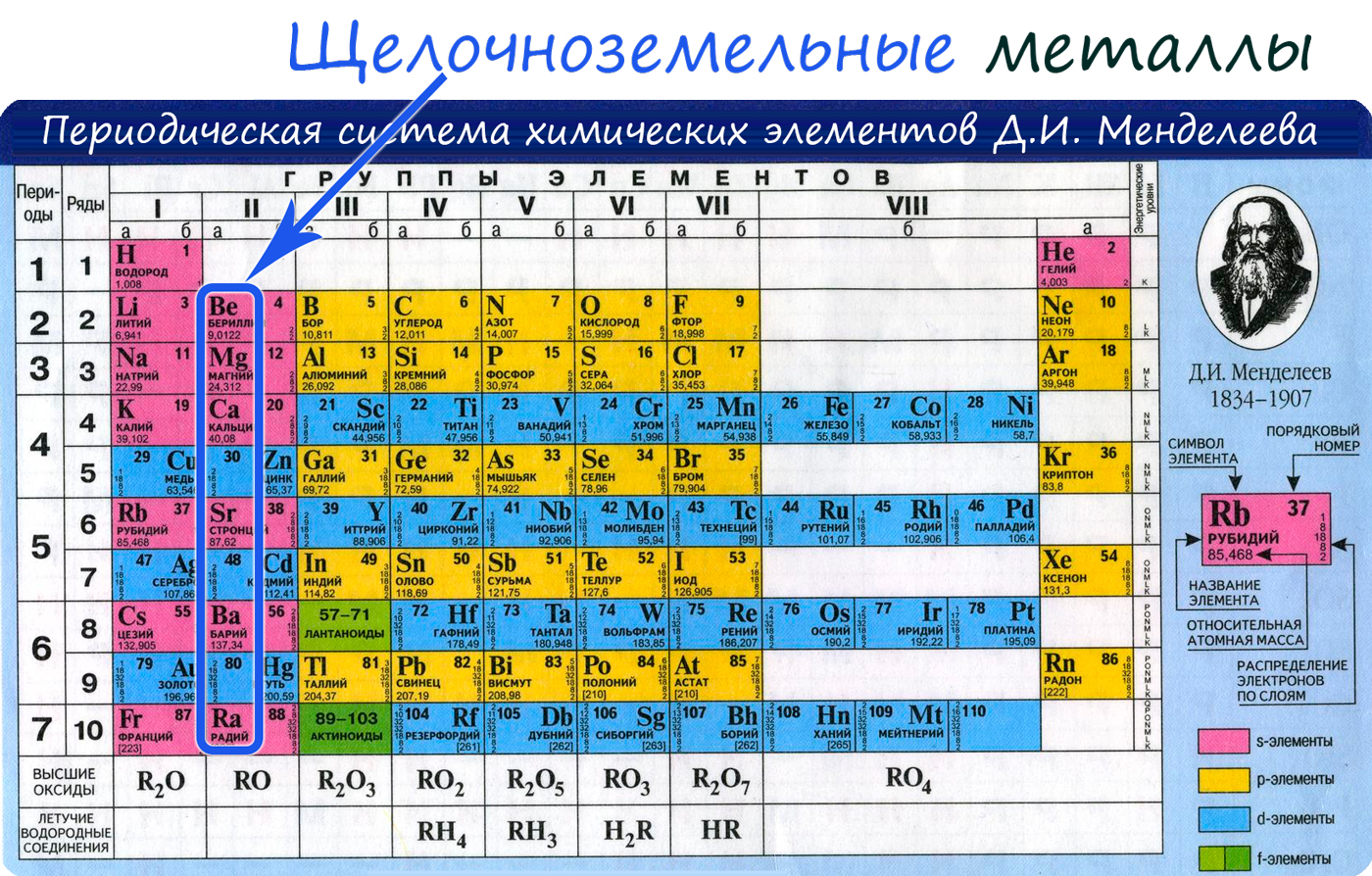
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
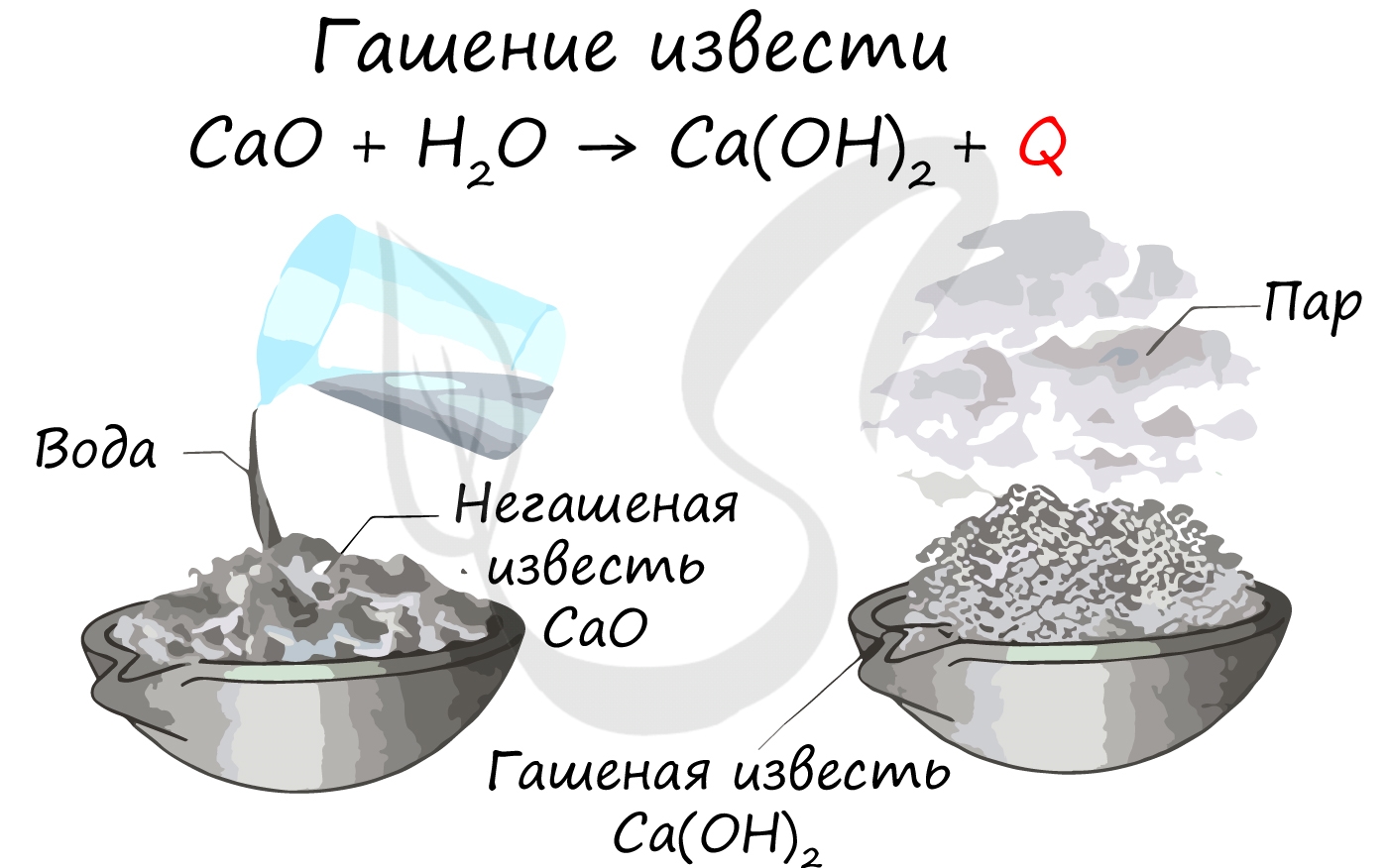
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
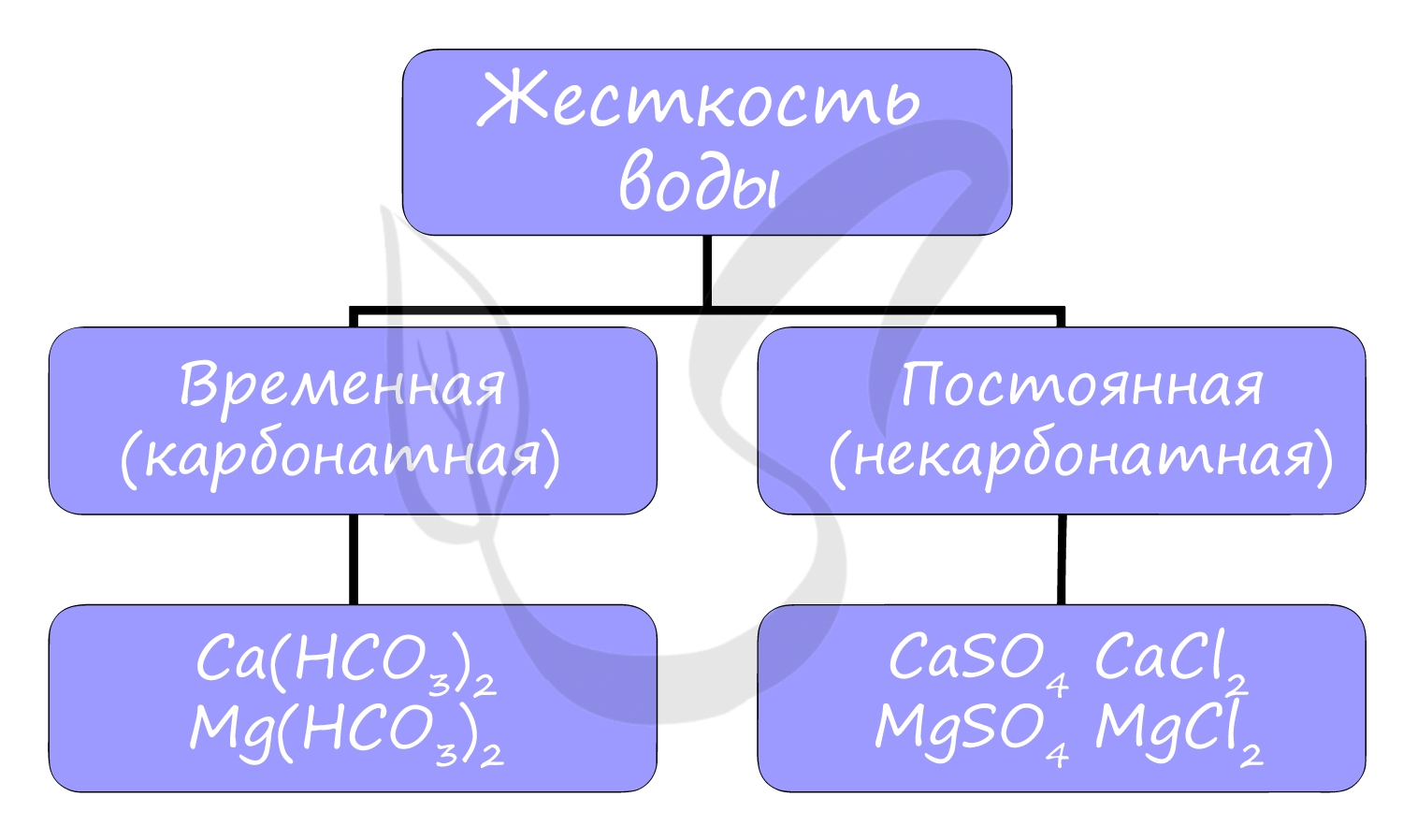
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

1. Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Презентация по теме Щелочные металлы

Дать общую характеристику элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева, повторить основные закономерности изменения свойств элементов по вертикали (в группе), металлическую связь и кристаллическую решетку, физические свойства металлов
ЦЕЛЬ УРОКА:

Разминка
Самый распространенный металл в земной коре -
A l
Самый твердый металл -
Самый тяжелый металл -
Основной компонент чугуна и стали -
При обычных условиях этот металл жидкий -
C r
O s
F e
H g
Самый тугоплавкий металл -
W


Увеличивается заряд ядра
Увеличивается радиус атома
Увеличиваются металлические и восстановительные свойства
Растет число энергетических уровней


Запомни!
Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1
NaOH, K2O, Li3PO4,
K2CO3, NaCl, Na2O2
+1
+1
+1
+1
+1
+1

Простые вещества
Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе;
Мягкие, легко режутся ножом;
Хорошо проводят тепло и электрический ток;
Легкие (Li, Na, K – легче воды);
Легкоплавкие
температуры плавления и кипения понижаются
плотность металлов увеличивается

Химические свойства
Металлы I группы главной подгруппы –
наиболее активные металлы,
обладают высокой восстановительной способностью
В ряду Li - Na - K - Rb - Cs- Fr
химическая активность увеличивается
Образуют соединения с ионной связью и ионной кристаллической решеткой

Взаимодействуют с неметаллами
Li + S
2 e
Восстановитель
Окислитель
СУЛЬФИД ЛИТИЯ
Na + P
3 e
Восстановитель
Окислитель
ФОСФИД НАТРИЯ
+1
0
0
+1
Li2S
2
Na3 P
3

Взаимодействуют с кислородом
Li + О2
4 e
Восстановитель
Окислитель
ОКСИД ЛИТИЯ
Na + O2
2 e
Восстановитель
Окислитель
ПЕРОКСИД НАТРИЯ
+1
0
0
+1
2Li2O
4
Na2 O2
2

Внимание!
При взаимодействии с кислородом
только литий образует оксид.
Другие металлы I группы главной подгруппы при взаимодействии с кислородом образуют пероксиды и надпероксиды.
ПЕРОКСИД НАТРИЯ
Na O O Na
+1
-1
-1
+1

A знаете ли вы?
При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию - углекислый газ связывается, а кислород выделяется:
2Na2О2 + 2СО2 → 2Na2CО3 + О2
На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.

Взаимодействуют с водой
Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В результате взаимодействия образуется щелочь и выделяется водород
Так как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ

Взаимодействуют с водой
2Li + 2H2О 2LiOH + H2
2 e
Восстановитель
Окислитель
ГИДРОКСИД ЛИТИЯ
Восстановитель
Окислитель
ГИДРОКСИД НАТРИЯ
+1
0
Na + H2О
2 NaOH + H2
2
2
0
+1
2 e

Хранение щелочных металлов
Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят под слоем керосина
Беречь от воды

Нахождение в природе
Щелочные металлы в природе встречаются только в виде соединений. Почему?
Na Cl
Галит, поваренная соль
Na Cl • K Cl
Сильвинит
K Cl• Mg Cl2• 6H2O
Карналлит
Na2SO4 • 10H2O
Мирабилит, глауберова соль
В океанических
водах
В минералах и горных породах
В живых организмах
Рубидий и цезий встречаются в виде примесей к другим щелочным металлам
Франций содержится в урановых рудах

Получение щелочных металлов
2NaCl (расплав) 2Na + Cl2
Щелочные металлы получают электролизом расплавов хлористых солей
электрический ток

Применение щелочных металлов
В металлургии в качестве восстановителя при получении титана, урана, циркония
и других металлов
В химической промышленности для получения пероксида натрия, гидрида натрия,
моющих средств и др.
В качестве добавок к сплавам,
для улучшения их свойств
В атомной промышленности, ядерной энергетике
Практического значения не имеет, в связи с высокой радиоактивностью
В качестве катализаторов
В электронике, радио-электротехнике
Na
Rb
Fr
K
Li
Cs

Из истории
Литий
Открыт в 1817 году шведским химиком А. Арфведсоном. Но в свободном виде был выделен позднее Г. Дэви путем электролиза щелочи
Натрий Калий
В 1807 году английский химик Г.Дэви впервые получил в свободном виде путем электролиза увлажненных твердых щелочей
Рубидий Цезий
Немецкие химики Р. Бунзен и Г. Кирхгоф с помощью спектрального анализа обнаружили в минералах в 1860 году – цезий, а в 1861 году – рубидий
Франций
Открыт в 1939 году М. Перей при анализе продуктов радиоактивного распада актиния. В 1946 году М. Пере предложила назвать элемент в честь своей родины Франции

Выбери правильный ответ
1. Щелочной металл
a) Mg
a) Ba
a) Al
a) Rb
2. Наиболее ярко выражены металлические свойства
a) Cs
a) Li
a) Fr
a) K
3. При взаимодействии с кислородом образует пероксид
a) Ca
a) Na
a) Li
a) Mg
4. Степень окисления щелочных металлов
a) +2
a) +1
a) +3
a) +4


Выберите свойства характерные для щелочных металлов
А) не взаимодейсвуют с кислородом
Б) в соединениях проявляют переменную степень окисления
В) быстро окисляются
Г) имеют металлическую кристаллическую решетку
Д) при взаимодействии с водой образуют щелочи
Е) хорошие окислители
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
