Получение металлического натрия в домашних условиях
Обновлено: 05.10.2024
Получение металлического калия (натрия) в домашних условиях.
Калий. Это действительно исключительный элемент. Металл, который при соприкосновении с водой разлагает ее, а образовавшийся водород воспламеняется. Наверняка удивительное зрелище, — эти мысли не давали Фридриху (Вёлеру, здесь и далее мои примеч.) покоя. Он решил, во что бы то ни стало получить металл.
Калоян Манолов Великие Химики
Калий, являющийся одним из самых активных металлов, желанная мечта многих начинающих химиков. Реакция его с водой действительно один из самых красивых и в тоже время простых химических опытов. Несмотря на доступные фото и видео экспериментов ничто не заменит непосредственного созерцания синеватых кусочков калия и опытов с ним.
Отсутствие простой методики получения, доступной школьнику, неослабевающий интерес посетителей форумов к этой теме, а также несправедливое запрещение работы с калием в школе навело на мысль разработать доступную всем методику получения.
П озволю себе несколько слов об опасности калия, хотя это всем известно. Это, однако, не означает, что не стоит браться за опыты, просто соблюдайте ТБ и уважительно относитесь к этому агрессивному металлу. Главное беречь глаза и работать в защитных очках! При реакции с водой или другими веществами реакция идёт обычно очень бурно, с «взрывом». Образуются разлетающиеся едкие брызги! Калий и другие щелочные металлы берут пинцетом. Помните о пожароопасных свойствах металла. Об опытах же и его свойствах исчерпывающе сказано на форуме в теме «щёлочные металлы» и видеоархиве журнала. Единственное, что хотелось бы добавить - металл может получаться с загрязнённой поверхностью, многим опытам это не мешает, можно срезать корочку, обнажив чистую поверхность металла, делать это лучше под слоем керосина. Если этого не сделать, в воде после реакции образуется нерастворимая взвесь. На фото один из первых опытов с загрязнённым металлом. В улучшенной версии прибора чистота калия выше и подобного не получалось, вода оставалась прозрачной.
Ещё в годы учёбы в университете мне попадалась интересная книга - А. И. Беляев
Николай Николаевич Бекетов - выдающийся русский физико-химик и металлург.
Вот выдержка из докторской диссертации Н. Н. Бекетова (1865), приведённая в книге:
«Если глиний (так раньше называли алюминий) восстановляет барий из окиси, то можно было ожидать и подобного действия его на окись калия: я произвел опыт в изогнутом ружейном стволе, в закрытый конец которого были положены куски едкого кали и глиния; при довольно высокой температуре показались пары калия, большая часть которых сгущалась в холодной части ствола, из которой я добыл несколько кусочков мягкого металла, плавающего на воде и горящего фиолетовым пламенем, имеющего, одним словом, все характерные свойства чистого металлического калия. В большом виде я этого опыта не повторял, а может быть он окажется удобным для практики, так как цена глиния невысока, а восстановление идет, по-видимому, гораздо легче и при низшей температуре, чем восстановление калия железом».
Это очень меня заинтересовало, т.к. другие химические способы восстановления требуют более высокой температуры, по описаниям «белокалильного жара» или порядка 1100 ° С, трудно достижимой в быту, а электролиз расплава едкого кали хотя и возможен, но, намного более трудоёмок (о электролизе едкого калия и недостатках этого метода подробно описано в монографии Алабышева Натрий и калий)
Применив подобный способ к гидрооксиду рубидия с помощью простейшего прибора Бекетов, добился довольно высокого выхода металла.
«3 (15) марта 1888 года на заседании Отделения химии Русского физико-химического общества в Петербурге н. н. Бекетов сообщил, что ему удалось получить металлический рубидий восстановлением гидрата окиси рубидия металлическим алюминием. По этому поводу Н. Н. Бекетов сказал: «Редкость материала и невозможность приобрести путем покупки сколько-нибудь значительное количество металла заставили меня искать более удобного способа получения рубидия из его соединений, так как способ, употребленный Бунзеном (прокаливание с сажею кислого виннокислого рубидия), дал ему 18% заключенного в соли металла, не говоря уже о других неудобствах этого способа. С этой целью я применил к рубидию способ, к которому я пришел по чисто теоретическим соображениям много лет тому назад (1859), а именно действие алюминия на гидрат. Способ этот был уже много изучен по отношению к едкому кали; оказалось, что при действии алюминия можно выделить максимум около половины металла, но всегда несколько менее, так как, по-видимому, половина окиси остается в соединении с окисью алюминия. По моим соображениям рубидий должен был также легко выделяться алюминием; это оправдалось на деле, и я уже несколько раз приготовлял, таким образом, сравнительно большие количества металла — от 31 до 27 г за раз. Реакция производится в железном цилиндре с железной же газопроводною трубкою, которая соединена со стеклянным резервуаром. Цилиндр в стоячем положении нагревался в газовой печи до ярко-красного каления; реакция идет сначала быстро с большим отделением газа (водорода, образующегося по реакции. - А. Б.), но затем замедляется и рубидий гонится постепенно, стекая, как ртуть, и сохраняя даже свой металлический блеск вследствие того, что весь снаряд во время операции наполнен водородом. Приведенное количество металла получалось в 3/4 часа, если не был взят избыток алюминия, который вероятно дает с рубидием сплав, почему последние части щелочного металла перегоняются с трудом».
В первом опыте я нагрел газовой горелкой сифонный баллончик с газоотводной трубкой из жести, соединённой со стеклянным приёмником. Внутри было 5,0 г. гидрооксида калия и 1,2 г. кусочков алюминия. При нагревании до оранжево-жёлтого каления внезапно появилось фиолетовое пламя. Горел выделяющийся водород с примесью паров калия. После охлаждения и заглянул внутрь трубки. Просвет был заметно уже. Тогда я бросил её в банку с водой. Раздался хлопок и из трубки вылетел небольшой фонтан пламени. Это означало, что калий удалось получить, и он конденсируется внутри трубки, не стекая в сосуд приёмник.
Нам потребуются алюминий и едкое кали. С алюминием нет никаких проблем, просто наточите напильником опилок. В качестве источника чистого алюминия удобен кусок электропровода или старой посуды.
С гидрооксидом калия дело сложнее. Это вещество в быту, подобно едкому натру не применяется, но его довольно легко достать. Нужно либо попросить его в учебном заведении или купить. Помимо магазинов химреактивов он продаётся в некоторых радиотехнических магазинах. Я просто попросил его у коллег.
Он оправдывает своё название исключительно сильным разъедающим действием на кожу, боле сильным, чем действие кислот. Очень опасно попадание даже малейших крупинок в глаза. Это приводит, по крайней мере, к тяжёлому повреждению зрения или полной слепоте. Работать с ним нужно обязательно в защитных очках! Рекомендуются резиновые перчатки. На открытом воздухе он должен находиться минимальное время, из-за сильной гигроскопичности. Вот ещё одна ложка дёгтя – реактив выпускают не в виде безводного вещества, а в виде смеси, содержащей гидрат. Если Вы её нагреете с алюминием, она расплавится в кристаллизационной воде и прореагирует с алюминием, подобно водному раствору.
Вот что написано в ГОСТе, описывающем качество реактива.
Как видно из таблицы, в лучшем случае, щёлочь содержит 13% воды! Нам понадобится безводный препарат. Нужно прокалить едкое кали в чашке из нержавеющей стали (в крайнем случае, железной посуде). Учитывайте, при испарении воды во все стороны разлетаются брызги щёлочи! Выпаривать нужно в вытяжном шкафу или на открытом воздухе, предусмотрев меры предосторожности. Вначале чешуйки плавятся, раствор кипит, постепенно кипение прекращается и образуется расплав со спокойной поверхностью. Температура плавления гидрооксида калия - 380 С. Я просто поставил ч Не допускайте попадания воды на расплав! Образуется едкий аэрозоль. (Проверено мной, когда я налил воды в чашку со следами плава)
Т Осторожно во все стороны отлетают кусочки щёлочи!
Получившаяся щёлочь загрязнена продуктами коррозии стали, но это не страшно и на результаты нашего опыта не повлияет.
Чтобы раздробить едкое кали для реакции восстановления поступайте так – в хлопчатобумажную салфетку в несколько слоёв завёртываем куски и ударами молотка на прочном основании (я использовал отрезок рельсы) дробим. Затем быстро разворачиваем над газетой и ссыпаем в пузырёк, в котором она до этого хранилась. Щёлочь должна быть предварительно взвешена в закрытом пузырьке, перекладываем её возможно быстрее. Удобно для этого использовать газету. Края крышки для дополнительной герметичности можно промазать пластилином.
Бекетов использовал изогнутую железную трубку (ружейный ствол). Проведённый мной опыт показал неудобства данного варианта, я не советую его делать.
Вначале я использовал 12-г сифонный баллончик с отводом - импровизированная реторта. В него нужно поместить максимум около 6,0 г. щелочи и 1,5 г. опилок алюминия. Большее количество использовать не нужно, из-за бурной реакции, сопровождаемой выделением больших количеств водорода:
НПосле начала нагрева начинается реакция – выходящий из «приёмника» водород с парами калия
самовоспламеняется и горит фиолетовым пламенем. Если этого не произошло, реакция не началась, продолжайте греть сильнее. При этом образуется едкий аэрозоль! Делать под тягой или на воздухе! «Приёмник» - пробирка неплотно заткнут стеклотканью (можно использовать другой негорючий материал). Но внутрь его калий не потечёт. Основная часть металла сконденсируется в средней части трубки. Просвет постепенно сужается, давление возрастает и появляется небольшое пламя возле стыка трубки с баллончиком. Я продолжал нагревать 5 минут, опыт показал, что внутри остался непрореагировавший алюминий, нагревать лучше подольше, наверное, минут 10-15. После охлаждения быстро вскрываем ножницами и пассатижами трубку. Делаем всё в защитных очках, под тягой или на открытом воздухе. Маленькие кусочки калия пирофорны! Я подстелил газету, чтобы было удобнее, она не воспламенилась. Но нужно предусмотреть эту возможность. Кусочки калия поддеваем пинцетом и сразу помещаем в пузырёк с керосином. Для глаз кусочки калия очень опасны! Получилось менее грамма (где-то 0,4-0,5г) загрязнённого с поверхности металла. Однако такой вариант меня не удовлетворил. «Прибор» был крайне примитивен, и доставать калий было неудобно, я продолжил улучшать «установку».
Как известно в XӀX веке калий получали полукустарным способом, нагревая поташ с углём и мелом. При этом использовался приёмник Донни и Мареска, позволяющий быстро охлаждать пары металла и не допускать окисления. Вот иллюстрация из словаря Брокгауза и Ефрона. В самодувном горне нагревается до белого каления железный сосуд с реакционной смесью. Пары металла быстро охлаждаются, конденсируются, и образующийся угарный газ защищает его от окисления.
П Горло немного сошлифовано наждачной бумагой. Оно должно с трением входить в реакционный сосуд из 12-г баллончика. Жесть вставляется на тонкий слой гипса, им же изнутри подмазан шов, благодаря чему достигается герметичность. В правой половине в дне просверлено небольшое отверстие в 2 мм. Жесть используется от консервной банки сгущённого молока, размеры 50*85 мм. С помощью пассатиж, натягивая края и заворачивая шов, удаётся обеспечить плотное прилегание, почти без зазора.
«Печь» осталась та же, банка с отверстиями. Крышку можно не использовать, особой роли она не сыграет. Заранее отшлифуйте гвоздь, чтобы он плотно закрывал отверстие в дне баллончика и сделайте шпатель из той же жести, чтобы им счищать калий. (см. фото ниже) Шпатель должен повторять округлую форму стенок.
Теперь о проведении опыта. Как я уже говорил, реакция сопровождается образованием аэрозоля щёлочи, делайте всё под вытяжкой или на открытом воздухе.
Теперь аккуратно наворачиваем влажную вату на жесть, отступив от краёв 5-8 мм, закрепляем её тонкой проволокой.
Вначале удаляем гвоздь-затычку. Затем понемногу прогреваем баллончик горелкой (можно из экономии пользоваться паяльной лампой). Я использовал бутановый баллончик и большую горелку-насадку, упомянутую выше. Газ внутри баллона охлаждается, и пламя немного уменьшается, согревайте баллончик рукой. Следите, чтобы половина «реторты» была нагрета до оранжевого каления, горло холодильника должно быть нагрето до начала красного каления. Грейте около 13-14 минут. Реакция вначале сопровождается появлением фиолетового пламени, выходящего из холодильника, потом оно постепенно уменьшается и пропадает, тогда можно уменьшить отверстие неплотно и с зазором вставив гвоздь. В ходе реакции понемногу смачивайте вату пипеткой, не допуская попадания воды на стыки.
Прекратив нагрев, плотно вставьте затычку. Дайте прибору остыть до комнатной температуры! Я просто вынес его на мороз. Затем удаляем вату, и стираем следы воды.
Заранее подготовьте место, где будете выскребать калий из приёмника. Помните об опасности возгорания! У Вас должен быть бензин, пинцет, самодельный шпатель-скребок, емкость для хранения калия с инертным растворителем, вроде керосина или масла. Желательно, чтобы оно было высушено. Соскребаем гипс и разнимаем холодильник. Сразу на горло холодильника надеваем кусок полиэтилена и придавливаем его пластилином или заранее сделайте пробочку. Размыкаем половинки холодильника, основная часть калия сконденсировалась в левой части, внутри правой были лишь следы. В левую часть наливаете бензин (я использовал гексан) Делается это для защиты металла от окисления и бензин использован, т.к. потом он испарится бесследно, и можно будет опять использовать холодильник, не нарушая гипсовую замазку. Делаем всю операцию в защитных очках!
Ш пателем выскребаем металл со всех сторон, потом пинцетом помещаем его в емкость для хранения. Помните, маленькие стружки калия окисляются на воздухе так быстро, что могут воспламениться. Это легко увидеть, если тщательно расплющить ножом обсушенный кусочек калия на куске бумаги (лучше фильтровальной или туалетной), что обычно сопровождается её воспламенением. Часть металла получится в виде небольших стружек и крупинок. Их можно собрать смыв бензином в ёмкость для хранения или сухой стаканчик. Они пригодятся для реакции с водой, даже небольшие крупинки горят красивыми фиолетовыми огоньками. У меня получилось (вернее я собрал в бюкс) около 1,1 г калия (0,7-0,8 г в виде компактной массы). Всего было где-то 1,3 г. Часть металла в виде остатков я собирать не стал, промокнул бумагой от гексана и пинцетом побросал в воду (удобно просто стряхивать крупинки с бумаги). После реакции нужно удалить следы металла с холодильника, правую половину просто бросьте в воду, на вытянутой руке и сразу отойдите. Левая половина пусть полежит на воздухе, и следы калия частично окислятся, удалите потом их, не повредив гипсовой замазки с помощью влажной ваты на проволоке (осторожно, не направляйте отверстие на себя) и затем промыв пипеткой и просушив салфеткой. Реакционный сосуд тщательно промойте водой и высушите. Вот что получилось после опыта:
Ш Конечно, металла получится немного, но для большинства опытов этого достаточно. Об опытах смотрите на сайте журнала Химия и Химики, строго соблюдайте меры предосторожности, иначе можете ослепнуть! Можно повторить несколько циклов получения.
Юные химики, заинтересованные, в получении натрия могут попробовать получить его в небольшом масштабе, описанным выше для калия, способом. Процесс (как и меры предосторожности) должны быть аналогичными. Температура кипения натрия 883 °С (калия 761 °С), он должен перегнаться. Не всегда его можно извлечь из клапанов или попросить в школе. Понятно, что эта проблема лишь для начинающих юных химиков. Гидрооксид натрия более доступен и содержит меньше влаги. Восстановление алюминием идёт легче (в момент выделения водорода в случае гидрооксида калия реакционная смесь несколько разогревается), чем использовавшаяся в 19 веке реакция соды с углём. Она требует температуры 1100 С, по данным книги Натрий Свойства, производство, применение/А. Г. Морачевский. По другим источникам "белокалильного жара", достичь которого сложно. (Основы химии Менделеева) Баллончик-реактор выдержит довольно много циклов восстановления, более 5.
Для загрузки следует брать около 5,0 гидрооксида натрия и 1,7 г. опилок алюминия.
ПриложениеЕсли кому интересно, вот первоначальная, несовершенная версия «прибора», использованная в первых опытах
К З
Вставки из F-разъёмов должны быть плотно охвачены жестью, следует немного подмазать их перед вставкой гипсом или глиной для герметичности и просушить. Полученная трубка вполне герметична и вставки не должны расплавиться.
Получаем натрий из ВОДНОГО раствора
Как всем известно (ну тем, кто учил химию) получить щелочные металлы из водных растворов невозможно. По крайней мере так учат в школе. Речь идёт об электролитическом методе.
При этом в продолжении темы рассказывают об электролизе расплавов щелочей, из которых всё же можно выделить щелочные металлы в виде металлов.
В видео ниже вы увидите, как буквально на коленке можно организовать процесс электролиза расплава щелочей и получить металлический натрий. (готовьте салфетки, чтобы подтирать кровь из глаз)
А также продемонстрирован лайфхак, как получить щелочные металлы их ВОДНЫХ растворов их солей.

1.3K пост 11.3K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
Неужели все только для визуалов?(
С удовольствием бы почитал текст…
Во, только вчера на ютубе смотрел. А вот про опыт с лампочкой было б прикольно снять.
Надо чем-то увлечь людей, я бы кучу разных опытов, или поэпичней тиктокеров всяких замутил)
Всегда с интересом смотрю выпуски)
Термоусадку на гвозде лучше усаживать верхней частью пламени зажигалки, а не средней.
Меня вот какая штука интересует.
В одной из технологий оксидирования используется кипящий насыщенный раствор едкого натра.
Состав раствора примерно таков :
Дистиллированной воды 100г;
едкого натра 62г;
натриевой силитры 12г;
Вопрос заключается вот в чем.
Читая о технике безопасности работы с едким натром, нигде не видел упоминания о испарениях его растворов.
Вроде бы и очевидно, что пары щелочного раствора весьма ядовиты, но хотелось бы более полного ответа от компетентного человека.
Таким образом можно и аммоний получить электролизом, в виде амальгамы. Правда, при попытке выделить его из амальгамы аммоний немедленно разваливается.

На ноль делить нельзя. Можно найти предел отношения величин, когда одна из них стремится к нулю. :)
А не покажете опыт ( подробностей не помню, читал только в журнале) про электролиз натрия в расплаве - когда в расплав ( вроде бы селитры) макают включенную электролампочку. Ну и вариант с калием тоже хотелось бы.
а как бы нахуа? оно клорадского жука убивает или сорняки убивает? кака полза практическая?
мб унитаз не пачкается при применении этих ваших ВОДНЫХ растворов?
как популяризировать науку?
что бы то - то надо натрий! Йоу ! а где взять? и погнал

Научное открытие


Зависимость от соцсетей
Для трех подписчиков.)
Каждый раз когда человек открывает смартфон и влетает на ютуб, пикабу, тикток, он получает мощнейший выброс дофамина. Многие считают, что дофамин это гормон счастья. Однако это уже давно не так. Дофамин - нейромедиатор который побуждает нас к получению удовольствия. Но это не само удовольствие/счастье/кайф. Именно этот нейромедиатор заставляет нас листать ленту круглые сутки, сейчас поясню подробнее.
Тысячи лет назад, в "пещерные" времена дофамин играл особую роль в построении жизни. Идешь по лесу, увидел съедобные ягоды, получи дофаминчика (побуждает к действию), собери ягоды, не умри с голода(кайф).
Пришло дружественное племя? Держи дофамина (иди поговори, узнай про хищников). Узнал, что в соседней саванне развелось много гепардов? Не иди туда, иди лучше туда где по рассказам много свиней (поел, не умер с голоду, семья цела, все хорошо).
Увидел у вражеского племени новую технологию (копье)? Держи дофамина (убей, забери копье), изучи новую технологию. Стань SWAG в своей пещере.
Плохая новость - мы попали в ловушку наших "инстинктов". Нам кажется, что пожар в Австралии, фотки моделей или друзей в инсте, новые посты в паблике Science, невероятно важны. Однако возникает вопрос, как давно вы применяли эти знания на практике? Эта информация мертвым грузом оседает в голове, не неся за собой практической пользы.
Но самое страшное - дальше.
"Ну залипаем мы в телефоне, ну и че? Два - три часа в день, ничего страшного с дофаминовой системой не произойдет, дай отдохнуть после работы."
А теперь смотри сюда.
У НАС ВСЕГО ОДНА СИСТЕМА ПОБУЖДЕНИЯ - дофаминовая.
Рецепторы дофамина можно сравнить со вкусовыми рецепторами. Чем больше дофамина ты получаешь, тем больше дофамина тебе нужно. Твоего дофамина тупо не хватит на то, чтобы прочитать книгу(результат будет не скоро), открыть бизнес, переехать в другую страну. Для этого тебе потребуется энергия и мотивация, каждый, сука, день. Но мотивации уже нет, твои рецепторы уже сожженны в соцсетях. Дофамина на спорт, образование, и иногда даже для поиска сексуального партнера, не остается.
Причина по которой я прекратил использовать смартфон - Тикток.
Алгоритмы хорошо подобрали для меня контент, все что нужно - психология, саморазвитие, спорт, мотивация, нейробиология. Господи, это именно то, что мне нужно - удобный, быстрый формат, возможность сохранять видео. Как будто Эльдорадо от мира информации. Но вот прошло 2 месяца, в сохраненные я не захожу, лишь продолжаю листать ролик за роликом с мыслью "Йоу, ты же не фигню смотришь, полезный, развивающий контент" и не замечаю, как я постепенно тупею, не могу сконцентрованно прочитать 10 страниц Канемана, речь становится хуже. И боюсь Пикабу, Ютуб, и даже Хабр, работают на этом принципе. Для большей части людей эта информация - мусор.
Каждый раз когда вижу маленьких детей залипаюих в смартфон становится не по себе.
К последним новостям мира науки
Один из крупнейших научных издательских домов Elsevier начал отправлять рецензентам анкеты с вопросами о. гендерной и расовой принадлежности.
Делается это, по словам редакции «для поддержки инклюзивности науки». В частности, инклюзивность решили внезапно поддержать в таких журналах, как Chemical engineering journal и Journal of Alloys and Compounds (само собой, никоим образом не связанных с исследованиями гендерных и расовых вопросов)


Кроме того, забавно видеть от научного издательства постановку вопроса «Каким бы расовым термином вы бы себя определили?»
И далее идёт перечисление «рас»:
Азиаты или жители Океании
Черные
Испанцы или латиноамериканцы
Коренные народы (североамериканские индейцы, южноамериканские индейцы и т.п.)
Ближневосточные или североафриканские жители
Белые
Собственное описание
Толерантность, инклюзивность и всё такое — это, конечно, хорошо, однако расоведение (раздел антропологии, изучающий человеческие расы) выделяет всего четыре расы человека (европеоидная, монголоидная, негроидная, австралоидная) и десятки малых антропологических типов. В списке же намешаны расы, народы, языковые группы и даже возможность самоопределить себя в отдельную расу.
Извините, другой науки у нас для вас нет 🌚
Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
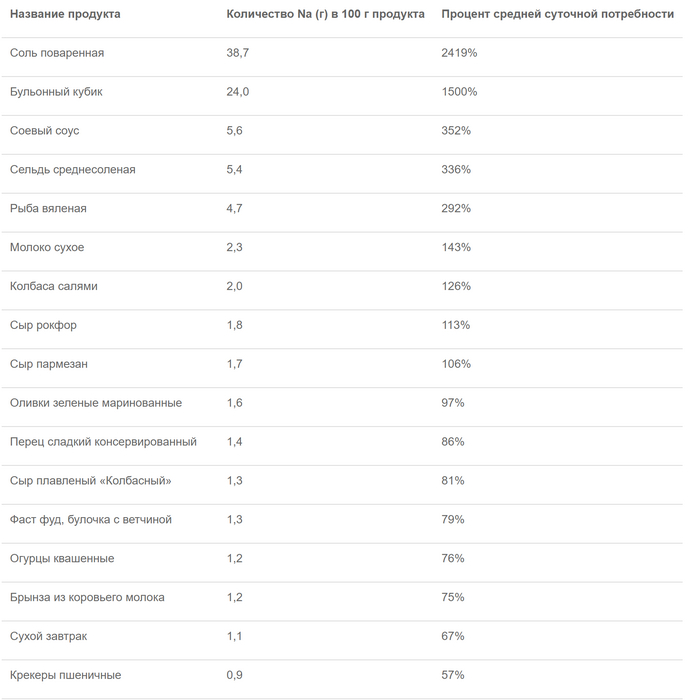
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
Получение металлического натрия из средства для чистки труб! (Для химиков-энтузиастов)
Средство для чистки труб "Крот" - это раствор щелочи очень грязной щелочи.Можно ли получить чистый металлический натрий из этого раствора? Оказывается можно)))
В школе я с огромным интересом наблюдал за тем, как реагируют щелочные металлы с водой и мне всегда хотелось самостоятельно поэкспериментировать с такими веществами))
Если вас тоже завораживал металл плавающий по воде и выделяющий водород, то, наверное, вам будет интересно это видео)

Отлично. Теперь ждём "Кокаин из поваренной соли", "Виски из куриных потрошков" и другие полезные рецепты!
Именно таким образом сэр Хемфри Дэви и открыл натрий. Электролиз раствора едкого натра.
ну всё, теперь можешь пускаться во все тяжкие))
А, что еще можно сделать из крота?
Кстати, вопросик есть: Эта адская жидкость(крот имею ввиду) дюраль разъедает?

Занимательные опыты по химии








Был бы у меня такой учитель

Ответ BabudaiAga в «Б - Баланс»
Если кого-то интересует проверка баланса своих кубиков - есть хороший способ без проведения 10000 бросков. Правда, это легко сделать только для пластиковых кубиков.
Для этого делается очень крутой солевой раствор. В простой воде кубик тонет, поэтому нужно воду сильно просолить, повысив ее плотность до того момента, что бы кубик плавал. После чего кубик кидается в этот раствор.
Куб находится во взвешенном состоянии, почти в невесомости, поэтому, если какая-то из граней перевешивает (кубик не сбалансирован), эта грань всегда будет тонуть - кубик проворачивается этой гранью вниз. И это легко увидеть, если попробовать чуть покрутить плавающий кубик пальцем. Сбалансированный куб держится любой гранью вверх, несбалансированный постоянно проворачивается в одно и то же положение. И скорость проворота в это положение показывает насколько куб несбалансирован.
Я так свои д20 кубы для настолок все проверял. Это намного быстрее и нагляднее, чем совершать 10000 бросков =)
Но с металлическими способ не канает. Ну, конечно, если у вас нет плошки с ртутью, что бы купать кубики в ней. =)
Продолжение поста «Б - Баланс»
Я уже говорил тебе, что такое безумие? Безумие — это точное повторение одного и того же действия, раз за разом, в надежде на изменение. Это и есть безумие.
(с) Ваас Монтенегро
По просьбам в комментариях под прошлым постом продолжаем тему баланса игровых костей.
Для ЛЛ: 10 000 бросков кубиков с Ozon. Потом ещё столько же бросков кубиков из магазина настолок. Потом четыре онлайн-генераторов кубов, тоже по 10 к роллов для каждого. Подведение итогов.
Объект исследования:
1) кубики из магазина настольных игр, набор 10 штук (250 р набор, по 25 р каждый);
2) самые дешёвые кубики от Ozon, набор 8 шт (на момент заказа 104 р, т.е. по 13 р каждый);
3) результаты генераторов: этого, этого, этого и вот этого (бесплатно, разумеется).
Как бросал: чтобы исключить влияние оператора, из говна и палок плотного картона сделал dice tower (благо, схему в интернете найти легко). Фотографировать этот шедевр орочьей инженерии, с вашего позволения, не буду: свою функцию выполняет, при бросках не деформируется, но выглядит неказисто.
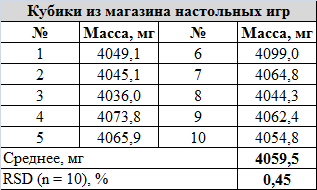
Кубики из магазина настолок: розового цвета, "для няшных варгеймов", как сказано на сайте. Не думаю, что со своими патлами и бородой я соответствую критериям няшности, но уж какие были в наличии. Размер: стандартные 16 мм. Материал: написано, что нефрит. Грани и углы хорошо сглажены: кубик катится долго, делая на столе не менее 5-6 оборотов. Матрица - правосторонняя. Материал не выглядит совершенно однородным, на гранях присутствует градиент цвета. Размер точек не отличается, сами точки залиты белой краской ниже уровня грани. Внешний вид:

Сравнение массы кубиков в наборе:
Кубики с Озона: меньше стандартных, всего 12 мм. 8 штук в наборе. Материал - АБС-пластик. Прозрачные, точки заглублены и маркированы красной, жёлтой и синей краской. Кубики, кажется, пытались сбалансировать: точка на грани 1 крупнее и глубже остальных. В толще материала 3 из 8 кубов имеют маленькие (менее 1 мм) пузырьки воздуха. Кубики с этим дефектом не исключал из выборки: проверим то, что пришло, "as is", никто ведь не будет рассматривать их так пристально во время игры. Грани и углы сглажены, куб катится хорошо. Матрица тоже правосторонняя. Внешний вид:

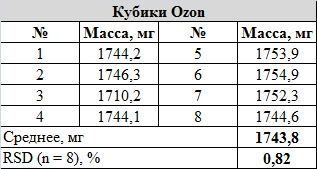
Т.к. в обоих случаях масса кубиков в наборе очень близка, принял решение кидать кубики каждого типа вместе, по 10 и 8 штук, для ускорения набора статистики. Иначе, думаю, к концу эксперимента кукушечка у меня отлетела бы окончательно.
Выгоняем котов (очень уж им хотелось присоединиться к новой весёлой игре) и начинаем. Результаты - в этом файле Excel (Яндекс.Диск). Далее для наглядности полученные результаты отнесены к "идеальным" 16,67% (1/6, столбец "Δ от нормы"). Для оценки полученных результатов использовал, как предложил уважаемый @fakir22, критерий хи-квадрат, только расчёт выполнил через функцию ХИ2ТЕСТ.
Результаты бросков для кубиков из магазина настолок:
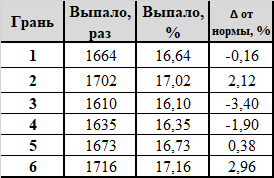
Максимальное отклонение от оптимального значения составило 3,40% (напомню, для кастомного кубика из предыдущего поста грань 6 выпадала на 9,74% чаще, а 1 - на 5,80% реже "положенного"). Для числа выпадений каждой грани RSD (n=6) 2,39%, χ^2 = 0,4451: опровергнуть гипотезу равной вероятности граней 1-6 не удалось.
Вытираем скупую мужскую слезу пот со лба, берём в руки кубики с Озона и бросаем их. правильно, ещё 10 000 раз. За окном уже брезжит рассвет и матерятся дворники. Результаты:
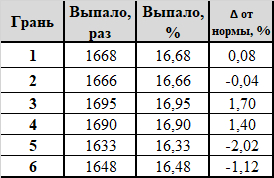
Признаться, я был удивлён. Самые дешёвые кубики, от которых не ждёшь никаких сюрпризов, показали весьма достойные результаты: RSD (n=6) 1,43%, χ^2 = 0,8891: очень. нет, ОЧЕНЬ хорошо. Очевидно, доказать неравновесность кубиков тоже не удалось. Кубики, по итогу, унёс на работу и раздарил коллегам (- Мужик, у тебя кубик есть? На, мужик, кубик).
В прошлый раз я сказал, что для нивелирования неравновесности физических дайсов стоит использовать онлайн-генераторы кубов. Чтобы не быть голословным, проверил четыре таких сайта из топа поисковика (те, что показывали полную выдачу по каждому "роллу": к этому моменту вносить результаты по одной цифре я был уже не в состоянии). Для каждого сайта делаем ещё по 10 000 "бросков" и переносим результаты в эксель.
Пикабу образовательный: теперь я знаю о возможности рассортировать данные из одной ячейки через опцию "Данные" - "Текст по столбцам" (может быть, кому-то пригодится). Полные результаты в расчётном файле по ссылке выше. Чтобы не растягивать, приведу только сводную таблицу (не реклама):
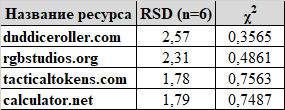
Т.о., все эти сайты дают правдоподобную картину случайного распределения результатов ролла.
Подведём итоги.
1) Если грани кубиков не имеют очевидных различий, скорее всего, распределение результатов ролла будет близко к нормальному (КАПИТАН ОЧЕВИДНОСТЬ, чёрт побери). Цена тут, вероятно, вторична.
2) При выборе кастомных костей надо быть очень осторожным. Некоторые мастера отдают предпочтение внешнему виду, по каким-то причинам (сложность ли производства, банальное попустительство или что-то ещё) забывая о балансе своих изделий.
3) Онлайн-генераторы (по крайней мере те, что я навскидку рассмотрел) дают вполне достоверную картину распределения вероятности выпадения костей. Но, разумеется, кому-то (мне, например) нравится момент бросания кубиков, в этом есть своя романтика.
Напоследок пара слов уважаемому (без сарказма) @cyberdicegames. Я ни в коем случае не ставлю под сомнение Ваше мастерство: безусловно, и кости и, особенно, коллекционные фигурки выглядят очень здорово, и я с интересом буду в дальнейшем следить за Вашими публикациями. Однако. Как там было сказано? Цитирую (орфография сохранена):
. когда мне пишут люди про баланс моих дайсов, обладая только теорией, (что у вас тут вырез на одной грани больше чем на другой и я УВЕРЕН ваши кубики НЕБАЛАНСНЫ), меня это всегда вызывает улыбку. все эти громкие заявления - пальца выделенного не стоят. . все эти люди, кто так яро выражали своё мнение про баланс - имели в своих коллекциях огромное количество дайсов просто с ужасным балансом.
Пальца выделенного, мда. Ну что же, вот я из интереса потратил своё время и теперь обладаю не только теорией, но и кучей практики (даже больше, чем хотелось бы). Самые дешёвые кубики, купленные на Озоне и в первом попавшемся магазине настолок, оказались сбалансироваными. Случайные онлайн-генераторы кубов - тоже выдают адекватные результаты. Но баланс как минимум некоторых моделей Ваших кубов, которые стоят в 69 (. ) раз дороже и которые Вы, по сути, рекламируете своими постами на Пикабу, объективно оставляет желать лучшего. Стильная, красивая, дорогая. игрушка.
Буду рад, если Вы аргументированно меня переубедите. Агрессивно отстаивая баланс своих дайсов, Вы раз за разом показываете кубик, насечки на гранях которого имеют равную длину (даже сделали, как я посмотрю, новую подпись к фото: "Perfect! Balanced Dice"). Вот только никто с этим и не спорил: например, ещё больше двух недель назад я говорил, что к этому кубику меньше всего вопросов. И даже Ваш эксперимент это подтверждает. Сомнения вызвали кубы с визуально различающейся длиной выточек, но все неудобные вопросы о них Вы игнорируете, приводите эмоциональные доводы без конкретных цифр или переходите на личности.
Вы заявляете: "самым важным элементом в моей работе является - качество", но отмахиваетесь от критики (я хотел, чтобы мои замечания были максимально обоснованными и конструктивными, сделав в общей сложности 30 000 физических роллов и 40 000 виртуальных): "мне не интересно доказывать элементарные вещи, которые каждый сам может осознать" и т.п. Это звучит инфантильно и непрофессионально.
Приглашаются: @arrraarrra (вопрос о виртуальных дайсах), @Deha4444, @ghostabv, @Whateveryouwish, @KAKAOCMETAHA, @dildus, @arigatan и остальные, спрашивавшие про баланс магазинных кубов.
Форум химиков
Вижу будущее: способы получения натрия в домашних условиях будут открыты в 2009. А пока довольствуются старыми, проверенными методами типа "стырить из школы".
Я гдето читал что его можно получить опустив в расплавленную натриевую селитру горящую лампочку,изнутри она покрывается натрием
himik2009 писал(а): Я гдето читал что его можно получить опустив в расплавленную натриевую селитру горящую лампочку,изнутри она покрывается натрием
Срочно патентуйте, батенька, а то в промышленности мучаются с электролизом, а тут вот он простой и недорогой способ, и главное натрий сам в колбу лезет прям через стекло. Представьте, как здорово, можно наладить производство крышек с электродами как у лампочки - накручиваешь ее на лабораторную банку какую-нибудь, заполняешь ее аргоном, опускаешь в расплавленную селитру и натрий сам в банку собирается, осталось только этикетку приклеить.
ну вообще она таки покрываеца натрием, только наверное долями милиграмма, проще уж лампочку от уличного фонаря натриевую раскурочить
а вообще получить не так уж и сложно, азид натрия разложить к примеру
Уж легче натрий спионерить где там в школе, азида раздобыть
Методика получения азида удалена, ни к чему это . amik
Это "электролиз сквозь стекло". Лампочка в качастве катода в расплавленной селитре. Спираль - эмиттер электронов, натрий восстанавливается на внутренней стороне колбы.
Сам не делал - читал.
З.Ы. Бурное ехидство в обсуждении ИМХО необоснованно.
таки лезет За счет достаточной ионной проводимости стекла при температуре расплава соли.
Тоже что-то "краем уха" про это слышал, хотя это просто красивый демонстрационный опыт, который наверняка непросто воспроизвести. Вот только, что должен представлять из себя катод - это вопрос. Если приложить напряжение к цоколю, то ничто не заставит металл выделяться внутри колбы.
в виде гипотезы предположу, что нужно напряжение порядка киловольтов, на частотах в десятки килогерц, естесственно выпрямленное (т.е. не синусоида, а "горбушки"). Катодом будет нить лампочки, анод в расплаве. Т.е. получается что-то вроде "изолированного электрода", как в озонаторе. Тогда, имхо, метал отложится внутри на стенке колбы.
disclaimer : аффтару топика : не пробуйте с этим экспериментировать без должной подготовки и лучше завяжите с натрием дома. Если уж так нетерпится попробовать свои силы в электрохимии расплавов, попробуйте получить магний из солевого расплава, так как это описано у славных Гроссе и Вайсмантеля. Это менее опасно.
Опоздал со своим постом
спасибо за источник
еще вроде как-то можно получить прокаливанием гидроксида натрия и порошка железа только вроде температура нужна высокая
К вопросу о том, как легко попасть в антихимию. я вот не знал такой фишки, а подано так, что смешно.
жгут, взаправду жгут.
И еще один, не вполне обычный опыт с электрической лампочкой, но не с большой, а от карманного фонаря. Укрепите ее в полоске жести, согнутой под прямым углом, и вставьте полоску в небольшой химический стакан так, чтобы стеклянный баллон лампочки оказался внутри стакана и был обращен к его дну. Подключите лампочку к батарейке: выступ на цоколе, самый крайний его участок соедините с отрицательным полюсом, а полоску жести - с положительным. Обратите внимание: припаивать проводники нельзя, потому что во время опыта припой может расплавиться. Надо придумать механический контакт или же использовать патрон от старого карманного фонаря.
До начала опыта выньте лампу из стакана и насыпьте в него нитрат натрия (нитрат калия в этом случае не годится; почему - станет ясно позже). Поставьте стакан на асбестовую сетку или металлическую пластинку и нагрейте его на пламени газовой горелки или спиртовки; сухой спирт не очень удобен, так как трудно регулировать температуру расплава. Селитра плавится при 309 оС, а при 390 оС уже разлагается; вот в таком интервале и придется поддерживать температуру. Для этого изменяйте либо размер пламени, либо расстояние до стакана. Следите, чтобы расплав не застывал, даже с поверхности.
В расплавленную селитру осторожно опустите лампочку. Большая часть стеклянного баллона должна быть погружена в расплав, но следите за тем, чтобы верхняя часть цоколя, к которой припаян проводник, не соприкоснулась с селитрой - произойдет короткое замыкание. Зажженную лампочку подержите в селитре около часа, потом отключите ток, погасите горелку и аккуратно доставьте лампочку. Когда она остынет, промойте ее водой, и вы увидите, что лампочка изнутри покрыта зеркальным слоем!
Мы уже говорили, что при нагревании заряженные частицы в стекле приобретают подвижность (поэтому и зажглась лампа, когда трубку нагревали спичкой). Главные действующие лица - ионы натрия: уже при температуре выше 300 оС они становятся достаточно подвижными. Само стекло остается при этом совершенно твердым.
Когда вы погрузили включенную лампочку в расплав селитры, то стекло, из которого сделан баллончик, оказалось в электрическом поле: спираль - отрицательный полюс, расплав, который соприкасается с полоской жести,- положительный. Подвижные ионы натрия начали двигаться в стекле в сторону катода, т. е. по направлению к спирали. Иными словами, они перемещались к внутренней стенке баллона.
Значит, зеркальный налет изнутри натриевый? Да. Но как же ионы превратились в металл?
Раскаленные металлы (в том числе и те, из которых изготовлена спираль) испускают электроны. От спирали они попали на внутреннюю поверхность стекла и соединились там с ионами натрия. Так образовался металлический натрий.
Но почему для опыта не годится калиевая селитра? Ведь нитрат вроде бы и не участвует в процессе. Нет, участвует. Когда ион натрия стал нейтральным атомом, в стекле осталась отрицательно заряженная ионная дырка. Тут и нужна натриевая селитра: из ее расплава под действием электрического поля в стекло проникают ионы натрия и заполняют дырки. А ионы калия примерно в полтора раза больше ионов натрия, они не смогут войти в стекло. В калиевой селитре лампа просто треснет.
Такой необычный электролиз через стекло иногда применяют на практике, чтобы получить слой очень чистого натрия, или, более строго, - "спектрально чистого".
публикую, т.к. получаемое количество натрия и напряжение - минимальны.
но цезий таким образом не получиш.
Григорьев И.Н. Получение металлического калия (натрия) в домашних условиях - файл n1.doc
Читайте также:
