Понятие о металлах и сплавах кратко
Обновлено: 02.05.2024
Материаловедение (от рус. материал и ведать) — междисциплинарный раздел науки, изучающий изменения свойств материалов как в твёрдом, так и в жидком состоянии в зависимости от некоторых факторов. К изучаемым свойствам относятся: структура веществ, электронные, термические, химические, магнитные, оптические свойства этих веществ. Материаловедение можно отнести к тем разделам физики и химии, которые занимаются изучением свойств материалов. Кроме того, эта наука использует целый ряд методов, позволяющих исследовать структуру материалов.
Направления исследований материаловедения
· Космическое материаловедение — создание и изучение материалов, которые пригодны для использования в космическом пространстве.
· Нанотехнология — создание и изучение материалов и конструкций размерами порядка нескольких нанометров .
дефекты кристаллов — изучение нарушений структуры кристаллов, включения посторонних частиц и их влияние на свойства основного материала кристалла;
технологии дифракции , такие как рентгеноструктурный анализ , используемые для изучения фазового состояния вещества.
создание и изучение материалов для электроники , например, полупроводники ;
структурная керамика , занимающаяся композитными материалами , напряжёнными веществами и их трансформациями.
· Биоматериалы — исследование материалов, которые можно использовать в качестве имплантатов в человеческое тело.
Разделы физики, на которых базируется материаловедение
· Термодинамика — для изучения стабильности, изменений фаз, для построения фазовых диаграмм .
· Термический анализ , термогравиметрия — для изучения изменения свойств материалов при воздействии температуры и при взаимодействии с различными газами .
· Кинетика — при изучении изменений фазового состояния вещества, термического разложения структуры и диффузии .
· Химия твёрдого тела — для изучения химических процессов, проходящих в твёрдой фазе.
Металловедение — прикладная наука, которая изучает строение, свойства металлов, устанавливает связь между химическим составом, структурой и свойствами металлов, а также закономерности изменения структуры и свойств под воздействием внешних факторов
Основана на теоретическом и экспериментальном изучении физики металлов, химически-структурных методах анализа твёрдого тела, а также на термодинамических и кинетических концепциях.
Как наука металловедение насчитывает около 200 лет, несмотря на то, что человек начал использовать металлы и сплавы ещё за несколько тысячелетий до нашей эры. В XVIII веке появились отдельные научные результаты, позволяющие говорить о начале осмысленного изучения всего того, что накопило человечество за все время использования металлов.
Первые опыты по травлению стали предпринял Реомюр (1683—1757). Ринман в 1774 году путём травления сталей нашел связь между их структурой и свойствами. В России дальнейшие работы по установлению связи между строением стали и её свойствами были проведены П. П. Аносовым. Основы научного металловедения были заложены металлургом Д. К. Черновым, который за свои работы был назван «отцом металлографии». В развитие металловедения большой вклад внесли работы Ф. Осмонда, У. Юм-Розери, Н. Ф. Мотта, Ф. Зейтца, Э. Бейна и других.
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на 2019 год, к металлам часто относят (единого общепринятого определения нет, например, полуметаллы и полупроводники не всегда относят к металлам):
· 6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
· 4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra; к щёлочноземельным также иногда относят Mg, и Be;
· 38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
— Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
· 7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
· 7 в группе полуметаллов: B, Si, Ge, As, Sb, Te, Po;
· 14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
· 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
· Также металлическими свойствами может обладать водород
Таким образом, к металлам могут относится более 90 элементов из всех открытых
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
2. Температура плавления
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
2.Кристаллические решетки
Кристаллическая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла . Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции . Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии.
В зависимости от пространственной симметрии, все кристаллические решётки подразделяются на семь кристаллических систем . По форме элементарной ячейки они могут быть разбиты на шесть сингоний . Все возможные сочетания имеющихся в кристаллической решётке поворотных осей симметрии и зеркальных плоскостей симметрии приводят к делению кристаллов на 32 класса симметрии , а с учётом винтовых осей симметрии и скользящих плоскостей симметрии на 230 пространственных групп .
Помимо основных трансляций, на которых строится элементарная ячейка, в кристаллической решётке могут присутствовать дополнительные трансляции, называемые решётками Браве . В трёхмерных решётках бывают гранецентрированная (F), объёмноцентрированная (I), базоцентрированная (A, B или C), примитивная (P) и ромбоэдрическая (R) решётки Браве. Примитивная система трансляций состоит из множества векторов (a, b, c), во все остальные входят одна или несколько дополнительных трансляций.
Общая характеристика металлов и сплавов
Металлы - это вещества, которые обладают в обычных условиях совокупностью характерных (металлических) свойств, таких как металлический блеск, прочность, пластичность, ковкость высокие электро- и теплопроводность. В отличие от неметаллов электрическая проводимость металлов возрастает при снижении температуры. К металлам обычно относят как простые вещества (собственно металлы), так и сплавы, которые также проявляют металлические свойства.
Для использования металлов в качестве конструкционных материалов важнейшее значение имеет сочетание механических свойств: пластичности и вязкости со значительной прочностью, твёрдостью и упругостью.
Используемые в технике и строительстве металлы подразделяют на чёрные и цветные. К чёрным металлам относят железо (Fe) и сплавы на его основе: сталь, чугун и ферросплавы. Сталь и чугун - это сплавы железа с углеродом. Чугуном называют сплав, содержащий более 2,14% углерода, сталью - меньше 2,14% углерода. Ферросплавы (специальные чугу-ны) имеют в своем составе повышенное содержание элементов: ферросилиций содержит 9 - 13% кремния (Si), ферромарганец 10 - 25% марганца (Мn) и т.д. На долю чёрных приходится около 94% получаемых в мире металлов.
Все остальные металлы и сплавы на их основе относят к цветным металлам. Из цветных металлов наибольшее значение в промышленности имеют алюминий (А1), медь (Сu), цинк (Zn), олово (Sn), титан (Ti), хром (Сг), никель (Ni), марганец (Мn). Так как стоимость цветных металлов достаточно высока, то в тех случаях, когда это возможно, вместо них стараются использовать чёрные металлы или неметаллические материалы.
В промышленности и строительстве металлы в виде чистых веществ практически не используют. Обычно применяют металлические сплавы, которых к настоящему времени существует тысячи видов. Это объясняется тем, что многие свойства сплавов (твёрдость, прочность, коррозионная стойкость и т.п.) превышают аналогичные свойства составляющих их чистых металлов.
Металлические сплавы - это однородные системы, состоящие из нескольких металлов (иногда и неметаллов) с характерными металлическими свойствами. Изменяя состав сплавов (соотношение и вид образующих их компонентов), можно в значительной степени изменять их свойства и таким образом создавать специальные сплавы с совокупностью необходимых свойств. Металлы (или неметаллы), вводимые в составсплава дляулучшения его свойств, называют легирующими, апроцесс изменения свойств сплава -легированием. I
Сплавы состоят из множества мелких по-разному ориентированных друг относительно друга кристаллов, называемых кристаллитами или зёрнами.
Различают следующие виды сплавов:
1 Твёрдый сплав представляет собой механическую смесь кристаллитов, каждый из которых содержит только один из металлов. Такие сплавы образуются при больших различиях свойств металлов, входящих в сплав (рис.7).
2 При сходстве свойств металлов, входящих в состав сплава, образуются твёрдые растворы металлов друг в друге. При этом атомы одного металла либо внедряются во внутреннее пространство кристаллической решетки другого металла, либо замещают его атомы в кристаллической решётке, образуя соответственно твёрдые растворы внедрения и твёрдые растворы замещения (рис.8).
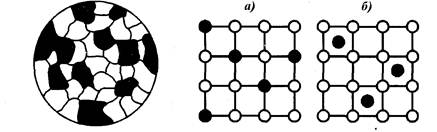
Рисунок 7 - Микроструктура а) твёрдые растворы замещения
твёрдого сплава, представляющего б) твёрдые растворы внедрения
собой механическую смесь двух Рисунок 8 - Твёрдые растворы
Различают сплавы с неограниченной взаимной растворимостью металлов в твёрдом состоянии и с ограниченной растворимостью. В последнем случае структура сплава не является однородной.
3 Твёрдые сплавы могут представлять собой химические соединения металлов друг с другом, которые называют интерметаллическими соединениями.
Фазой называют однородную по химическому составу и свойствам часть системы, отделенную от остальных частей (фаз) поверхностью раздела. На поверхности раздела свойства системы резко изменяются.
Правило фаз связывает число фаз, находящихся в равновесной системе, с числом компонентов системы, числом её степеней свободы и числом внешних параметров, определяющих состояние системы.
Соотношение: С= К - Ф + 2 называют правилом фаз Гиббса, где
С - число степеней свободы, или вариантность системы. Величина С показывает число параметров состояния системы (температура, давление, концентрации веществ), при изменении которых независимо друг от друга число фаз не меняется.
К - число компонентов системы. Это наименьшее число исходных веществ, достаточное для образования всех фаз данной системы.
Ф - число фаз в системе при данных условиях.
Правило Гиббса формулируется следующим образом: Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу компонентов системы минус число фаз плюс два.
Металлы являются нелетучими, поэтому состав сплава не зависит от давления. В связи с этим для сплавов используется уравнение в упрощенной форме: С = К - Ф + 1.
При равномерном охлаждении системы, в которой не происходит никаких фазовых превращений, изменение её температуры также происходит равномерно. В этом случае графиком зависимости температуры от времени, является плавная кривая линия, называемая кривой охлаждения.
Фазовые превращения в сплавах, например кристаллизация или переход металла в твёрдом состоянии из одной кристаллической модификации в другую, всегда сопровождаются некоторыми тепловыми эффектами. Выделяющаяся при фазовых превращениях теплота компенсирует потерю теплоты при охлаждении, и температура сплава остается постоянной до тех пор, пока не закончится превращение. В этом случае на кривой охлаждения сплава появляется выраженный горизонтальный участок.
По кривым охлаждения строятся диаграммы состояния, которые дают наглядное представление о фазовом составе системы при различных температурах. Знание диаграмм состояния позволяет выбирать оптимальные температуры для термической обработки сплава и его использования.
Понятие металлов, сплавов и изделий из них. Классификация, свойства и область применения.
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: блеском и непрозрачностью ,высокой тепло- и электропроводностью, прочностью, твердостью, ковкостью, пластичностью, жаропрочностью и коррозийной стойкостью.
Для диагностических исследований, проводимых в рамках КИМВИ, используются классификации, основанные на физических, химических свойствах металлов и степени их распространенности. По этим показателям металлы подразделяются
• легкие – алюминий, магний, титан, бериллий, литий, натрий;
• тяжелые – медь, свинец, никель, кобальт, олово, цинк, ртуть;
• тугоплавкие – вольфрам, молибден, ниобий, тантал, рений, хром;
• благородные (драгоценные) – золото, серебро, платина, палладий;
• радиоактивные – франций, радий, уран, актиний и актиниды;
• рассеянные – галлий, индий, таллий;
• магнитные – железо, никель, кобальт;
• редкоземельные – скандий, иттрий, лантан и лантаниды.
В промышленности металлы подразделяют на две основные группы: черные (на основе железа) и цветные (все остальные).
Металлы, которые производят и используют в ограниченном масштабе, называют редкими. К ним относят все рассеянные и редкоземельные металлы, большая часть тугоплавких, радиоактивные и некоторые легкие (бериллий, литий, рубидий
Сплаваминазываются твердые кристаллические тела, получаемые при сплавлении металлов и металлов с неметалла-
ми. По химическому составу первые подразделяются на сплавы следующих металлов:
• черных (чугун, сталь);
• цветных (алюминиевые – дюралюминий, силумин; медные – бронзы, латуни; свинцовые (баббиты, припой); магние-
вые, титановые и пр.);
• драгоценных (золотые, серебряные, платиновые и др.).
Особенности собирания объектов из металлов и сплавов.
Специфические свойства металлов облегчают поиск соответствующих объектов,даже в случаях, когда
последние сокрыты под землей, в воде, в тайниках и пр. С этой целью обычно используются металлоискатели разных модификаций, предназначенные для обнаружения изделий, изготовленных как из черных, так и из цветных металлов, на различном удалении.
Обращаться с металлическими объектами при их изъятии нужно таким образом, чтобы не поставить под сомнение возможность дальнейшего исследования не только материала изделий, но и имеющихся на их поверхности загрязнений (например, наслоений материалов взломанных преград на рабочих поверхностях предполагаемого орудия взлома), а также проведения различных традиционных криминалистических экспертиз: трасологических, дактилоскопических, баллистических и
пр. Поэтому замки и запирающие устройства изымаются в том состоянии, в котором обнаружены; проверять работу запирающего механизма на месте происшествия нельзя.
При изъятии пуль, дроби и картечи с целью сохранения следов на них
запрещается пользоваться пинцетами, плоскогубцами, щипцами и другими подобными предметами. Каждый из подобных предметов упаковывается отдельно в бумагу или ткань.
Поиск металлических опилок и стужек проводится визуально, а также при помощи дактилоскопической магнитной кисти, конец
которой обернут чистой бумагой или полиэтиленом, и фиксируются дактилоскопическими пленкам.
При изъятии металлов в виде порошка, напротив, пользоваться пылесосом и липкой пленкой недопустимо. Соответствующие пробы из значительных объемов отбираются при помощи шпателей и помещаются в стеклянные плотно закрываемые сосуды или полиэтиленовые пакетики, которые после этого запаиваются.
Изымаемая металлическая ртуть упаковывается только в герметично закрываемые стеклянные сосуды.
Если обнаруженные металлические объекты сырые, их необходимо просушить и упаковать в полиэтиленовые пакеты с
тем, чтобы исключить возможность их дальнейшей коррозии.
Предметы, на поверхности которых предполагается наличие микрочастиц или наслоений металла, как правило, изымаются целиком и упаковываются в полиэтилен или бумагу.
каждый предмет упаковывается в отдельный полиэтиленовый пакет.
Изъятые объекты следует предохранять герметичной упаковкой от воздействия атмосферы воздуха, влаги и других коррозийных сред.
Понятие о металлах и сплавах
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью.
Файлы: 1 файл
Курсовая прокатчика.doc
Понятие о металлах и сплавах.
Из всех известных в настоящее время элементов более половины являются металлами. Металлы — непрозрачные вещества, обладающие специфическим металлическим блеском, пластичностью, высокой теплопроводностью и электропроводностью. По этому признаку металлы легко отличить от других веществ (дерево, стекло и т. д.).
Все металлы и образованные из них сплавы делят на черные (к ним относят железо и сплавы на его основе, на их долю приходится около 95 % производимой в мире металлопродукции) и цветные. В технике принята условная классификация, по которой металлы делят на группы:
- легкие — алюминий (Al),магний (Mg);
- тяжелые — медь (Си), свинец (Рb);
- тугоплавкие — вольфрам (W), молибден (Мо);
- благородные — золото (Аu), платина (Pt);
- рассеянные — гадолиний (Gd), индий (In), таллий (Tl);
- редкоземельные — скандий(Sc), иттрий (Y);
- радиоактивные — радий (Ra), уран (U).
Понятие „чистый металл” весьма условно. Любой чистый металл содержит примеси, а поэтому его следует рассматривать как сплав. Под термином „чистый металл” понимается металл, содержащий 0,010-0,001% примесей. Современная металлургия позволяет получать металлы высокой чистоты (99,999%). Однако примеси даже в малых количествах могут оказывать существенное влияние на свойства металла.
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых физико-механических и технологических свойств. Поэтому их применение в технике в качестве конструкционных материалов ограничено. Наиболее широко применяют сплавы, которые обладают по сравнению с чистыми металлами более высокой прочностью и твердостью.
Сплавы — твердые и жидкие вещества — получают сплавлением или спеканием двух или более металлов или металлов с неметаллами. Элементы, образующие сплав, называют компонентами. Сплавы могут состоять из двух или большего числа компонентов. Строение металлического сплава более сложное по сравнению с чистым металлом.
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятие „фаза” и „структура”.
Фазой называется однородная часть системы (металла или сплава), имеющая границы раздела, при переходе через которые их свойства резко меняются.
Например, жидкий металл является однофазной системой; смесь жидкого металла и твердых кристалликов — двухфазной системой, так как свойства жидкого металла значительно отличаются от свойств твердых кристалликов. Фазами могут быть отдельные металлы, их химические соединения, а также растворы на основе металлов.
Под структурой понимается строение металла, т.е. взаимное расположение различных фаз, форма и размер составляющих их кристаллов.
Структурными составляющими сплава называются обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями. Структурные составляющие могут состоять из одной, двух или более фаз.
Одна из важнейших задач металловедения — определение связи между структурой и свойствами.
Кристаллические решетки.
В кристаллических веществах, к которым относятся все металлы, находящиеся в твердом состоянии, атомы занимают вполне определенное место, образуя пространственную решетку. Элементарная (наименьшая) ячейка этой решетки у каждого кристаллического вещества имеет свое, строго определенное строение и размеры (параметры). По „узору” и числу атомов в элементарной ячейке различают несколько типов атомных решеток.
У металлов чаще всего наблюдаются решетки следующих типов:
- кубическая объемноцентрированная (α-железо, вольфрам, молибден, β-титан и др.),
- кубическая гранецентрированная (γ-железо, алюминий, золото, медь, серебро, свинец и др.),
- гексагональная (бериллий, кадмий, магний, α-титан, цинк, γ-хром и др.).
Элементарная ячейка объемноцентрированной кубической (о.ц.к.) решетки образована девятью атомами, восемь из которых расположены на вершинах воображаемого куба, а девятый — в его центре (рис. 1,а).
Элементарная ячейка гранецентрированной кубической (г.ц.к.) решетки имеет более плотную упаковку и содержит 14 атомов — восемь расположены на вершине куба и шесть на пересечении диагоналей его граней (рис. 1,б).
Элементарная ячейка гексагональной решетки представляет собой гексаэдр (шестигранную призму), в центре основания которого и вершинах углов расположены атомы; кроме того, три атома находятся внутри гексаэдра. Всего ячейка содержит 17 атомов (рис. 1, в).
В элементарной ячейке кристаллической решетки можно выделить ряд характерных, так называемых кристаллографических плоскостей. В зависимости от ориентации плоскость может пересекать большее или меньшее количество атомов. В кубической о.ц.к. решетке наибольшее число атомов пересекает плоскость, проходящую по диагонали куба (рис. 1,г), в кубической г.ц.к. решетке — через диагонали граней и диагональ куба (рис. 1, д) в гексагональной — через его основание. Последняя плоскость называется базисной плоскостью.
В результате повторений элементарной ячейки в трех измерениях образуется тело кристалла с однообразно ориентированной атомной решеткой. Внешняя форма кристалла или, как его часто называют, монокристалла зависит от строения элементарной ячейки и условий кристаллизации, т.е. от образования кристаллов при переходе из жидкого состояния в твердое.
Кристаллы правильной формы встречаются в природе довольно часто. Они наблюдаются у поваренной соли, кварца, льда (снежинок) и других неметаллических веществ. Монокристаллы металла можно вырастить только искусственно в специальных условиях.
Рис. 1. Основные типы элементарных ячеек, образующих кристаллические решетки металлов, и положение кристаллографических плоскостей, наиболее плотно усеянных атомами.
Если измерить в различных направлениях физические свойства монокристалла, то окажется, что они будут сильно зависеть от выбранного направления, т.е. монокристалл обладает ярко выраженной анизотропией свойств. При испытании образцов, вырезанных из кристалла меди, было обнаружено, что в зависимости от направления их вырезки прочность образцов изменялась от 140 до 350 МПа, а относительное удлинение — в пять раз; изменялись также электро- и теплопроводность и другие свойства. Это объясняется тем, что в зависимости от избранного направления вырезки образцы совпадали с той или иной кристаллографической плоскостью, имеющей разную плотность атомов.
Известно, что атомы твердых тел совершают тепловые колебания. С ростом температуры кристаллического тела амплитуда колебаний атомов возрастает и при температуре плавления настолько увеличивается, что разрушается кристаллическая решетка — металл плавится.
Внешний вид металлического изделия не создает впечатления о металле, как о кристаллическом теле, так как металл, затвердевающий в обычных условиях, превращается не в монокристалл, а в массу, состоящую из большого количества отдельных кристалликов, ориентированных по отношению друг к другу по-разному, называемую поликристаллом. Поэтому физические свойства металла в целом одинаковы во всех направлениях.
В металлах всегда присутствует то или иное количество посторонних примесей. При кристаллизации примеси мешают правильному росту кристаллов, и форма их искажается. Такие кристаллы обычно называют кристаллитами или зернами.
Чтобы увидеть внутреннее строение металла, необходимо тщательно отполировать срез небольшого металлического образца, затем полированную поверхность протравить, т.е. обработать специально подобранными для данного металла химическими растворами. Растворы — смеси кислот или щелочей, взаимодействуя либо с самими кристаллами, либо с межкристаллитным веществом, выявляют структуру металла (рис. 2, а).
Рис. 2. Структура чистого металла и сплавов.
Значительно более сложное строение имеют кристаллиты сплавов двух или нескольких металлов. Температура плавления отдельных металлов неодинакова, поэтому температура плавления смеси зависит от соотношения массы компонентов. При кристаллизации сплавов первыми начинают выпадать из расплава самые тугоплавкие частицы, в состав которых в большинстве своем входят металлы, имеющие наиболее высокую температуру плавления. На первичных частицах нарастают вторичные, менее тугоплавкие и т.д. Кристаллит развивается, как дерево — сначала ствол, затем ветви — все тоньше и тоньше. Поэтому такие кристаллиты называют дендритами (от латинского названия дерева). По мере кристаллизации в твердом состоянии оказывается все больше тугоплавких составляющих сплава, а жидкость, окружающая кристаллиты (межкристаллитное вещество), становится все более легкоплавкой, поэтому она твердеет в последнюю очередь. На (рис. 2, б), представлена микрофотография структуры сплава. Следовательно, межкристаллитное вещество, обволакивающее каждый кристаллит и спаивающее их все в одно целое, кристаллизуется в самую последнюю очередь. При нагревании, наоборот, межкристаллитное вещество плавится в первую очередь, затем, при повышении температуры, начинают переходить в жидкое состояние части кристаллитов в порядке, обратном кристаллизации, т.е., если чистые металлы плавятся при строго определенной температуре, сплавы плавятся в интервале температур.
При сплавлении двух металлов могут быть три характерных случая:
1. Оба металла неограниченно растворяются друг в друге при любых температурах, например медь и никель, золото и серебро. Такие сплавы обладают высокой пластичностью и хорошо обрабатываются давлением в горячем и даже холодном состоянии, но плохо обрабатываются резанием — под резцом образуется длинная вьющаяся стружка, возникают налипы.
2. Металлы растворяются друг в друге в твердом состоянии ограниченно, причем наиболее часто степень растворимости очень сильно зависит от температуры. Например, при постепенном добавлении к меди цинка он сначала целиком растворяется, а по достижении содержания цинка более 40 % образуются совершенно новые кристаллы — с другой решеткой, возникает новая фаза, т.е. сплав становится двухфазным (рис. 2, в). Физико-химические свойства фаз, как правило, весьма различны, имеют разную твердость, пластичность и т.д. У двухфазных сплавов обычно более низкие пластические свойства, чем у однофазных, они хуже обрабатываются давлением, но лучше резанием.
3. Металлы, кроме растворов, образуют химические соединения. Например, в сплаве меди с оловом Cu3Sn химическое соединение выступает как самостоятельный компонент сплава, а его количество зависит от соотношения основных металлов.
Химические соединения, имеют очень высокую твердость, превосходящую твердость основных компонентов в десятки раз. Известны химические соединения, например карбиды вольфрама, молибдена или титана, твердость которых приближается к твердости алмаза. Технологические свойства подобных сплавов зависят от количества интерметаллических включений, а главное — от их формы. Например, включения в виде игл и пластинок способствуют разрушению кристалла при деформации.
Реальная кристаллическая решетка металла не является неподвижной конструкцией. Все составляющие ее частицы находятся в непрерывном движении: движутся оторванные от атомов электроны, обеспечивая межатомную металлическую связь и электрическую проводимость, около своих средних положений совершают колебательные движения атомы; время от времени тот или иной атом при превышении определенного энергетического уровня начинает перемещаться по кристаллу, нарушая правильность кристаллической решетки. Такие нарушения вызывают и "чужеродные" атомы — атомы примесей, которые внедряются в решетку при кристаллизации. Мельчайшие пузырьки газа, трещинки, включения неметаллических примесей ослабляют кристаллическую решетку, делают ее несовершенной, тем самым, изменяя и свойства металлов и сплавов.
Читайте также:
