Практическая работа 7 по химии решение экспериментальных задач по теме металлы 9 класс рудзитис
Обновлено: 06.05.2024
Решение экспериментальных задач.
1. В четырех пробирках даны следующие вещества в твердом виде: а) хлорид магния; б) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
2. В четырех пробирках даны следующие твердые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
3. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
4. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
5. Докажите, что кристаллы сульфата железа(II) частично окислились и содержат примеси ионов Fе 3+ .
6. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жесткость.
7. Практически осуществите следующие превращения:
а) Fе → FеСl2 → Fе(ОН)2 → Fе(ОН)3 → Fе(NO3)3
б) Аl → Аl2(SO4)3 → Аl(ОН)3 → Na[Аl(ОH)4]
1. Добавляем раствор соляной кислоты. В пробирке с карбонатом натрия выделяется газ.
Оставшиеся вещества растворяем в воде и к
полученным растворам добавляем фенолфталеин.
В одной пробирке со щелочью раствор розовеет.
К оставшимся растворам добавляем раствор нит-
рата серебра. В пробирке с хлоридом магния обра-
зуется белый осадок.
К оставшемуся раствору добавляем концентри-
рованную серную кислоту и кусочек меди. Нагре-
ваем. Выделяется газ бурого цвета, что свидетель-
ствует о наличие нитрата натрия в пробирке:
2. Ко всем веществам добавляем раствор соляной
кислоты. В пробирке с карбонатом выделяется
углекислый газ:
В пробирке с сульфидом натрия выделяется газ
с запахом тухлых яиц — H2S.
После растворения оставшихся веществ в воде
добавляем раствор сульфата натрия.
В пробирке с нитратом стронция образуется
белый осадок.
К оставшемуся раствору добавляем раствор хло-
рида бария. Образуется белый осадок сульфата
бария:
3. К выданному веществу добавляем раствор
хлорида бария. Выпадает белый осадок, что свиде-
тельствует о наличии сульфат-иона.
При взаимодействии со щелочью или гидрокси-
дом аммония выпадает белый осадок гидроксида
алюминия:
4. Хлорид натрия окрашивает пламя горелки в
желтый цвет.
Хлорид стронция определяем по реакции с суль-
фатом аммония, в результате которой выделится
белый осадок:
Хлорид алюминия доказываем реакцией с гид-
роксидом натрия
5. Растворяем кристаллы в воде и добавляем
раствор NaOH. Образуется зеленый и бурый осадки.
Если сульфат железа (II) содержал Fe3+, то в
зеленом осадке будут прожилки или пятна бурого
цвета.
6. В воду, содержащую MgSО4, добавляем рас-
твор Na2CО3. Образуется белый осадок.
Ионы Mg2+ обуславливают постоянную жест-
кость воды. Такую воду можно умягчить, добавив
раствор карбоната натрия, так как при этом проис-
ходит связывание ионов Mg2+.
В воду, содержащую Са(НСО3)2, добавляем:
раствор Na2CО3, известковое молоко, то есть насы-
щенный раствор Са(ОН)2; кипятим ее. Образуется
белый осадок.
Присутствие Са(НСО3)2 обуславливает времен-
ную жесткость воды. Эту воду можно умягчить
добавлением известкового молока, соды или кипя-
чением, так как все эти процессы сопровождаются
образованием СаСО3.
7.
ГДЗ по химии за 9 класс к учебнику Рудзитиса. Ответы, решения онлайн

§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):
Проверка домашнего задания по химии за 9 класс Рудзитиса из ГДЗ
По мере углубления в химию, как в науку и учебный предмет, современные школьники сталкиваются с более сложными темами. Особенно это становится заметным в процессе изучения теоретического материала и на практических занятиях в старших классах. Ответы к упражнениям из учебника Рудзитиса за 9 класс помогают самостоятельно разбираться с трудными задачами, и всегда находить правильное решение, быстро сделать домашнюю работу, готовиться к контрольным, тестовым заданиям, получать качественные знания во время удаленного обучения.
Общее описание решебника
Последнее издание решебника по химии 9 класс Рудзитиса представляет собой подробное пособие с ответами к задачам в учебнике с пошаговым описанием их решения, и это очень важный нюанс. Рассматривая данные алгоритмы, ребенок не будет бездумно списывать. Он начнет обретать понимание предмета. В дальнейшем сможет справляться с упражнениями или вопросом по теме любой главы или параграфа без помощи преподавателя, и в этом смысле ГДЗ является хорошим подспорьем к учебе в школе.
Усилиями авторов в методичке проработана каждая страница. Особое внимание они уделили основным темам, изучаемым на протяжении учебного года в классе. Таким, к примеру, как окислительные и восстановительные реакции, а также использование органических соединений, классификация химических элементов.
Изучая ГДЗ Рудзитиса, девятиклассники научатся выполнять непростые уравнения. Осваивать в короткий срок много полезного материала, получать необходимые знания в полном объеме.
Польза ГДЗ для родителей и учителей
Так как подобного рода пособия содержат готовые ответы на задания, которые ученики решают на уроках и дома, а значит, могут быть полезны родителям и педагогам. Больше не нужно тратить огромное количество времени, чтобы вникать в ту или иную задачу, решить уравнение, чтобы проверить уровень подготовки сына или дочери.
Достаточно скачать ГДЗ по химии 9 класс Рудзитис на ноутбук, декстоптное устройство и пользоваться им по мере необходимости или зайти на сайт онлайн. Таким образом можно осуществлять контроль успеваемости своего ребенка, не углубляясь в содержащуюся в учебниках информацию.
Учителям ГДЗ помогает готовиться к предстоящим занятиям, прорабатывать новые методики обучения, выбирать оптимальные варианты решения уравнений для разбора их на уроке, а так же проверять рабочие тетради. Относительно последнего, можно добавить, что только педагогу известно, сколько доставляет проблем и отнимает времени рутинная работа по проверке письменных контрольных, домашних, тестов, и т.д. Разработанное Гудзитисом Г.Е. и Фельдманом Ф.Г пособие в этом плане, однозначно лучший выход.
Важность науки
Важность этой науки переоценить невозможно. Без знания свойств химических веществ и их соединений сегодня не обходится ни одно производство или промышленность. Будь то газовые, нефтеперерабатывающие комплексы, фармакология или сельское хозяйство.
Предмет обширен и глубок, и что самое главное, важен. Именно по этой причине преподавание его начинается в общеобразовательном учебном заведении, и здесь важно не упустить момент, и вовлечь учащегося в процесс обучения. Увлечь его интересными теориями, теоремами и формулами, при этом дать понять, что при должном старании освоить его не так уж и сложно. Особенно, если это делать с подобными данному решебнику Рудзитиса сборниками, наполненными важной и полезной информацией.
Решебник (гдз) по химии за 9 класс Рудзитис, Фельдман Учебник

Углубленное изучение химии - не редкость для многих профильных учебных заведений. Как правило, по окончании 11 класса учащиеся таких специализированных школ выбирают данный предмет для сдачи в формате ЕГЭ. Также такой уровень подготовки подходит и для тех учеников, которые рассчитывают сдать экзамен на максимально возможное количество баллов.
Именно для таких категорий учеников подходит учебник Рудзитиса для одиннадцатого класса с углубленным уровнем. Он может быть как базовым, так и дополнительным источником информации для выпускника в зависимости от учебной программы, принятой в его школе. В любом случае с его помощью школьник сможет повторить материалы, связанные со следующими понятиями:
- строение соединений;
- энергетика и скорость реакций;
- растворы;
- металлы и неметаллы.
Каким образом пособие по химии за 9 класс Рудзитис может помочь выпускнику и преподавателям
Сборник с ГДЗ предоставляет возможность:
- сократить время на подготовку без потери качества;
- совершить проверку своих знаний без посторонней помощи;
- повторить пройденный материал или восполнить пробелы в знаниях;
- подготовиться к итоговым выпускным испытаниям и увеличить вероятность получения нужного числа баллов.
Пособие по химии за 9 класс по химии (углубленный уровень) от Рудзитиса также может помочь учителям, занимающимся подготовкой детей к ЕГЭ индивидуально или на дополнительных занятиях. На основе приведенных задач учитель имеет шанс составить новые варианты упражнений и тестов для тренировки. Некоторые из таких заданий могут встретиться на экзамене.
Как устроен решебник
Сборник соответствует основному учебнику, где после каждого параграфа имеются вопросы и задания, на которые даны развернутые ответы. Некоторые ключи дополняются химическими формулами превращения веществ. Помимо этого тут есть объяснения к 21 практической работе. Найти нужный номер достаточно легко, вся информация доступна в режиме онлайн круглосуточно.
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”
На протяжении многих лет преподаватели и родители спорят о том, важны ли оценки. Дело в том, что сегодняшняя система подвергла сомнению важность получения аттестата. Из-за этого общество разделилось на два лагеря. Первые считают, что главное – это психическое и физическое здоровье. Другая категория, наоборот, думают, что оценки в журнале – это прямое отражение того, как старался ребенок, какой объем информации усвоил и насколько хорошо знает всю рабочую программу. Эта позиция более близка к современным реалиям, т. к. по аттестату принимают в университеты (устанавливается приоритет). Получать хорошие отметки и развиваться, например, в области естествознания можно с помощью онлайн-сборника Рудзитиса Гунтаса Екабовича издательства «Просвещение» 2016 года
Каким образом помогут ГДЗ по химии для 9 класса (авторы: Г. Е. Рудзитис, Ф. Г. Фельдман)
Отличники и многие хорошисты обычно имеют явное преимущество перед своими сверстниками:
- Они иногда могут пропускать занятия. Происходит это из-за того, что они – любимчики учителей. Их целеустремленность, пунктуальность и умение сосредотачиваться подкупают и служат гарантом, что ни одна тема не будет упущена, а все заданные упражнения будут выполнены;
- Бонусы при поступлении приносит посещение конкурсов и олимпиад. Помимо этого, такая активность позволяет меньше волноваться на контрольных работах, тестах, ЕГЭ и ОГЭ;
- Они почти никогда не подвергаются травле со стороны одноклассников.
Чтобы добиться такого положения, необходимо стараться. Так, требуется не прогуливать учебу без повода, заниматься дополнительно и выявлять все пробелы и упущенные моменты. Особенно это касается науки о веществах. Она нужна для значительного спектра специальностей, но все же большинство не выбирают эту дисциплину в качестве государственного экзамена, однако получить заветную медаль мечтает каждый.
Содержание решебника по химии за 7 класс Рудзитиса
Огромный плюс данного сборника в том, что все разделены, включенные в учебно-методический комплекс с готовыми ответами, полностью соответствуют основному учебнику:
- Классификация химических реакций. Их поведение в водных растворах
- Галогены.
- Кислород. Сера. Азот. Фосфор.
- Углерод и кремний.
- Металлы.
- Первоначальные представления об органических веществах.
Чтобы найти нужное, достаточно выбрать интересующий параграф и кликнуть на номер упражнения. После этого откроется решение, в котором подробно описаны все действия.
Готовые домашние задания –это специальное пособие, которое предназначено для помощи всем школьникам. В нем есть верные ответы на любой номер, а также подробные решения всех заданий.
Конспект урока-практикума "Решение экспериментальных задач по теме Металлы" (9 класс)
Вид урока : урок совершенствования знаний, умений и навыков на практике.
Форма: практическая работа.
- применить знания, полученные при изучении темы «Металлы», в экспериментальном решении задач;
- закрепить навыки проведения химического эксперимента.
Планируемые результаты:
· Предметные: знать свойства металлов главных подгрупп ПСХЭ Д.И. Менделеева; уметь применять полученные и теоретические знания о химии металлов в практических работах, проводить опыты по осуществлению реакций в соответствии с правилами пользования химической посудой и правилами безопасного обращения с химическими веществами, описывать наблюдения и характеризовать результаты выполненных опытов, составлять уравнения реакций, характеризующих свойства металлов и их соединений.
· Метапредметные:
А) регулятивные: умение ставить цели и анализировать условия достижения цели; прогнозирование результата и оценивание уровня достижения результата.
Б) познавательные: знать свойства металлов главных подгрупп ПСХЭ Д.И. Менделеева ; умение структурировать знания; умение выделять существенные характеристики объектов; умение устанавливать причинно-следственные связи.
В) коммуникативные: умение организовывать учебное сотрудничество и совместную деятельность с товарищем; умение участвовать в коллективном обсуждении проблемы, аргументировать свою позицию.
· Личностные: умение управлять своей познавательной деятельностью; самоконтроль и самооценка.
- Организационный момент.
- Мотивация на входе
задание на определение ионов в растворе. На слайде
- прежде чем выполнить это задание необходимо сначала поставить ожидаемый результат, а затем сравните его с реальным.
1. Обнаружить присутствие сульфат – анионов в растворе можно с помощью раствора, содержащего ионы
1. Cu 2+ 2. Na + 3. Ba 2+ 4. Al 3+
2. В растворах, содержащих ОH - , фенолфталеин имеет окраску:
1. желтую 2. оранжевую 3. бесцветную 4. малиновую
3. Обнаружить присутствие хлорид – анионов в растворе можно с помощью раствора, содержащего ионы
1. Cu 2+ 2. Na + 3. Ba 2+ 4. Ag +
4. Поваренная соль окрашивает пламя в:
1. в зеленый цвет
2. кирпично – красный цвет
3. светло – фиолетовый цвет
- зачем вам эти знания?
3. Целеполагание
Вы изучили теоретический материал по теме «Металлы и их соединения». Скажите, какая тема урока у нас будет сегодня?
Какую цель урока сегодня перед собой поставите?
Определите задачи урока.
Какой хотите получить результат в конце урока?
4. Информационно-аналитический блок
1. Повторим основные правила по технике безопасности.
2. Предлагаю вам выполнить первое учебное задание
НОВОЕ ПОСТУПЛЕНИЕ. В школьную лабораторию Дальнезакорской средней школы поступили новые химические реактивы, но вот не задача – на трех упаковках с реактивами не оказалось этикеток. Помогите лаборанту их распознать.
Перед вами на столах в трех пронумерованных пробирках даны вещества: хлорид калия, карбонат кальция и сульфат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из веществ. Запишите уравнения химических реакций в тетрадь, укажите их признаки.
Сравните свой результат с ключом, представленным на слайде. Оцените себя по критериям:
- за каждое верно составленное уравнение химической реакции – 1б,
- за верно указанный признак химической реакции – 1б.
Если вы набрали 6-5 б – «5», 4-3 б – «4», 2б – «3», менее 2б – вы не справились с заданием.
Сделайте вывод, что получилось /не получилось/, почему?
5. А теперь я вам предлагаю выполнить следующее задание.
ЧТО ЖЕ ЭТО? У вас на столе в химическом стакане находится неизвестное вещество, каким способ узнать, что же это? Попробовать на вкус? Конечно, нет! А вдруг это яд! По внешним признакам – тоже не получается!
Проведите эксперимент, растворите выданное вами вещество в воде, затем разлейте полученный раствор в две пробирки. К раствору в пробирке №1 прилейте немного растворе хлорида бария, а в пробирку № 2 гидроксида натрия.
Результаты эксперимента внесите в таблицу:
Предполагаемый ион, который содержит неизвестное вещество
Запишите уравнения химических реакций, которые были проведены.
На основе результатов эксперимента, сделайте вывод.
Применение сульфата алюминия
Сульфат алюминия используется в пищевой промышленности в качество добавки Е520 (коагулянт, отвердитель). Кроме этого его применяют для очистки сточных и питьевых вод (опять же выступает в качестве коагулянта), а также в бумажной и текстильной промышленности, кожевенном деле.
6. Учебное задание №3.
- Обратите внимание на заголовок, какому веществу эти прилагательные относятся?
ЖЕСТКАЯ И МЯГКАЯ. Вам известно, что в дождевой воде мыло хорошо пенится, такую воду называют мягкой, а в ключевой – обычно плохо (жесткая вода).
Перед вами на столах в двух химических стаканах дана вода. В одной из них вода содержит сульфат магния, а в другой гидрокарбонат кальция. Проделайте опыт, при помощи которого можно устранить постоянную жесткость. Запишите уравнение протекающей химической реакции. Обсудите с одноклассниками, какими способами можно устранить временную жесткость воды.
Почему жесткую воду не рекомендуется употреблять в пищу, нельзя, например, использовать для охлаждения двигателей машин? Ответ поясните. Приведите примеры из жизни.
Учитель дополняет информацию о влиянии жесткой воды на организм человека.
Влияние жёсткой воды на организм
Существует постоянная и временная жёсткость воды. При постоянной жёсткости в воде находится допустимое количество химических веществ, которое не приносит человеку вреда, а даже напротив насыщает организм необходимыми микроэлементами.
Сложнее обстоит дело с временной жесткостью, при которой в воде появляются гидрокарбонат кальция и магния. Эта крайне вредная смесь для организма, которая затрудняет работу желудка и кишечника, провоцирует образование камней в почках. Во время приготовления пищи в воде, перенасыщенной гидрокарбонатами магния и кальция, в продуктах разрушаются многие полезные вещества, а сами продукты развариваются. В такой воде хуже отстирываются вещи, а при мытье посуды моющие средства слабо пенятся. Обычно, когда говорят о «жёсткой воде» подразумевают именно временную жёсткость.
Результат повышенного содержания кальция и магния в водопроводной воде можно увидеть собственными глазами в виде накипи на стенках чайника или посудомоечной машины. При превышении нормы железа вместо накипи на стенках чайника образуется рыжеватый налёт. И то и другое вредно для организма. Только представьте, если накипь покрывает посуду за несколько недель, то, что происходит с нашим организмом, если мы употребляем эту воду годами? Кроме угнетающего воздействия на организм в виде образования камней, отложения солей, жёсткая вода не лучшим образом влияет на внешний вид. При постоянных гигиенических процедурах в жёсткой воде, волосы становятся ломкими и тусклыми, медленно растут, кожа при умывании стягивается, делается сухой, появляются мелкие морщинки.
Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Твёрдые вещества растворили в воде, далее прилили соляную кислоту.
В одной пробирке выделяется газ без цвета и запаха:
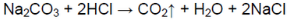
В пробирке — карбонат натрия.
К другим растворам добавили несколько капель фенолфталеина.
Содержимое одной из пробирок окрасилось с малиновый цвет.
В пробирке — гидроксид натрия (образует щелочную среду).
К оставшимся растворам добавили нитрат серебра.
В одной пробирке выпадает белый осадок:
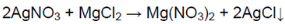
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.

3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
К растворам добавили сульфат калия.
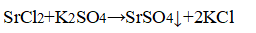
В пробирке — хлорид стронция.
К оставшимся растворам прилили раствор гидроксида натрия.
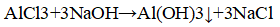
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия.
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
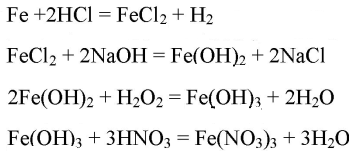
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
Растворили твёрдые вещества и добавили к растворам соляную кислоту.
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:

В пробирке — карбонат кальция.
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
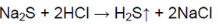
В пробирке — сульфид натрия.
К остальным растворам прилили раствор серной кислоты.
В одной из пробирок выпадает белый осадок:
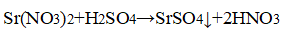
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия.
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
Читайте также:
