Практическая работа взаимодействие металлов с растворами кислот и солей
Обновлено: 20.09.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Практическая работа №2
По теме: «Общие свойства металлов и их соединений».
Цель работы: изучение химических свойств металлов и их соединений.
- Закрепить знания о химических свойствах металлов: взаимодействие металлов с растворами кислот и солей.
- Экспериментальным путем убедиться в различной химической активности металлов, доказать, что более активные металлы восстанавливают менее химически активные из водных растворов их солей.
- Изучить общие свойства амфотерных гидроксидов.
- Изучить общие свойства нерастворимых оснований.
- Отработать навыки экспериментальной работы согласно правилам техники безопасности.
Краткие теоретические сведения.
Металлы в периодической системе находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном уровне, как правило, не превышающее трёх. Атомы металлов легко отдают электроны и являются хорошими восстановителями.
Металлы по их активности расположены в ряд, называемый электрохимическим рядом напряжений металлов.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода, могут вытеснять его из растворов кислот, а всякий металл, стоящий ближе к началу ряда, может вытеснять (восстанавливать) последующие из растворов их солей.
1.Металлы, расположенные в начале ряда - от лития до магния –восстанавливают водород из воды с образованием щелочи:
2Na + 2HOH 2NaOH + H 2 ↑.
2. Металлы менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 ↑.
3.Металлы реагируют с кислотами. Взаимодействие металлов зависит от их активности (см. электрохимическим рядом напряжений металлов) и от концентрации кислоты:
а) кислоты HCl, H 3 PO 4 , H 2 SO 4(разб.) реагируют со всеми металлами (кроме Pb), которые стоят в ряду напряжений до водорода, при этом выделяется водород;
Zn + 2HCl ZnCl 2 + H 2 ↑.
б) концентрированная H 2 SO 4 при нагревании реагирует со всеми металлами (кроме Pt и Au), при этом водород не выделяется; с тяжелыми (плотность > 5 г/ см 3 ) металлами образует газ SO 2 (оксид серы (IV)); с более активными легкими (плотность 3 ) металлами выделяется H 2 S (сероводород):
Cu +2H 2 SO 4 (конц) CuSO 4 + 2H 2 O + SO 2 ↑.
в) концентрированная НNO 3 c щелочными и щелочноземельными металлами образует газ N 2 O – оксид азота (IV), с другими тяжелыми металлами – оксид азота (IV) NO 2 :
Ca + 10HNO 3(конц.) → Ca(NO 3 ) 2 + N 2 O + 5 H 2 O
Cu + 4HNO 3(конц.) → Cu(NO 3 ) 2 + NO 2 + 2 H 2 O
г) разбавленная НNO 3 взаимодействует c щелочными и щелоч-ноземельными металлами, а также с Zn, Fe, Sn, при этом выделяется газ NH 3 (аммиак) или образуется соль аммония (NH 3 + НNO 3 =NH 4 NO 3 ), при реакции с остальными металлами (плотность > 5 г/ см 3 ) образуется оксид азота (II) NO:
Ca + 10HNO 3(разб.) → 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3 H 2 O
Cu + 4HNO 3(разб.) → 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
д) кислоты H 2 CO 3 ,H 2 SO 3 , CH 3 COOH – слабые, взаимодействуют с активными металлами:
2 CH 3 COOH + 2Na → 2CH 3 COONa + H 2
4. Каждый последующий металл может быть восстановлен из раствора соли предыдущим металлом: Fe + CuSO 4 FeSO 4 + Cu.
Переходные металлы расположены в Периодической системе с 4 по 7 период. Переходные металлы, символы которых расположены в самой таблице, называют d-элементами, а те элементы, символы которых расположены в нижней части Периодической системы, называют лантаноидами и актиноидами или f-элементами.
Амфотерные оксиды - оксиды переходных металлов.
1. Амфотерные оксиды не растворяются в воде.
2. Амфотерные оксиды, реагируя с основными и с кислотными оксидами, дают соли:
Al 2 O 3 + K 2 O 2KAlO 2 ,
Al 2 O 3 + 3SO 3 Al 2 (SO 4 ) 3 .
3. Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH K 2 ZnO 2 + H 2 O,
ZnO + H 2 SO 4 ZnSO 4 + H 2 O
4. Соответствующие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH) 2 Zn 2+ + 2OH - - как основание
H 2 ZnO 2 2H + + ZnO 2 2- - как кислота
Амфотерные гидроксиды - это такие гидроксиды, где растворенная в воде часть, диссоциирует на катионы водорода, металла и анионы гидроксида и кислотного остатка.
Zn(OH) 2 ⇆ Zn 2+ + 2OH - , H 2 ZnO 2 ⇆ 2H + + ZnO 2 2-
1.Взаимодействием переходных металлов (после удаления оксидной пленки) с водой:
2Al + 6H2O = 2Al(OH) 3 + 3H 2 ↑
2.Взаимодействие солей со щелочами:
ZnCl 2 + 2KOH Zn(OH) 2 + 2KCl
3. Взаимодействием солей с кислотами:
Na[Al(OH) 4 ] + HCl Al(OH) 3 + NaCl + H 2 O
1. Диссоциирует на ионы растворенная в воде часть амфотерного гидроксида: Zn(OH) 2 ⇆ Zn(OH) + + OH - ⇆ Zn 2+ + 2OH -
H 2 ZnO 2 ⇆ HZnO 2- + H + ⇆ZnO 2 2- + 2H +
2. Взаимодействие с кислотными оксидами, кислотами и кислыми солями:
2Cr(OH) 3 + 3SO 3 Cr 2 (SO 4 ) 3 + 3H 2 O
Al(OH) 3 + 3HBr AlBr 3 + 3H 2 O
Zn(OH) 2 + 2NaHSO 4 ZnSO 4 + Na 2 SO 4 + 2H 2 O
3. Взаимодействуют с основными оксидами, основаниями и основными солями:
Zn(OH) 2 + Li 2 O Li 2 ZnO 2 + H 2 O
Zn(OH) 2 + Ba(OH) 2 BaZnO 2 + 2H 2 O
4. Подвергаются разложению при нагревании:
2Al(OH) 3 Al 2 O 3 + 3H 2 O
Приборы и реактивы:
- штатив с пробирками, пипетка, держатель для пробирок, спиртовки, спички, стеклянная палочка.
- растворы: серной кислоты, гидроксида натрия; растворы солей: сульфат меди (II),хлорид цинка, сульфат алюминия, сульфат натрия; кусочки: цинка, меди.
Порядок выполнения работы.
Опыт № 1. Взаимодействие металлов с растворами кислот.
Ход работы: В три пробирки положить: в первую кусочек магния, во вторую – гранулу цинка, в третью – медь (кусочек проволоки). Прилить во все пробирки 1 мл раствора серной кислоты.
Записать наблюдения в таблицу «Оформление отчета». Сравнить скорость происходящих реакций. Почему в одной из пробирок реакция не идёт? Дать объяснение. Записать уравнения реакций в молекулярном и ионном видах.
Опыт № 2. Взаимодействие металлов с солями.
Ход работы: В одну пробирку положить одну гранулу цинка и прилить раствор медного купороса, во вторую – кусочек медной проволоки и прилить раствор сульфата натрия.
Записать наблюдения в таблицу «Оформление отчета». Составить схему электронного баланса в окислительно–восстановительных реакциях.
Опыт № 3. Получение гидроксида цинка и испытание его амфотерных свойств.
Ход работы: В две пробирки налить по 5-6 капель раствора соли цинка и очень аккуратно по каплям добавить в них раствор щелочи до появления осадка.
Затем в одну пробирку добавить 2-3 капли раствора серной кислоты.
В другую пробирку добавить избыточное количество щелочи (до растворения осадка).
Записать наблюдения в таблицу «Оформление отчета». Составить уравнения реакций в молекулярном и ионном виде.
Опыт № 4. Получение гидроксида меди и изучение его свойств
Ход работы: Из имеющихся реактивов получить гидроксид меди (II). Указать цвет осадка. Нагреть полученное вещество.
Записать наблюдения в таблицу «Оформление отчета». Что произойдет с осадком при нагревании?
ПРАКТИЧЕСКАЯ РАБОТА ПО ДИСЦИПЛИНЕ «ЕСТЕСТВОЗНАНИЕ» ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С РАСТВОРАМИ КИСЛОТ И СОЛЕЙ. Специальность 46.02.01 Документационное обеспечение управления и архивоведение
1. Правила обязательны для выполнения всеми учащимися, лабораторно-практическим занятиям по химии.
2. Опасность возникновения травм :
- при работе со спиртовками ;
- при работе с горючими жидкостями;
- при работе со стеклянной посудой;
- при использовании электроплитки ;
- при работе с растворами кислот и щелочами.
3. Химические опыты с токсичными веществами (хлор, сероводород, фосфид, оксид углерода, бром, бензол, дихлорэтан, диэтиловый эфир, формалин, уксусная кислота, аммиак) проводить только в исправном вытяжном шкафу.
4. В кабинете химии должна быть аптечка, укомплектованная необходимыми медикаментами и перевязочными средствами для оказания первой помощи пострадавшим.
Требования безопасности перед началом занятий:
1. Не трогать приготовленные к работе материалы и оборудование.
2. Внимательно выслушать инструктаж по ТБ при проведении работы.
3. Получить учебное задание у преподавателя.
4. Одеть рабочую одежду.
Требования безопасности во время занятий:
1. Выполнять все действия только по указанию преподавателя.
2. Не зажигать спиртовку одну от другой. Гасить ее только колпачком.
3. Выполнять только работу, определённую учебным заданием.
4. Не делать резких движений, не трогать посторонних предметов.
5. Соблюдать порядок и дисциплину.
6. Пользоваться электроплиткой только с закрытой нагревательной спиралью.
7. Перед выполнением каждого вида работы выслушать инструктаж преподавателя.
8. При нагревании жидкостей не направлять отверстие пробирки на себя или соседа.
9. Пробирки закреплять надежно в штативных держателях.
10. Кипячение горючих жидкостей выполнять только на водной бане.
11. Пробирки нужно брать легко, не сжимая их пальцами.
12. Порошковые химикаты брать только пластмассовой ложечкой.
13. Кислотные растворы и щелочи наливать только в стеклянную посуду.
14. Растворы кислот вливать в воду, но не наоборот.
15. Не пробовать на вкус никакие жидкости и твердые хим.вещества.
Требования безопасности в аварийных ситуациях:
1. При плохом самочувствии сообщить об этом преподавателю.
2. Разбитое стекло убирать только щеткой и совком.
3. При получении травмы немедленно сообщить о случившемся преподавателю.
4. Разлитые и рассыпанные химикаты не убирать самостоятельно.
Требования безопасности по окончании занятий:
1. Привести в порядок свое рабочее место, проверить его безопасность.
2. Снять рабочую одежду.
3. Не выносить из кабинета ничего без указания преподавателя.
4. Вымыть лицо и руки с мылом.
5. Обо всех недостатках, обнаруженных во время работы, сообщите преподавателю.
Лабораторная работа № 6
Тема: Взаимодействие металлов с растворами кислот и солей.
Цель: познакомиться экспериментально с химическими свойствами неорганических кислот
1. Действие кислот на индикаторы
Оборудование реактивы:
- раствор серной кислоты (1:5);
- раствор соляной кислоты (1:3);
- раствор лакмуса (полоски индикаторной бумаги);
- раствор метилового оранжевого (метилоранж);
В 2 пробирки внесите по 5 капель раствора соляной кислоты, к одной добавьте каплю лакмуса (полоски индикаторной бумаги), а к другой – каплю метилоранжа.
Как изменяется окраска индикаторов от действия кислоты?
Теперь проделайте то же самое с серной кислотой. Что вы наблюдаете?
Вопрос: Какой можно сделать общий вывод о действии кислот на индикаторы – лакмус и метиловый оранжевый.
Задание: даны растворы 2 веществ. Как можно практически доказать, что одно из них является раствором кислоты?
2. Взаимодействие металлов с кислотами
Оборудование и реактивы :
- две гранулы цинка ;
- несколько кусочков меди, алюминия ;
- раствор соляной кислоты (1 :3)
Ход работы :
В пробирки положите разные металлы: в одну – гранулу цинка, в другую – железные опилки, в третью кусочки меди, в четвертую – кусочки алюминия. Во все пробирки налейте по 1 мл раствора соляной кислоты. Что замечаете?
Запишите уравнение реакции цинка и серной кислоты. Назовите получившееся сложное вещество.
Из пробирки, в которой осуществлялась реакция между алюминием и соляной кислотой, отберите 1-2 капли раствора, поместите их на предметное стекло, держа высоко над пламенем, выпарите его. Что осталось? Запишите уравнение. Назовите получившееся сложное вещество.
Сделайте общий вывод об отношении кислот к металлам и ответьте на вопросы ниже. Для этого воспользуйтесь схемой :
K , Ca , Na , Mg , Al
Zn , Fe , Ni , Pb
Cu, Hg, Ag, Pt, Au
Реагируют с водой с выделение водорода
Не реагирует с водой при обычных условия
Не реагирует с водой и растворами соляной и серной кислот
Реагируют с растворами соляной и серной кислот с выделением водорода.
1. Какой из металлов, взятый для опытов, не реагирует с растворами соляной и серной кислот? Какие еще металлы не реагируют с этими кислотами?
2. К какому типу реакций относится взаимодействие кислоты с металлом?
3 .Взаимодействие кислот с оксидами металлов
Оборудование и реактивы:
- Пипетка, предметное стекло
- Раствор серной кислоты
На дно сухой пробирки поместите с помощью стеклянной лопаточки немного (по объему со спичечную головку) порошка оксида меди и прилейте 5 капель раствора серной кислоты. Содержимое пробирки взболтайте. Какого цвета раствор? Если реакция не наблюдается, слегка нагрейте пробирку. Каплю полученного раствора поместите на предметное стекло и, высоко держа над пламенем горелки, нагрейте до появления первый голубых кристаллов. Длительное нагревание не рекомендуется, т.к. происходит образование ядовитых веществ.
Напишите уравнение реакции взаимодействия между оксидом меди и серной кислотой. Назовите полученные вещества
Вопрос: что образуется при взаимодействии кислом с оксидами металлов?
3. Взаимодействия кислот с основаниями
Оборудования и реактивы :
- раствор гидроксида натрия
- раствор уксусной кислоты
В две пробирки налейте по 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли раствора фенолфталеина. В первую пробирку налейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты (СН3СООН). Что наблюдаете?
Напишите уравнения реакций. Назовите получившиеся вещества.
Вопрос: как называется реакция взаимодействия кислот с основаниями?
4. Взаимодействия кислот с солями
Оборудование и реактивы
- раствор карбоната калия
- раствор соляной кислоты
- раствор силиката натрия
- 2 пробирки, пипетки.
В пробирку налейте 1 – 2 мл раствора карбоната калия. Прилейте 1 – 2 мл соляной кислоты. Что наблюдаете?
В пробирку налейте 1 – 2 мл раствора силиката натрия. Прилейте 1 -2 мл соляной кислоты. Что наблюдаете?
Изучение взаимодействия металлов с растворами кислот и солей (практическая работа по химии)

Данная работа является методическим сопровождением к учебному занятию по химии в рамках совершенствования ЗУН по химии в контексте изучения темы "Металлы".Работа включает технологическую карту занятия и инструктивную карту - справку для студентов.В качестве направляющих элементов в работу включены цели занятия,методы и приёмы обучения,а так же комплексно-методическое обеспечение,обозначены тип и форма занятия,детализирован ход занятия.
Просмотр содержимого документа
«Изучение взаимодействия металлов с растворами кислот и солей (практическая работа по химии)»
ТЕХНОЛОГИЧЕСКСЯ КАРТА ЗАНЯТИЯ
Преподаватель
Глухоедова Е.П.
Группа
Тема урока :
Изучение взаимодействия металлов с растворами кислот и солей.
Тип урока :
Урок совершенствования ЗУН.
Форма урока:
Цели урока:
Образовательные
-используя внутри и межпредметные связи, лабораторный эксперимент, совершенствовать знания о способности металлов взаимодействовать с растворами кислот и солей;
- определить взаимосвязи химических свойств металлов со строением их атомов.
Развивающие
- формирование навыков анализировать и делать выводы на основеконкретного химического эксперимента;
- формирование научного типа мышления, владения химической терминологией;
- продолжить развитие навыков составления реакций ионного обмена и ОВР на примере химических свйств металлов;
- продолжить формирование у учащихся способности к самостоятельной образовательной, учебно-исследовательской деятельности, навыков разрешения проблем.
Воспитательные
- продолжить формирование умения продуктивно общаться и взаимодействовать со сверстниками в процессе совместной деятельности; а также формирование навыков аккуратного ведения лабораторного журнала.
Методы и приёмы обучения:
Комплексно-методическое обеспечение:
Методы словесной передачи и слухового восприятия информации (приемы: лекция, беседа);
Методы наглядной передачи и зрительного восприятия информации (приемы: наблюдение, демонстрация);
Методы контроля (приемы: фронтальный опрос, самостоятельная работа).
Периодическая таблица химических элементов Д.И. Менделеева,ряд активности металлов;
Саенко О.Е. Химия для колледжей: учебник. – Ростов-на- Дону: Феникс, 2014г.
Ход занятия
Задачи данного этапа урока
Деятельность преподавателя
Деятельность учащихся
I. Организационный этап 2-3 мин
Мотивация к активной познавательной деятельности
Приветствие. Выявление отсутствующих.
Записывают тему урока .
II. Актуализация знаний 10-15 мин
Используя межпредметные связи (физика), сформировать представление о зависимости физических свойств металлов от их строения.
- формирование научного типа мышления, владения химической терминологией.
Прежде чем изучать химические свойства металлов, давайте вспомним закономерности в строении атомов металлов и общие физические свойства металлов.
Преподаватель раздает по одному тексту с вопросами на каждый ряд. В каждом тексте по 4 вопроса (на 4 группы) Задача – ответить на предложенные вопросы.
Задание 1-й группы (ряда) – закончить данные предложения.
Задание 2-й группы (ряда) – ответить на предложенные вопросы
Задание 3-й группы (ряда) – ответить на предложенные вопросы
- Благодаря металлической связи и металлической кристаллической решетке, металлы обладают общими физическими свойствами. Перечислите эти свойства.
Учащиеся в паре, отвечают на свой вопрос, передают ответ вперёд, первая парта зачитывает ответы ответы.
Отвечают на вопросы:
1. Если провести диагональ в ПСХЭ Д. И. Менделеева от бора к астату, то в левом нижнем углу будут находиться …(металлы)
2. У металлов на внешнем энергетическом уровне находится небольшое количество электронов
(1-2, реже 3-4 электрона)
3. Радиус атомов металлов сравнительно (большой).
4. Металлические свойства с увеличением порядкового номера в периодах ослабевают, а в группах сверху вниз усиливаются.
1. Тип химической связи в металлах? (металлическая) соответственно тип кристаллической решетки в металлах называется (металлической).
2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны)
3.Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия называется (Пластичность)
4.Какую плотность имеют легкие металлы ? (Плотность менее 5 г/см).Самый легкий металл? (Литий)
1.Металлическая связь обусловлена наличием (свободных) электронов.
2.Лучшие проводники электричества среди металлов? (Серебро, медь)
3.Какую температуру плавления имеют тугоплавкие металлы?
( Т плавл. более 1000С). Самый тугоплавкий металл? (Вольфрам).
4. Свойство поверхностью металла отражать световые лучи называется? (Металлический блеск)
Фронтально перечисляют основные физические свойства металлов.
III. Совершенствование знаний, умений и навыков ( в рамках проведения практической работы)- основной этап урока 35-45мин
ание навыков наблюдения и описания химических реакций с помощью естественного (русского, родного) языка и языка химии.
- формирование навыков проводить химический эксперимент
- формирование навыков описания свойств металлов на основе наблюдений за их превращениями;
- формирование навыков анализировать и делать выводы.
-формирование навыков составления уравнений реакций, подтверждающих химические свойства металлов
Учитель проговаривает основные задачи урока (принцип целеполагания):
Мы должны к заключению урока:
-знать общие химические свойства металлов;
-уметь записывать уравнения реакций, характеризующие особые химические свойства металлов;
-наблюдать, анализировать и прогнозировать химический эксперимент;
-получить навыки осуществления цепочек хим. превращений.
Часть 1. Экспериментальный этап
Преподаватель демонстрирует видеоэксперименты особенности взаимодействия различных металлов с кислотами и солями. ,характеризующие реакции взаимодействия
Опыт №1. Взаимодействие металлов с кислотами
Опыт №2. Взаимодействие металлов с растворами солей
Часть 2. Этап первичного применения полученных ЗУН
Групповая работа
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1.Анализируют ход опыта, делают выводы.
2.Описывают предложенный эксперимент.
3.Записывают в бланках уравнения соответствующих реакций.
4.Решают проблему, поясняя: с учетом правил по положению металлов в ряду напряжений:
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt Au
1.Активность металлов определяется по способности их вытеснять водород из состава кислот в зависимости от местонахождения металла в ряду (работа с таблицей «Электрохимический ряд напряжений металлов»).
с учетом правил по положению металлов в ряду напряжения
2.Наиболее активные металлы вытесняют менее активные из их солей (работа с таблицей «Электрохимический ряд напряжений металлов»).
Запись уравнений химических реакций согласно предложенной схеме- работа на месте, фронтально у доски
IV. Закрепление и обобщение полученных знаний. 10-15мин
- формирование навыков применять полученные знания, анализировать и делать выводы
V. Подведение итогов (рефлексия)
4-5 минут
- формирование навыков анализировать и делать выводы, подводить итоги
На этапе закрепления студентам предлагается выполнение индивидуальной работы по изучению химических свойств металлов.
Индивидуальные задания:
Вариант 1
Вариант 2
Фронтальная беседа, приём-кубик Блума
Выполнение работы по изучению химических свойств металлов с использованием инструкций (выполнение индивидуального задания на бланке)
Ответы на вопросы преподавателя в игровой форме.
VI. Домашнее задание. 3-5 мин
- продолжить формирование у учащихся способности к самостоятельной образовательной, деятельности.
Пояснения к домашнему заданию:
1.Подготовить отчёт по работе
2.ЗАПОМНИТЬ! Химические свойства металлов
3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.:
Приложения.
Приложение 1. Задания для групп.
Приложение 2. Инструктивная карта практической работы.
Приложение 1.
Закончите фразу:
Дайте ответ на вопрос:
2.Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (Свободные электроны)
2.Лучшие проводники электричества среди металлов? (Серебро, медь)
Приложение 2.
Практическая работа № 8 (инструктивная карта)
Тема: Изучение взаимодействия металлов с растворами кислот и солей.
Цель: (студент формулирует самостоятельно)
Оборудование: инструктивные карты
Часть 1
Опыт №1. Взаимодействие металлов с кислотами
Реактивы и оборудование: Магний, Аl (гранулы), железо , Zn (гранулы), 40%-ый раствор НCl; пробирки.
В три пронумерованные пробирки нальем 3 мл 40%-го раствора НCl и поместим в каждую гранулы магния, железа и алюминия, соответственно. В маленький кристаллизатор нальём небольшое количество 40%-го раствора НCl .
- в пробирке с магнием:
- в пробирке с железом:
- в пробирке с алюминием:
Проблема: все взятые металлы активны, однако они по-разному реагируют с водой?
Вывод по опыту:
Опыт №2. Взаимодействие металлов с растворами солей
Реактивы и оборудование: Zn (гранулы), Fe (железный гвоздь), (40%-ый раствор сульфата железа (II), пробирки.
В пробирку № 1 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим кусочек железа (железный гвоздь). В пробирку № 2 прильём раствор медного купороса (раствор СuSO4·5Н2О) объёмом 5 мл и добавим гранулу цинка.
Проблема:Все предложенные опыты – это опыты с использованием металла и соли другого металла, напишите уравнения реакции согласно предлож. эксперименту. Опишите наблюдения.
В колбе № 1: СuSO4 + Fe →
В колбе № 2: СuSO4 + Zn →
Часть 2
Задание 1. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Индивидуальные задания:
Задание на дом:
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения,разберите по выбору одно уравнение с позиции ОВР, одно с позиции РИО.:
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- понятие металлической связи; типы кристаллических решеток разных металлов;
- зависимость физических свойств металлов от их строения;
- распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
- характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
- устанавливать связь между строением веществ и их свойствами.
Просмотр содержимого документа
«Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей»
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Периодическая система химических элементов им. Д.И. Менделеева;
Ряд стандартных электродных потенциалов Е 0 ;
Типы кристаллических решеток металлов.
Ряд напряженности металлов.
Тетрадь для практических и контрольных работ.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м 3 ) и тяжелые (от 6000 кг/м 3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е 0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
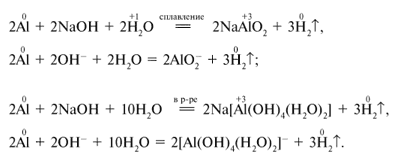
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Вопросы для закрепления теоретического материала к практическому занятию
Перечислить общие физические свойства металлов.
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Отчитаться о выполненной работе преподавателю.
Напишите уравнение реакции взаимодействия металла с кислотой
алюминий + серная кислота
железо + соляная кислота
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
В результате реакции выделяется газ (H2) водород.
Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла
алюминий + железный купорос
железо + медный купорос
Образец решения задания № 2
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
В результате реакции выделяется металлическая медь (красный осадок).
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
Магний оксид магния хлорид магния гидроксид магния сульфат магния
Медь оксид меди сульфат меди гидроксид меди оксид меди
Образец решения задания № 3
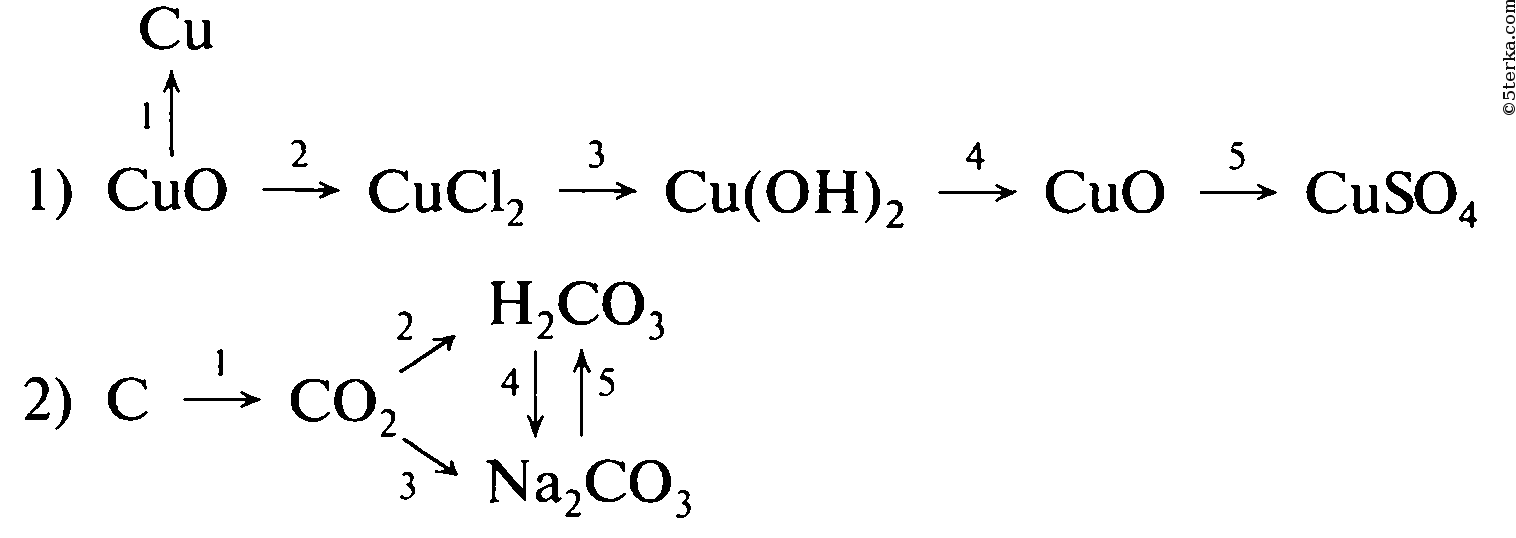
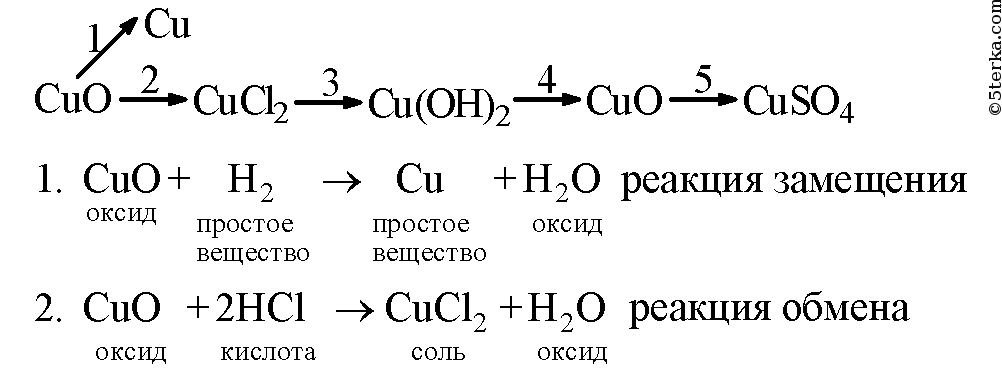
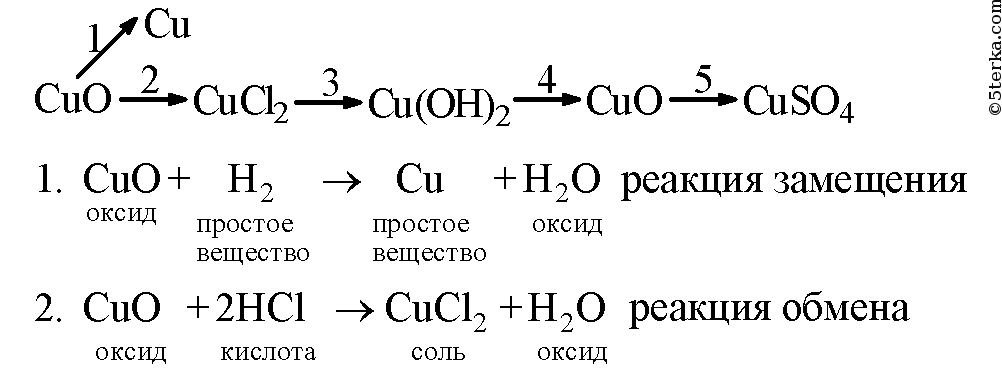
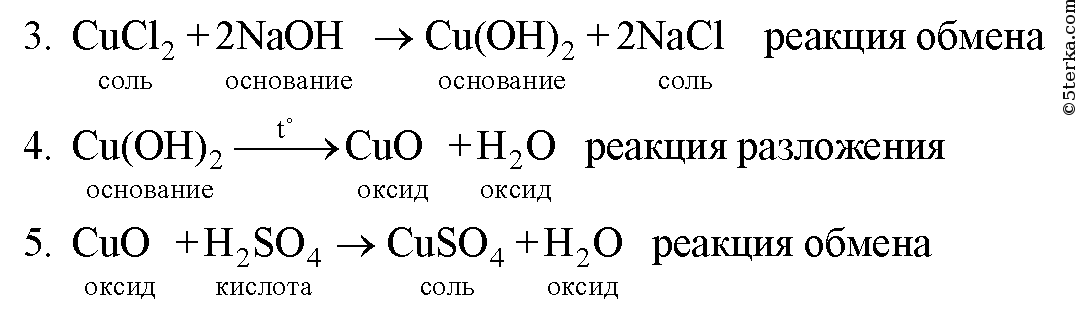
Вопросы для контроля
Перечислите основные химические свойства металлов?
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
Читайте также:
