Преобразование металлической связи обобществляются
Обновлено: 04.10.2024
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
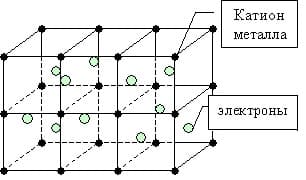
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
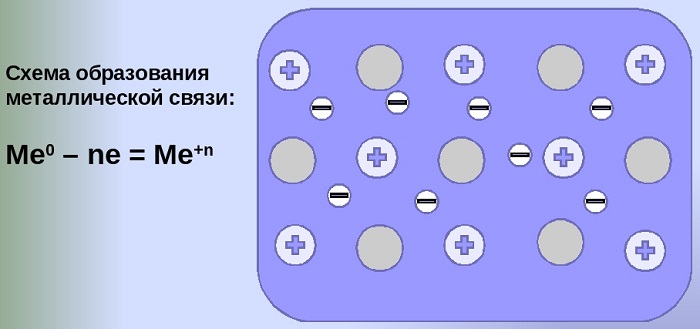
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
Металлические кристаллы подразделяются на 3 основных типа:
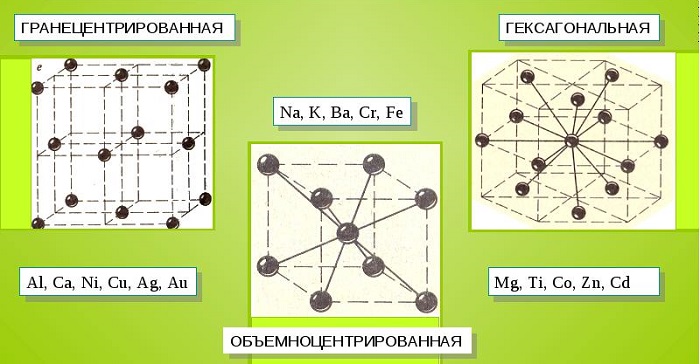
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
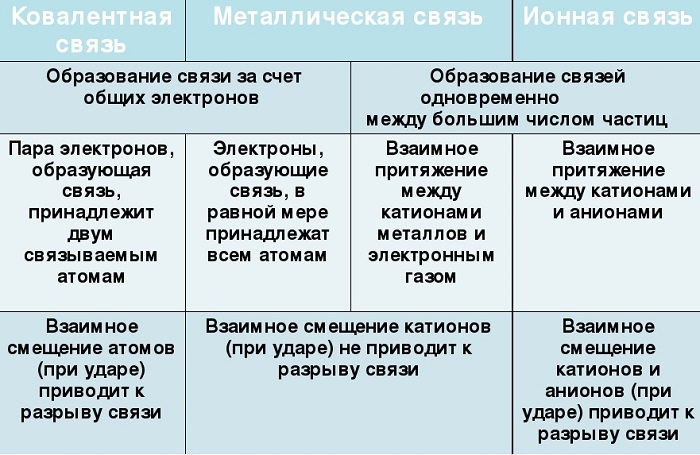
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Металлическая связь это связь, которая удерживает вместе много металлических атомов в любом металлическом веществе.
Обычно самый внешний электрон каждого из металлических атомов отделяется от атома и перекрывается с большим количеством соседних металлических атомов, не будучи связанным с какой-либо конкретной парой атомов.
Другими словами, валентные электроны металлов, образующие металлические связи, не локализованы и способны свободно блуждать по всему кристаллу, образованному такой связью.

Что такое металлическая связь
Все элементы стремятся получить восемь электронов в своей внешней оболочке или валентной оболочке.
Чтобы попытаться получить восемь электронов в их валентной оболочке, атомы всех элементов пытаются образовать связи с другими совместимыми атомами.
Они образуют связи либо путем пожертвования электронов, либо путем обмена электронами. В случае простых металлов, таких как натрий, он отдает электрон и получает положительный заряд.
А затем образует соединения с такими элементами, как хлор, который получает электрон и получает отрицательный заряд. Этот вид связи называется ионной связью .
Иногда атомы, такие как водород и кислород, разделяют электроны, чтобы заполнить их валентную оболочку. Этот вид связи называется ковалентной связью .
Иногда большое количество металлических атомов собирается вместе, и многие электроны в их валентных оболочках отделяются и бродят вокруг оставшихся положительных ионов, таким образом разделяясь между всеми из них.
Этот вид связи называется металлической связью .
Металлическая связь примеры
Атомы после потери электрона становятся положительным ионом, и, таким образом, взаимодействие между такими ионами и электронами приводит к когезионной силе связи, которая удерживает кристалл вместе.
В свободном состоянии металл не существует как один атом. Он либо образует металлические связи с аналогичными атомами, либо образует ионную связь с любым неметаллом.
Не все металлы образуют металлические связи, находясь в свободном состоянии.
Ртуть, например , образует ковалентную связь металл-металл, которая существует в свободном состоянии и существует как Hg2+2.
В 1900-х годах Пол Друд выдвинул теорию о том, что металлические вещества существуют путем образования связей, которые имели “море электронов”, и это точное и принятое изображение в отношении металлических связей.
Эта структура иногда также описывается как “массив положительных ионов в море электронов”.
Металлическая связь описывается как совместное использование электронов на большой площади по сравнению с размером структуры.
И, следовательно, когда эти электроны разделяются, электричество также проводится. Металлическая связь, присутствующая в металлах, является хорошим проводником электричества, поскольку электроны свободно текут и могут хорошо проводить электричество.
Объемные свойства металлов
Металлы имеют несколько свойств, которыми они известны. Некоторые из них-проводимость, ковкость, пластичность, блеск, высокая температура плавления и высокая температура кипения.
Металлы существуют в виде твердой структуры, но их можно легко деформировать. Свойства металлов в свободном состоянии обусловлены расположением электронов в металлической связи.
Поскольку валентные электроны свободны, делокализованы, подвижны и не связаны с каким-либо конкретным атомом, можно объяснить несколько свойств металлов.
Проводимость
В металлических связях электроны могут свободно перемещаться в пределах кристаллов, в которых они существуют.
Это позволяет легко перемещать электрический заряд. Если электроны от любой внешней силы толкаются в металл из-за электрической цепи.
Электроны могут перемещаться через электронное море и выходить с другого конца металла, подключенного к электрической цепи.
Ковкость и пластичность
Если к металлу приложена внешняя сила, море электронов действует как подушка для этой силы. Таким образом, структура металлов не повреждается и не изменяется, протоны только перестраиваются в соответствии с приложенной силой.
Море электронов перестраивается, чтобы приспособиться к новому расположению протонов и, таким образом, сохранить металл нетронутым.
Кристаллическая структура не разрушается, они только деформируются из — за внешней силы. Это причина ковкости и пластичности металлов.
Теплоемкость
Металлы могут проводить тепло, расширяться и сжиматься при нагревании или охлаждении, что позволяет использовать их различными способами.
Эта теплоемкость и тепловое расширение также связаны с тем, что свободные электроны могут перемещаться по твердому телу, облегчая проводимость тепла и расширение, когда электроны энергично движутся.
Блеск
Свободные электроны в море электронов могут свободно поглощать фотоны, и поэтому металлы выглядят непрозрачными.
Электроны на поверхности металла могут отражать свет с той же частотой, с которой свет попадает на его поверхность, и поэтому металлы кажутся блестящими.
Металлическая связь в расплавленном металле
В расплавленном металле, хотя металлическая связь все еще присутствует, упорядоченная структура разрушается.
Но металлическая связь, которая существует в твердой форме металла, не полностью разрушается, пока металл не закипит.
Металлическая связь полностью разрушается, когда металл кипит, но она лишь слегка ослабляется, когда плавится.
Прочность металлических связей
Прочность любой металлической связи зависит от трех факторов:
- Количество электронов, которые делокализуются из металла
- Заряд металлического иона
- Размер металлического иона
Металлические связи очень прочны и требуют большого количества энергии для разрыва, и, следовательно, они имеют высокую температуру плавления и высокую температуру кипения.
Сильная металлическая связь подразумевает большее количество делокализованных электронов, что приводит к увеличению эффективного заряда на катионе, что делает размер катиона меньше.
Растворимость и образование соединений металлов
Если они не вступают в реакцию с ними, металлы не растворяются в воде или любые органические растворители.
Реакция, которая делает металл растворимым, обычно представляет собой реакцию окисления, которая лишает атомы металла их странствующих электронов, тем самым разрушая металлическую связь.
Тем не менее, металлы легко растворимы друг в друге, и они сохраняют металлические характеристики своего соединения.
Например , золото легко растворяется в ртути даже при комнатной температуре. Иногда они сохраняют свои первоначальные свойства, но иногда слияние двух металлов образует металлическое соединение с совершенно другой структурой.
Мы называем их сплавами. Область исследований, касающаяся плавления металлов в сплавы, называется металлургией.
Оптические свойства
Море носителей заряда, то есть электронов, оказывает глубокое влияние на оптические свойства металлов. Мы можем понять это, только если рассмотрим электроны как коллектив, а не отдельные электроны.
Мы все знаем, что свет представляет собой комбинацию электрического и магнитного поля. Электрическое поле света обычно способно возбуждать упругий отклик от электронов, которые существуют в металлическом кристалле.
Таким образом, фотоны не могут проникнуть глубоко в металл и обычно отражаются, в то время как некоторые могут быть поглощены. Этой характеристикой обладают все фотоны видимого спектра.
Именно по этой причине металлы часто бывают серебристо-белого или серовато-белого цвета. Баланс между поглощением и отражением света определяет, насколько они серые или белые.
Серебро, например , является металлом с высокой проводимостью, а также одним из самых белых по цвету.
Заметными исключениями из этого являются красноватая медь и желтое золото. Это связано с существованием верхнего предела частоты, на которую могут реагировать металлические электроны.
Металлическая связь вопросы, ответы?
Примеры металлической связи?
Простые вещества с металлической связью — металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества — интерметаллические соединения (AlCr₂, Ca₂Cu, Cu₅Zn₈ и др.).
Что обобществляется при образовании металлической связи?
Металлическая связь имеет сходство и с ковалентной связью. Это сходство основано на обобществлении электронов, но при образовании ковалентной связи обобществляются внешние неспаренные электроны двух соседних атомов, а при образовании металлической в обобществлении участвуют все атомы.
Каковы свойства металлических связей?
Металлическая связь это сила, которая удерживается вместе внутри металлических элементов. Наличие металлических связей приводит к их свойствам.
Прочность, ковкость, пластичность, тепловая и электрическая проводимость, непрозрачность и блеск являются свойствами металлических связей.
Ковкость это свойство металла, которое может быть сформировано в любую форму без разрушения. Пластичность-это свойство металла деформироваться при растяжении.
Тепловая и электрическая проводимость означает способность металла пропускать тепло или ток через него.
Блеск означает, что металлические связи будут сиять, если какой-либо свет отражается через них. А непрозрачность означает, что она не пропускает свет.
Почему металлические связи сильны?
Из-за металлических связей, присутствующих в элементах, атомы плотно удерживаются вместе. Структура металлов в основном компактна, а атомы расположены в регулярном порядке.
Электроны из внешних оболочек атома делокализуются. Это означает, что они могут свободно перемещаться в любом месте вокруг структуры. И это разделение локализованных электронов между атомами приводит к сильной металлической связи.
Металлические металлы имеют высокую силу притяжения между атомами, и для ее преодоления требуется много энергии.
Как атомы связываются в металлической связи?
В металлической связи атомы удерживаются вместе силой. Металлическая связь возникает, когда есть доля валентных электронов.
Например , если натрий металлически связан с самим собой, третья оболочка до восьмой орбиты является общей друг с другом. И то же самое происходит с любым другим элементом, связывающимся с самим собой.
В основном, когда заряд распределяется на большее расстояние по сравнению с размером атомов, присутствующих в структуре, образуются металлические связи.
Согласно периодической таблице позиционирования, элементы, присутствующие на левой стороне образуют металлические связи.
В чем разница между металлической связью и ионной связью?
Металлическая связь образуется , когда происходит совместное использование электронов по площади. тогда как ионная связь образуется при переносе электронов между двумя химическими веществами.
Ионная связь происходит между положительными и отрицательными ионами, а металлическая связь происходит между положительными ионами и электронами.
Похожие страницы:
Содержание статьи1 Что такое ковалентная связь1.1 Квантовомеханическое рассмотрение ковалентной связи1.2 Образования ковалентной связи Что такое ковалентная связь Существование таких молекул.
Дативная связь Как показывают экспериментальные данные, энергия связи атомов фтора в молекуле F2 меньше энергий связи атомов хлора и брома в.
ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Элементы первой группы периодической системы характеризуются прежде всего одинаковым строением внешнего электронного слоя атомов, в котором.
Содержание статьи1 Химическая связь Строение молекул1.1 Образование молекулы водорода1.1.1 Образование многоатомных молекул Химическая связь Строение молекул Это взаимодействие атомов которая.
Содержание статьи1 Металлы виды1.1 Щелочные металлы1.2 Щёлочноземельные металлы1.3 Переходные металлы1.4 Лёгкие металлы1.5 Полуметаллы1.6 Благородные металлы1.7 Лантаноиды1.8 Актиноиды1.9 Список всех металлов.
Ионная связь это химическая связь между атомами с большой разностью электроотрицательностей, образуется между металлом и не металлами, например реакция натрия.
Виды металлических связей и как они образуются
Все вещества во Вселенной имеют свою структуру строения, а следовательно — и свои свойства. Об особой связи частиц веществ впервые написал Уильям Хиггинс в XVIII веке. Тогда в своем научном труде ученый описал «особую соединительную силу», которая стала основой для возникновения теории о валентности, а позже — теории о химических связях.
Современная химия описывает существование нескольких типов химических связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Атомы металлов между собой объединяются в вещества с появлением новых свойств. При этом связь между атомами-металлами отличается свойствами от ковалентной и ионной связей.
Металлическая связь — особый вид химической связи, возникающий между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов. Металлическая связь встречается в простых веществах металлах и их сплавах.
Металлическая связь формируется за счет частиц двух видов:
Вещества с металлической связью чаще всего представляют собой чистые соединения и сплавы различных металлов, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Атомы металлов имеют ряд особенностей:
- небольшое количество электронов на внешнем электронном уровне;
- большие радиусы.
Благодаря данным характеристикам соединения металлов легко отдают внешние электроны, что позволяет им становиться ионами с положительным зарядом.
По природе происхождения металлическая связь близка к ковалентной, а также к ионным соединениям, но в силу ряда отличий представляет собой отдельный тип химических связей.
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
- ненасыщаема— объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
Виды, особенности образования, как происходит, схема
Металлическая связь не может существовать между отдельными соединенными между собой атомами. Она появляется только в веществах.
При этом связи в этих веществах не отличаются постоянством. Электроны, отделившиеся от атомов металлов, превращаются в «электронный газ», благодаря чему они могут спокойно путешествовать по кристаллической решетке.
Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Характерные кристаллические решетки
Кристаллическая решетка в веществах с металлической связью является основой, неким каркасом кристалла, в узлах которой находятся ионы металла, а между ними в виде «электронного газа» перемещаются отрицательно заряженные электроны, периодически присоединяющиеся к ионам металлов, превращая их в атомы.
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелочноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдрическую решетку.
Физические свойства металлов
Почти все металлы и их сплавы имеют сходные физические свойства:
Читайте также:
