Презентация щелочные металлы 9 класс по габриеляну
Обновлено: 04.10.2024
В презентации отражены важнейшие физические и химические свойства щелочных металлов, показаны закономерности изменения ивойств этих элементов на основании их положения в Периодической системе химических элементов. Также приведены важнейшие соединения щелочных металлов, показаны сферы их применения. Презентация адресована учащимся 9-х классов, изучающих химию по программе Габриеляна, с целью систематизировать и углубить знания в данной теме.
| Вложение | Размер |
|---|---|
| schelochnye-metally.pptx | 827.96 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Щелочные металлы Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б г . Кемерово
Строение и свойства атомов Свойство, изменяющееся в пределах подгруппы Число энергетических уровней Увеличивается Число электронов на внешнем уровне Не изменяется, равно номеру группы (1) Электроотрицательность Уменьшается Высшая степень окисления Равна +1 Металлические свойства Увеличиваются Восстановительные свойства Увеличиваются
ЛИТИЙ РУБИДИЙ НАТРИЙ ЦЕЗИЙ КАЛИЙ
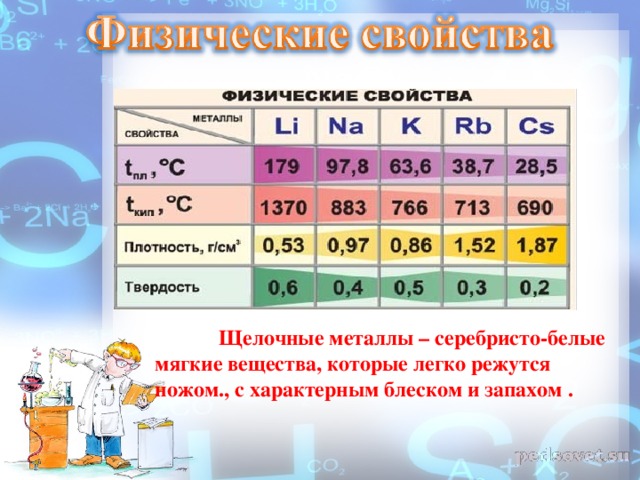
Физические свойства металлы цвет Радиус , нм t пл.,С t кип., C плотность г/см3 твердость литий Сереб-ристо - белый 155 179 137 0,53 0,6 натрий тот же 189 97,8 883 0,97 0,4 калий тот же 236 63,7 766 0,86 0,5 рубидий тот же 248 38,7 713 1,52 0,3 цезий золотисто - белый 267 28,5 690 1,87 0,2 франций В природе не существует в таких количествах, которые достаточны для изучения его свойств.
Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать ножом. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
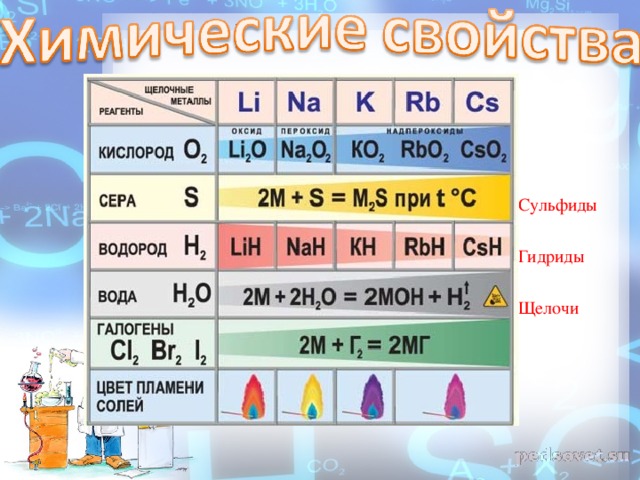
ХИМИЧЕСКИЕ СВОЙСТВА Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту ( Li , Cs ) их хранят под слоем керосина.
1. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий
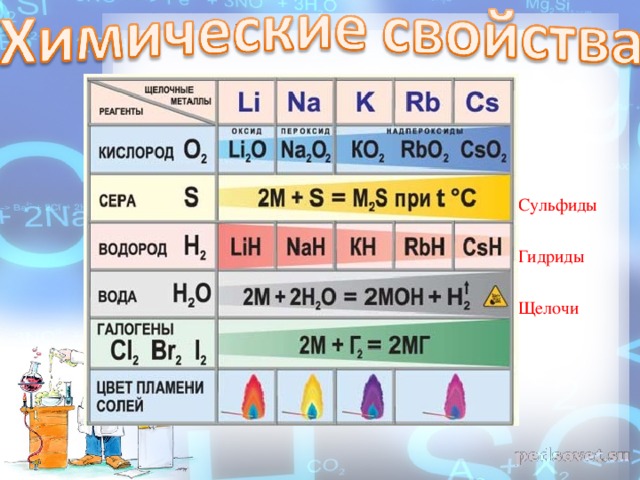
2. С неметаллами С водородом образуют гидриды . Бурно реагируют с хлором и серой.
С кислородом реакция протекает по-разному: Только литий сгорает на воздухе с образованием оксида стехиометрического состава : При горении натрия в основном образуется пероксид натрия В продуктах горения калия , рубидия и цезия содержатся в основном надпероксиды :
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода :
Гидроксиды щелочных металлов Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
Карбонат натрия Карбонат натрия используется в стекольном производстве, мыловарении, в производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Гидрокарбонат натрия Na H C O 3 (другие названия: питьевая сода(E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета .
Хлори́д на́трия — химическое соединение NaCl , натриевая соль соляной кислоты, хлористый натрий. Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль). Применяется для получения неорганических веществ, соды, в пищевой промышленности, в производстве мыла. ХЛОРИД НАТРИЯ
Домашнее задание Параграф 11, упр. 1(б), 2 (письменно)
По теме: методические разработки, презентации и конспекты

Презентация по химии "Расчеты по химическим уравнениям"; 8 класс
Данная презентация выполнена с применением тригеров и гиперссылок. Может применяться при изучении новой темы и при повторении изученного материала.

Контрольная работа по химии по теме "Металлы" для 9 класса к учебнику О.С.Габриеляна
Контрольная работа содержит 2 варианта заданий.

Разработка урока с презентацией по химии для 10 классов (общеобразовательная школа, Габриелян) по теме: "Кислородосодержащие вещества - спирты"
Данная тема урока рассматривается после завершения курса тем по изучению органических веществ – углеводородов. Урок проводится после контрольной работы по изученному ранее материалу и не содержи.
Презентация "Щелочные металлы" 9 класс
презентация к уроку по химии (9 класс) на тему
Щелочные металлы 9 класс Подготовила учитель химии Кузяшева Ю.В
Цель урока Сформировать понятие щелочных металлов Дать сравнительную характеристику щелочным металлам Познакомиться с физическими и химическими свойствами щелочных металлов
Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна металлическая кристаллическая решетка. У атомов металлов на внешнем уровне 1-3 электрона. У атомов металлов на внешнем уровне 1-3 электрона. Металлы являются восстановителями и окислителями. Для металлов характерна металлическая кристаллическая решетка. Металлы обладают электропроводностью и теплопроводностью. При взаимодействии с кислородом металлы принимают электроны. Все металлы активно взаимодействуют с кислотами. Металлы С u, Au, Ag не взаимодействуют с водой даже при нагревании. М g, Be находятся в главной подгруппе II группы Уберите неверное
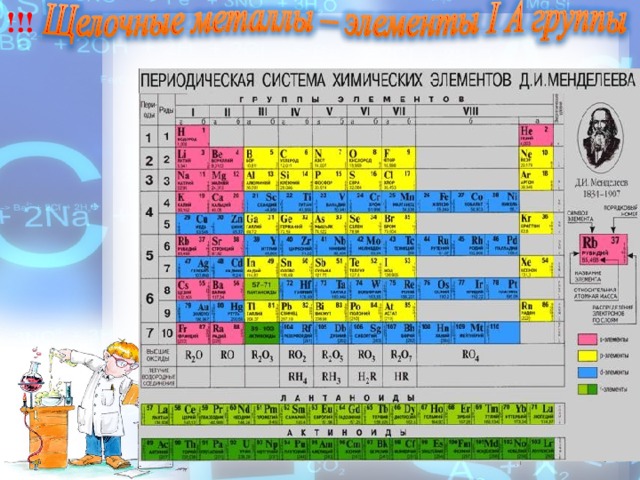
Щелочные металлы — это элементы главной подгруппы I группы литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs , франций Fr. Название группы связано с тем, что при взаимодействии этих металлов с водой образуются едкие вещества - щелочи
Как изменяются металлические свойства в группе?
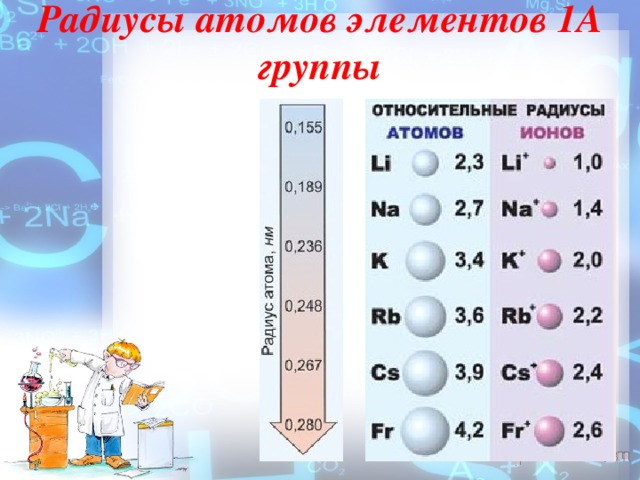
Радиусы атомов элементов 1А группы
Сравнение свойств Что общего в атомном строении щелочных металлов? Как изменяется химическая активность этих элементов?
ИСТОРИЯ ОТКРЫТИЯ Натрий и калий – 1807г. Английский химик и физик Г.Дэви получил их в виде металлов при электролизе расплавленного едкого натра NaOH и едкого кали КОН. Литий открыт в 1817г. шведским химиком И. Арфведсон. Этот минерал выглядит как самый обыкновенный камень, и поэтому металл назвали литием, от греческого «литос» - камень.
ИСТОРИЯ ОТКРЫТИЯ Рубидий – 1863 г. Р. Бунзен и Г.Кирхгофф обнаружили с помощью спектрального анализа, а затем выделили в чистом виде из минерала лепидолит (фторсиликат лития и алюминия) Цезий - 1882 г. Р. Бунзен и Г.Кирхгофф обнаружили с помощью спектрального анализа, а затем выделили в чистом виде из солей, полученных из минеральных вод.
ИСТОРИЯ ОТКРЫТИЯ Франций - Этот элемент был предсказан Д.И.Менделеевым и был открыт в 1939 г. Маргаритой Пере , сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины – франций . . Микроскопические количества изотопов франция-223 и 224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Происхождение названий Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" - сода К (1807) араб. "алкали" - щелочь Rb (1861) лат. "рубидус" - темно-красный Cs (1860) лат. "цезиус" - небесно-голубой Fr (1939) от названия страны Франция – его на Земле всего 25 мг.
Изменение физических свойств
Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника
Применение щелочных металлов
Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Д ля получения перекиси калия К атализатор Термическое получение металлов Теплоноситель в ядерных реакторах
Нахождение в природе В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.
Оксид лития Оксид натрия Оксиды щелочных металлов Составьте общую формулу оксидов .
KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Гидроксиды щелочных металлов Какова общая формула гидроксидов?
НЕМНОГО ИСТОРИИ Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты». М.В.Ломоносов писал, что в его время за четыре-пять плиток соли можно было купить раба. Многие племена в Центральной Африке отдавали за чашку соли чашку золота. В Китае XIII века из каменной соли делали монеты.
Поваренная соль и география Поваренная соль известна человеку с незапамятных времен, и название ее сходно во многих языках. В честь соли названы многие города, реки и озера: Солигалич, Соликамск, Сольвычегорск, Соль-Илецк, Сольцы, Усолье и Усолье-Сибирское, реки Усолка и Соленая и многие другие.
Поваренная соль в организме человека Соль – обязательная составная часть организма человека. Соль поддерживает нормальную деятельность клеток, из которых состоят все ткани и органы. Из соли в желудке вырабатывается соляная кислота, без которой невозможно переваривание пищи. Суточная потребность в поваренной соли для взрослого человека составляет 10 – 15 грамм.
Применение поваренной соли Производство химических веществ --- соляной кислоты --- гидроксида натрия --- хлора --- соды Для консервирования Приправа к пище Производство мыла
Сколько нужно времени для того, чтобы съесть пуд соли? Есть поговорка: «Чтобы хорошо узнать человека, надо съесть с ним пуд соли». Оказывается это можно сделать всего за год с небольшим. Ведь потребность соли для нормального питания человека составляет не менее 7 килограммов в год.
Презентация "Щелочные металлы"
презентация к уроку по химии (9 класс) по теме
Центр дистанционного образования детей-инвалидов при ОГАОУ «Белгородский инженерный юношеский лицей-интернат» ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнила: Быкова О.С., учитель химии
Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать понятие о физических и химических свойствах щелочных металлов.
Строение и свойства атомов
Щелочные металлы — это элементы главной подгруппы I группы : литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs , франций Fr.
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Щелочные металлы - простые вещества
Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Взаимодействие с неметаллами
Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na + O2 = Na2O2, калий, рубидий и цезий – надпероксид: K + O2 = KO2.
Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na + H2 = 2NaH, с серой – сульфиды: 2K + S = K2S, с фосфором – фосфиды: 3K + P = K3P, с кремнием – силициды: 4Cs + Si = Cs4Si, с углеродом карбиды образуют литий и натрий: 2Li + 2C = Li2C2
С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития: 6Li + N2 = 2Li3N. С галогенами все щелочные металлы образуют галогениды: 2Na + Cl2 = 2NaCl.
Взаимодействие с водой
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой. При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно. Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся. Взаимодействие с кислотами
Соединения щелочных металлов В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях , природных водах.
Гидроксид натрия NаОН в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали. Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами. Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твердые кристаллические вещества ионного строения. . Nа2СO3 — карбонат натрия , образует кристаллогидрат Nа2СO3* 10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3 , она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла. Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.
NаСl — хлорид натрия , или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту.
Щелочные металлы 9 класс

Презентация к уроку химии в 9 классе для учащихся, которые занимаются по программа Олега Сергеевича Габриеляна. Презентация насыщена красочными слайдами, содержит материалы из истории открытия, строении атома, физические и химические свойства. Является очень важным компонентом урока химии, обеспечивая наглядность
Просмотр содержимого документа
«Щелочные металлы 9 класс »

ТЕМА УРОКА : «Щелочные металлы»
Учитель биологии и химии Соколов А.М.
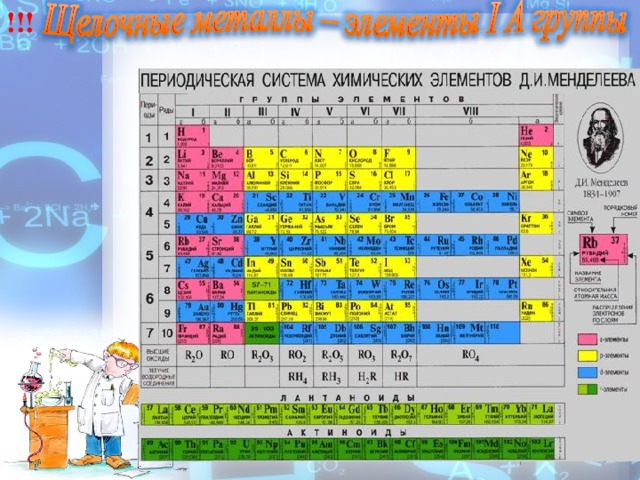
Как изменяются свойства элементов в главных подгруппах сверху вниз?
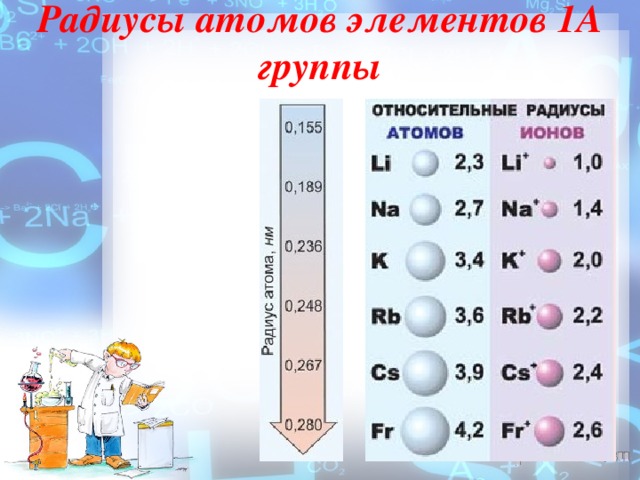
Радиусы атомов элементов 1А группы


А) заряд ядра
Li * Rb ; Na * Al
Б) число электронных слоев
В) число электронов на внешнем уровне
Г) радиус атома
Д) восстановительные свойства
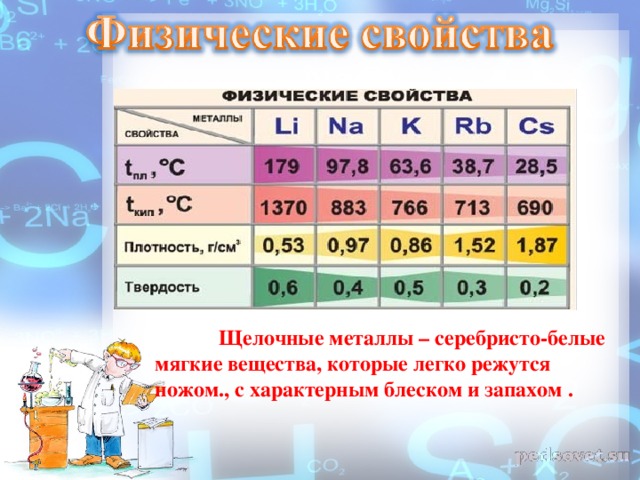
Щелочные металлы – серебристо-белые мягкие вещества, которые легко режутся ножом., с характерным блеском и запахом .
Домашнее задание
П.11 (страница 52-54), записи в тетради учить. Стр. 58 №1(а), №2.
"Щелочные металлы"
Презентация к уроку химии в 9 классе по теме Щелочные металлы, их свойства физические и химические" Презентация разработана для учащихся, которые занимаются по программа О.С. Габриеляна. Содержит красочные слайды и видеофрагменты опытов. Является очень хорошим наглядным пособием при изучении нового материала
Просмотр содержимого документа
«"Щелочные металлы" »

Учитель биологии и химии Сергеева А.А.


Читайте также:
