При нагревании кремний реагирует с металлами химический элемент простое вещество
Обновлено: 17.05.2024
Кремний в химии имеет обозначение Si (силициум) от латинского слова silex «кремень». Это типичный неметалл, элемент 14 группы (по прежней классификации — главной подгруппы IV группы) и третьего периода периодической системы Д.И. Менделеева. Атомный номер 14. Атомная масса 28,09.
Рисунок 1. Структура кремния и его внешний вид.
Физические свойства кремния. Аллотропные модификации кремния
Кремний имеет две аллотропные модификации:
- Кристаллический — свойства обусловлены наличием кубической кристаллической решетки. Атомы расположены на вершине и в центре каждой грани, прочно связаны друг с другом ковалентной связью.
- Аморфный — порошок бурого цвета на основе разупорядоченной кристаллической структуры. Гигроскопичный, активнее вступает в реакции.
Таблица 1. Основные физические параметры кристаллического кремния.
Химические свойства Si
Определяются положением кремния в периодической системе Д.И. Менделеева и строением атома: электронная формула 1s2 2s2 2p6 3s2 3p2. Проявляет степени окисления: -4, 0, +2, +4. Валентность: II и IV.
Окислительные свойства кремний проявляет в реакциях с активными металлами:
S i + 2 M g → t ° M g 2 S i - 4 силицид магния;
С водородом не реагирует, но при растворении силицидов в кислотах образуется силан:
M g 2 S i + 4 H C l → 2 M g C l 2 + S i H 4 силан.
Восстановительные свойства кремния.
- +галогены (Cl, Br, J) при нагревании, со фтором при комнатной температуре:
S i + 2 F 2 → S i F 4 тетрафторид кремния;
- при избытке кислорода: S i + O 2 → 600 ° С S i O 2 оксид кремния IV;
- при недостатке кислорода: 2 S i + O 2 → 400 ° С 2 S i O монооксид кремния;
- образование бинарных соединений:
- +сера: S i + S → 600 ° С S i S 2 сульфид кремния;
- +азот: 3 S i + 2 N 2 → 1300 ° С S i 3 N 4 нитрид кремния;
- +углерод: S i + C → 2000 ° С S i C карбид кремния (карборунд);
- +щелочи при кипячении:
- S i + 4 N a O H к о н ц → t ° N a 4 S i O 4 + 2 H 2 ↑ ;
- S i + 2 K O H + H 2 O → t ° K 2 S i O 3 + 2 H 2 ↑ ;
- с кислотами не реагирует. Растворяется только в смеси плавиковой и азотной кислот:
3 S i + 4 H N O 3 + 18 H F → 3 H 2 [ S i F 6 ] + 4 N O + 8 H 2 O .
Нахождение в природе
Кремний в чистом виде (как самородный минерал) встречается крайне редко. Но, соединяясь с кислородом, он образует S i O 2 — кремнезем, входящий в состав многих минералов: песок, кварц, полевой шпат, слюда, некоторые поделочные и полудрагоценные камни: яшма, гранат, турмалин и др., что обуславливает высокое (не менее 26%) содержание кремния в земной коре.
Рисунок 2. Оксид кремния IV в природе.
Содержание кремния в морской воде достигает 3 мг/л, поэтому он накапливается в кремниевых губках, диатомовых водорослях, радиоляриях.
Пищевые продукты, содержащие кремний: овес, огурцы, рис, пшеница, лук, семя льна, авокадо и др.
Технология получения
В лабораторных условиях кремний получают:
- прокаливанием белого песка (оксид кремния IV) с металлическим магнием:
2 M g + S i O 2 → t ° S i ↓ + 2 M g O ;
- восстановлением из оксида кремния IV с помощью алюминия:
2 A l + S i O 2 → t ° S i ↓ + A l 2 O 3 .
Промышленные способы получения кремния:
S i O 2 + 2 C к о к с → t ° 2 C O ↑ + S i ↓ .
Однако, такой кремний имеет примеси карбида кремния и не подходит для производства микросхем.
Продукт со степенью чистоты до 99,9% получают:
- восстановлением водородом или цинком из S i C l 4 :
S i C l 4 + 2 H 2 → 1200 ° С S i ↓ + 4 H C l ;
S i H 4 → t ° S i ↓ + 2 H 2 ↑ .
Важные соединения кремния
Оксид кремния (IV) S i O 2 имеет атомное строение, высокий показатель твердости, тугоплавкий (плавится при температуре 1730 °С). Кислотный оксид, соответствует кремниевой кислоте.
- в промышленности — нагреванием кремния в атмосфере кислорода:
S i + O 2 → 600 ° С S i O 2 .
- в лабораториях — взаимодействие силиката натрия с уксусной кислотой. Кремниевая кислота сразу распадается на воду и S i O 2 , который выпадает в осадок:
- N a 2 S i O 3 + C H 3 C O O H → C H 3 C O O N a + H 2 S i O 3 ↓ ;
- H 2 S i O 3 → S i O 2 ↓ + H 2 O .
Химические свойства SiO2:
- не растворяется в кислотах, реагирует только с плавиковой кислотой и газообразным фтороводородом:
- S i O 2 + 6 H F ж и д → Н 2 [ S i F 6 ] + 2 H 2 O ;
- S i O 2 + 4 H F г а з → S i F 4 + 2 H 2 O ;
- при взаимодействии с основными оксидами и щелочами, а также с карбонатами образуются соли кремниевой кислоты — силикаты:
- C a O + S i O 2 → C a S i O 3 силикат кальция;
- 2 К O H + S i O 2 → K 2 S i O 3 силикат калия + H 2 O ;
- N a 2 C O 3 + S i O 2 → N a 2 S i O 3 силикат натрия + C O 2 ↑ .
На реакции с карбонатами основано получение оконного стекла — смесь из соды, известняка и белого песка прокаливают при температуре, равной 1500 °С:
N a 2 C O 3 + C a C O 3 + 6 S i O 2 → t ° N a 2 O · C a O · 6 S i O 2 + 2 C O 2 ↑ .
Кремниевая кислота и ее соли — силикаты.
Кремниевая кислота H 2 S i O 3 — слабая, малорастворимая. Легко распадается на оксид и воду, при подсыхании превращается в студенистое вещество — силикагель. Получают при взаимодействии кислот (в том числе, угольной) с растворимыми силикатами щелочных металлов:
N a 2 S i O 3 + 2 H C l → 2 N a C l + H 2 S i O 3 ↓ .
Кремниевая кислота реагирует только с сильными основаниями и их оксидами, образуя силикаты:
H 2 S i O 3 + L i O H → L i 2 S i O 3 + 2 H 2 O .
Силикаты, кроме N a 2 S i O 3 и K 2 S i O 3 (их называют жидким стеклом), нерастворимы в воде. Получают следующими методами:
- взаимодействие кремния, оксида кремния или кремниевой кислоты с щелочами:
- S i + 2 N a O H + 2 H 2 O → t ° N a 2 S i O 3 силикат натрия + 2 H 2 ↑ ;
- 2 L i O H + S i O 2 → L i 2 S i O 3 силикат лития + H 2 O ;
- 2 K O H + H 2 S i O 3 → K 2 S i O 3 силикат калия + 2 H 2 O ;
- сплавление оксида кремния с основными оксидами:
M g O + S i O 2 → M g S i O 3 с и л и к а т м а г н и я ;
K 2 S i O 3 + C a C l 2 → C a S i O 3 с и л и к а т к а л ь ц и я + 2 K C l .
Силициды — это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Тип химической связи — ионная.
Получают при сплавлении простых веществ или восстановлением смеси оксидов коксом в электропечах:
- S i + 2 C a → t ° C a 2 S i - 4 силицид кальция;
- 2 M g O + S i O 2 + 4 C → M g 2 S i силицид магния + 4 C O .
Вступают в реакцию:
- с водой (гидролиз): M g 2 S i + 4 H 2 O → 2 M g ( O H ) 2 + S i H 4 ;
- с кислотами: C a 2 S i + 4 H C l → 2 C a C l 2 + S i H 4 .
Силан — это бинарное соединение кремния с водородом S i H 4 , ядовитый бесцветный газ.
Если к порошку силицида магния добавить разбавленную соляную кислоту, то на поверхности раствора образуются пузырьки силана. Они лопаются и загораются на воздухе.
- M g 2 S i + 4 H C l → 2 M g C l 2 + S i H 4 силан;
- S i H 4 + 2 O 2 → S i O 2 + 2 H 2 O — горение силана.
Химические свойства силана:
- + H 2 O : S i H 4 + 2 H 2 O → S i O 2 + 4 H 2 ;
- +щелочи: 2 S i H 4 + 2 N a O H + H 2 O → N a 2 S i O 3 + 4 H ;
- разложение при нагревании: S i H 4 → S i + 2 H 2 .
5. Карборунд SiC имеет атомный тип кристаллической решетки, сходный с алмазной. Твердый, плавится при температуре 2730 °С.
Получают по схеме:
S i + C → 2000 ° С S i C .
- при высокой температуре: S i C + 2 O 2 → t ° S i O 2 + C O 2 ;
- в расплаве щелочи: S i C + 2 O 2 + 4 N a O H → N a 2 S i O 3 + N a 2 C O 3 + 2 H 2 O .
Применение кремния и его соединений — силикатная промышленность.
Кремний используют в металлургии — добавка к стали и другим сплавам; в электронике — изготовление полупроводниковых приборов, радиодеталей и солнечных батарей.
Кремний необходим для поддержания здоровья кожи, волос и ногтей. Кремний участвует в формировании костей, повышает эластичность и прочность кровеносных сосудов, что используется в профилактике сердечно-сосудистых заболеваний.
Диоксид кремния:
- производство стекла, керамики, бетона и кирпича. Из керамики, помимо посуды и декоративных изделий, производят изоляторы для высоковольтных ЛЭП и другие изделия, используемые в технике и строительстве;
- чистый кварц используется в приборостроении;
- производство косметики: как эмульгатор и компонент против слеживания.
Силициды входят в состав жаропрочных и кислотоустойчивых сплавов и высокотемпературных полупроводниковых материалов.
Карбид кремния используют как абразив при затачивании резцов металлорежущих станков и шлифовки драгоценных камней, а также в качестве имитации алмаза в ювелирном деле.
Кремний. Химия кремния и его соединений

Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии :

+14Si 1s 2 2s 2 2p 6 3s 2 3p 2
Электронная конфигурация кремния в возбужденном состоянии :

+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:

Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Na 2 SiO 3 + 2 HCl → H 2 SiO 3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Соединения кремния

Кремний – активный неметалл, вступающий в реакции с металлами и неметаллами. Соединения кремния в зависимости от входящих в состав веществ называются силанами, силицидами, силикатами.
Простое вещество
Кремний (Si) – хрупкое кристаллическое вещество. Имеет переменную валентность II и IV. Электроны располагаются на трёх энергетических уровнях. Четыре валентных электрона находятся на s- и p-подуровнях. Электронная конфигурация элемента – 1s 2 2s 2 2p 6 3s 2 3p 2 .
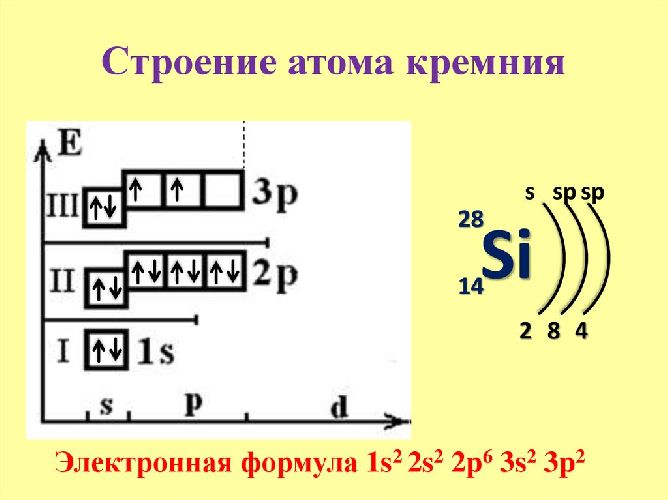
Рис. 1. Электронное строение кремния.
В реакциях с металлами кремний проявляет свойства окислителя и имеет отрицательную степень окисления -4. С галогенами и неметаллами кремний ведёт себя как восстановитель и имеет степень окисления +4. Третья степень окисления +2 проявляется в монооксиде кремния.
Соединения
Общая характеристика соединений кремния представлена в таблице.

Рис. 2. Силициды.
Вещество
Формула
Физические свойства
Химические свойства
Монооксид, оксид кремния (II) или кремнезём
Аморфное вещество. Не проводит электричество, не образует соли. Растворяется в плавиковой кислоте. При нагревании разлагается на кислород и кремний
Реагирует при нагревании:
– с углекислым газом: SiO + СО2 → SiO2 + CO;
Диоксид, оксид кремния (IV) или песок
Кристаллическое тугоплавкое вещество. Не растворяется в воде. Диэлектрик
– С металлами: SiO2 + 2Mg → Si + 2MgO;
– с оксидами: SiO2 + CaO → CaSiO3;
Образует гомологичный ряд с общей формулой SinH2n+2. Ядовитый бесцветный газ с запахом, воспламеняется на воздухе. Нерастворим в холодной воде. Разлагается при нагревании и в горячей воде
– с концентрированным гидроксидом натрия: SiH4 + 4NaOH → Na4SiO4 + 4H2;
– с перманганатом калия: 3SiH4 + 8KMnO4 → 8MnO2 + 3SiO2 + 8KOH + 2H2O
Карборунд или карбид кремния
Тугоплавкое твёрдое вещество. Кристаллическая решётка схожа с решёткой алмаза. Полупроводник
– С водяным паром при высокой температуре: SiC + 2H2O → SiO2 + CH4;
– с концентрированными кислотами: 3SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O;
– со щелочами в присутствии кислорода: SiC + 4NaOH + O2 → Na4SiO4 + C + 2H2O;
– с кислородом при нагревании: 2SiC + 3O2 → 2SiO2 + 2CO
– с металлами при нагревании: 2SiC + 5Mg → 2Mg2Si + MgC2;
– с галогенами при нагревании: SiC + 2Cl2 → SiCl4 + C
Соединения с активными металлами. Электропроводны
Mg2Si не реагирует с водой, но взаимодействует с разбавленными кислотами
Условно называются гидроксидами кремния. Существует несколько видов. Наиболее известные метакремниевая (H2SiO3) и ортокремниевая (H4SiO4) кислоты. Слабые, без кислого вкуса. Плохо растворимы в воде. Не меняют цвет индикатора
– Растворяются в растворах и расплавах щелочей: H2SiO3 + 2KOH → K2SiO3 + 2H2O;
Соли кремниевых кислот. Твёрдые вещества, входящие в состав земной коры. Тугоплавки
В природе наиболее распространённое вещество – песок. Кварц, аметист, агат, хрусталь и другие вещества являются модификацией песка.

Рис. 3. Кварц.
Что мы узнали?
Из урока 9 класса узнали, какие вещества образует кремний. Элемент активно взаимодействует с металлами и неметаллами, образуя оксиды, кислоты, силаны, силициды, силикаты. В зависимости от реакции кремний проявляет свойства восстановителя или окислителя и имеет степени окисления +2, +4, -4. Большинство веществ – твёрдые тугоплавкие вещества, плохо растворимые в воде. Кислоты кремния – слабокислые жидкости, силаны – газы с неприятным запахом. За счёт активности кремний встречается в природе только в составе сложных веществ.
Химические свойства кремния

Кремний – твёрдый неметалл, входящий в состав горных пород. При обычных условиях инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния использует силикатная промышленность для изготовления стекла, зеркал, электроники, строительного материала.
Общее описание элемента
Кремний расположен в четвёртой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движется 14 отрицательно заряженных электронов.
Атом может переходить в возбуждённое состояние за счёт свободного d-подуровня. Поэтому элемент проявляет две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1s 2 2s 2 2p 6 3s 2 3p 2 .
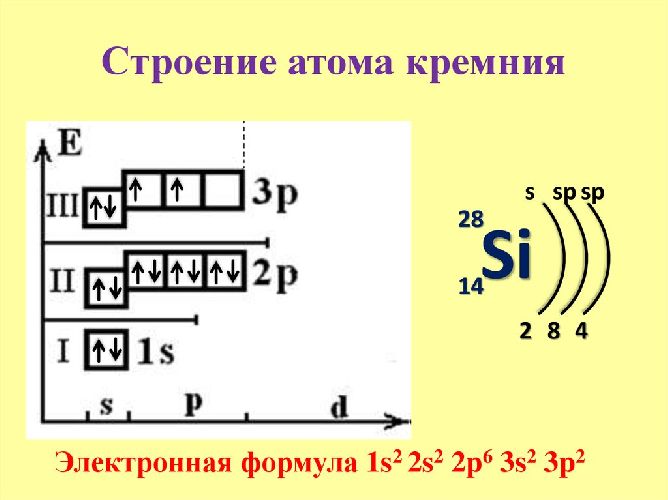
Рис. 1. Строение атома кремния.
Кремний – хрупкий полупроводник с высокими температурами правления и кипения. Относительно лёгкий неметалл: плотность составляет 2,33 г/см 3 .

Рис. 2. Агат.
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
Элемент
Описание
Реакция
При обычных условиях
Взаимодействует при 600°C с образованием диоксида (песка)
Реагирует при 400°C
Реагирует при 2000°C с образованием карборунда
Протекает при 1000°C
Реагирует при 1000°C
Взаимодействует при 2000°C
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
Уравнение
Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С
Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот
В водных растворах растворяется, образуя силикаты и водород
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.
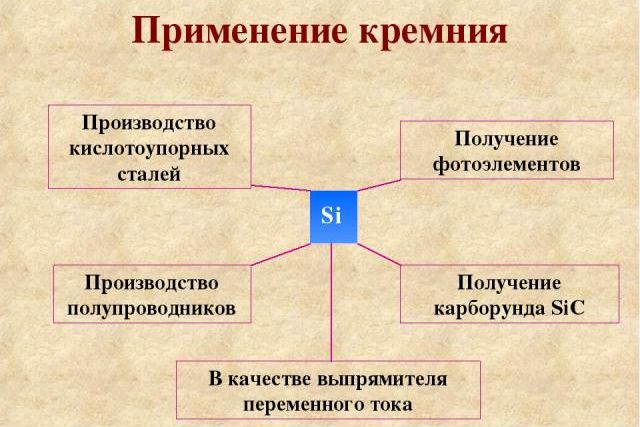
Рис. 3. Применение кремния.
Кремний – хрупкий неметалл, взаимодействующий с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, с неметаллами – восстановителя. Реагирует при нормальных условиях только с фтором, плавиковой кислотой (в том числе вместе с азотной кислотой), со щелочами. Остальные реакции протекают при повышенных температурах.
Характеристика элемента кремния

Кремний – химический элемент IV группы периодической системы Менделеева, атомный номер 14, масса атома 28,0855. Какими же свойствами обладает кремний, и каковы его характеристики?
Общая химическая характеристика кремния
Кремний – это элемент третьего периода IVА группы, р-элемент. В атоме кремния есть пять незанятых d-орбиталей. С их участием кремний образует соединения, в которых его координационное число равно 6. Для кремния характерно образование цепей, в которых чередуются атомы кремния и кислорода, соединенные прочными связями.

Рис. 1. Кремний.
Кремний в природе встречается в связанном виде: земная кора более чем наполовину состоит из кремнезема SiO2, силикатных алюмосиликатных пород типа каолинита Al2O3*2SiO2*2H2O, главных составных частей песка и глины.
Название этот элемент получил от минерала с латинским названием silisium (silex – означает кремень). Русское название «кремний» введено в 1834 году. академиком Г. И. Гессом.
Физические свойства
Известен аморфный и кристаллический кремний. Характер кристаллического кремния состоит в том, что это темно-серое с металлическим блеском, тугоплавкое, хрупкое кристаллическое вещество, обладающее незначительной проводимостью.
Расположение атомов Si такое же, как атомов С в алмазе. Каждый атом кремния находится в центре тетраэдра и связан ковалентно с четырьмя другими атомами кремния. Аморфный кремний – бурый порошок, который является более реакционноспособным.
У кремния в природе встречаются три стабильных изотопа
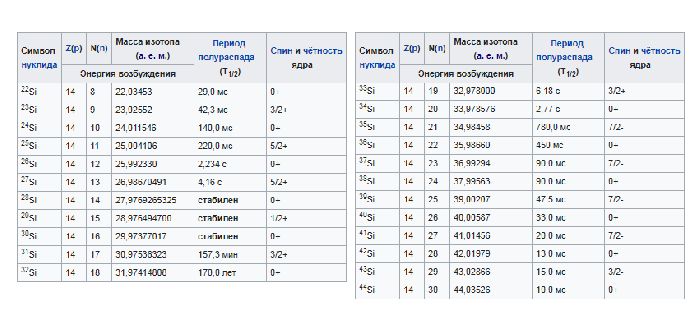
Рис. 2. Изотопы кремния.
Химические свойства
Так как у атома кремния на внешнем энергетическом уровне имеется четыре электрона, то характерными степенями окисления его являются +4 и -4.
В соединениях кремний проявляет валентность IV, вступая при нагревании во взаимодействие с простыми веществами (фтором, хлором, кислородом, углеродом).
При обычных условиях из простых веществ кремний реагирует лишь с фтором:
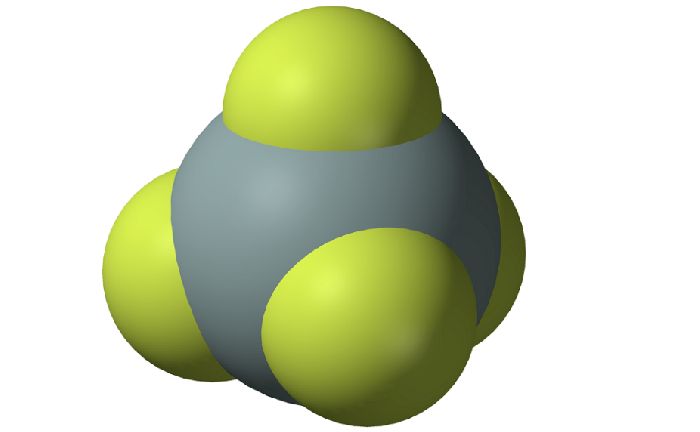
Рис. 3. Тетрафторид кремния.
С кислородом и фтором реакции протекают при +400-+600 градусах:
Si+2Cl=SiCl4 (тетрахлорид кремния)
С кислотами кремний не реагирует. Только аморфный кремний, измельченный в порошок, реагирует с фтороводородной кислотой.
Кремний взаимодействует с горячими растворами щелочей, образуя силикаты и водород:
Со многими металлами кремний химически взаимодействует, образуя силициды:
2Mg+Si=Mg2Si (силицид магния)
При действии соляной кислоты на силицид магния Mg2Si образуется силан SiH4:
Силан – бесцветный ядовитый газ, аналог метана, самовоспламеняющийся на воздухе и сгорающий с образованием оксида кремния и воды:
В статье описываются физические и химические характеристики элемента кремния. Валентность кремния почти всегда IV , и лишь в некоторых соединениях проявляется валентность II. Кремний при нагревании температуры способен реагировать с металлами, неметаллами и щелочами.
Читайте также:
