Процесс перехода металла из жидкого состояния в твердое называется
Обновлено: 18.05.2024
Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией.
Процесс кристаллизации состоит из двух одновременно идущих процессов - зарождения и роста кристаллов. Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или расти на имеющихся готовых центрах кристаллизации (несамопроизвольная кристаллизация).
Самопроизвольная кристаллизация
Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала G. С повышением температуры термодинамический потенциал вещества как в твердом, так и в жидком состоянии уменьшается, что показано на рисунке.
Изменение термодинамического потенциала в зависимости от температуры для металла в твердом и жидком состояниях
Температура, при которой термодинамические потенциалы вещества в твердом и жидком состояниях равны, называется равновесной температурой кристаллизации. Кристаллизация происходит в том случае, если термодинамический потенциал вещества в твердом состоянии будет меньше термодинамического потенциала вещества в жидком состоянии, т. е. при переохлаждении жидкого металла до температур ниже равновесной. Плавление - процесс, обратный кристаллизации, происходит при температуре выше равновесной, т. е. при перегреве. Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом.
Поскольку жидкий металл с присущим ему ближним порядком в расположении атомов обладает большей внутренней энергией, чем твердый со структурой дальнего порядка, при кристаллизации выделяется теплота. Между теплотой и температурой кристаллизации Тк существует определенная связь. Так как при равновесной температуре кристаллизации термодинамические потенциалы в жидком и твердом состояниях равны, то
Рекомендуемые материалы
Параметр ΔS = Q/TK характеризует упорядоченность в расположении атомов при кристаллизации. В зависимости от сил межатомной связи теплота кристаллизации для различных металлов изменяется от 2500 Дж/моль (Na, К и др.) до 20000 Дж/моль (W и др.).
Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. В связи с этим на кривой охлаждения, изображаемой в координатах температура-время, процессу кристаллизации соответствует горизонтальный участок:

Кривые охлаждения металла
При большом объеме жидкого металла выделяющаяся при кристаллизации теплота повышает температуру практически до равновесной (кривая а); при малом объеме металла выделяющейся теплоты недостаточно, вследствие чего кристаллизация происходит с переохлаждением по сравнению с равновесной температурой (кривая б).
Разница между равновесной (Ts) и реальной (Тn) температурой кристаллизации называется степенью переохлаждения ΔT. Степень переохлаждения зависит от природы металла. Она увеличивается с повышением чистоты металла и с ростом скорости охлаждения. Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30 °С; при больших скоростях охлаждения она может достигать сотен градусов.
Степень перегрева при плавлении металлов, как правило, не превышает нескольких градусов.
В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объема, в пределах которых расположение атомов вещества во многом аналогично их расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них, наиболее крупные, становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Образованию зародышей способствуют флуктуации энергии, т. е. отклонения энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения. Размер образовавшегося зародыша зависит от величины зоны флуктуации.
Появление центров изменяет термодинамический потенциал системы ΔGобщ. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал уменьшается на VΔGυ (G1), с другой стороны, он увеличивается вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем на величину, равную Sσ (G2):

где V-объем зародыша; S-поверхность зародыша; σ-удельное поверхностное натяжение на границе кристалл-жидкость; ΔGυ-удельная разность термодинамических потенциалов при переходе жидкости в кристаллическое состояние.
Изменение термодинамического потенциала при образовании зародышей в зависимости от их размера
Если принять, что зародыш имеет форму куба с ребром А, то общее изменение термодинамического потенциала
Отсюда следует, что графическая зависимость изменения термодинамического потенциала от размера зародыша имеет максимум при некотором значении А, названном критическим. Зародыши с размером больше критического вызывают уменьшение ΔGобщ. и поэтому являются устойчивыми, способными к росту. Зародыши, имеющие размер меньше критического, нестабильны и растворяются в жидкости, поскольку вызывают увеличение ΔGобщ.
Скорость процесса и окончательный размер кристаллов при затвердевании определяются соотношением скоростей роста кристаллов и образования центров кристаллизации. Скорость образования зародышей измеряется числом зародышей, образующихся в единицу времени в единице объема; скорость роста - увеличением линейного размера растущего кристалла в единицу времени. Оба процесса связаны с перемещениями атомов и зависят от температуры. Графическая зависимость скорости образования зародышей и скорости их роста от степени переохлаждения представлена на рисунке.

Изменение скорости образования зародышей (с. з.) и скорости роста кристаллов (с. р.) в зависимости от степени переохлаждения
Для металлов, которые в обычных условиях кристаллизации не склонны к большим переохлаждениям, как правило, характерны восходящие ветви кривых. Это значит, что при равновесной температуре, когда степень переохлаждения равна нулю, скорость образования зародышей и скорость роста также равны нулю, т. е. кристаллизации не происходит. При небольших степенях переохлаждения, когда велик зародыш критического размера, а скорость образования зародышей мала, при затвердевании формируется крупнокристаллическая структура. Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотовая) или в подогретую металлическую форму. Увеличение переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливки. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получаются более мелкие кристаллы.
Несамопроизвольная кристаллизация
В реальных условиях процессы кристаллизации и характер образующейся структуры в значительной мере зависят от имеющихся готовых центров кристаллизации. Такими центрами, как правило, являются тугоплавкие частицы неметаллических включений, оксидов, интерметаллических соединений, образуемых примесями. К началу кристаллизации центры находятся в жидком металле в виде твердых включений. При кристаллизации атомы металла откладываются на активированной поверхности примеси, как на готовом зародыше. Такая кристаллизация называется несамопроизвольной или гетерогенной. При несамопроизвольной кристаллизации роль зародышей могут играть и стенки формы.
Наличие готовых центров кристаллизации приводит к уменьшению размера кристаллов при затвердевании. Эффект измельчения структуры значительно увеличивается при соблюдении структурного и размерного соответствия примесной фазы с основным металлом, которое способствует сопряжению их кристаллических решеток.
В жидком металле могут присутствовать и растворенные примеси, которые также вызывают измельчение структуры. Адсорбируясь на поверхности зарождающихся кристаллов, они уменьшают поверхностное натяжение на границе раздела жидкость - твердая фаза и линейную скорость роста кристаллов. Это способствует уменьшению Акр и появлению новых зародышей, способных к росту. Примеси, понижающие поверхностное натяжение, называют поверхностно-активными.
Получение монокристаллов
Большое научное и практическое значение имеют монокристаллы. Монокристаллы отличаются минимальными структурными несовершенствами. Получение монокристаллов позволяет изучать свойства металлов, исключив влияние границ зерен. Применение в монокристаллическом состоянии германия и кремния высокой чистоты дает возможность использовать их полупроводниковые свойства и свести к минимуму неконтролируемые изменения электрических свойств.
Монокристаллы можно получить, если создать условия для роста кристалла только из одного центра кристаллизации. Существует несколько методов, в которых использован этот принцип. Важнейшими из них являются методы Бриджмена и Чохральского.
Метод Бриджмена (рис. а) состоит в следующем: металл, помещенный в тигель с коническим дном 3, нагревается в вертикальной трубчатой печи 1 до температуры на 50-100 °С выше температуры его плавления. Затем тигель с расплавленным металлом 2 медленно удаляется из печи. Охлаждение наступает в первую очередь в вершине конуса, где и появляются первые центры кристаллизации. Монокристалл 4 вырастает из того зародыша, у которого направление преимущественного роста совпадает с направлением перемещения тигля. При этом рост других зародышей подавляется. Для непрерывного роста монокристалла необходимо выдвигать тигель из печи со скоростью, не превышающей скорость кристаллизации данного металла.

Схемы установок для выращивания монокристаллов
Метод Чохральского (рис. б) состоит в вытягивании монокристалла из расплава. Для этого используется готовая затравка 2 - небольшой образец, вырезанный из монокристалла по возможности без структурных дефектов. Затравка вводится в поверхностный слой жидкого металла 4, имеющего температуру чуть выше температуры плавления. Плоскость затравки, соприкасающаяся с поверхностью расплава, должна иметь кристаллографическую ориентацию, которую желательно получить в растущем монокристалле 3 для обеспечения наибольших значений тех или иных свойств. Затравку выдерживают в жидком металле для оплавления и установления равновесия в системе жидкость-кристалл. Затем затравку медленно, со скоростью, не превышающей скорости кристаллизации, удаляют из расплава. Тянущийся за затравкой жидкий металл в области более низких температур над поверхностью ванны кристаллизуется, наследуя структуру затравки. Для получения симметричной формы растущего монокристалла и равномерного распределения примесей в нем ванна 5 с расплавом вращается со скоростью до 100 об/мин, а навстречу ей с меньшей скоростью вращается монокристалл.
Диаметр растущего монокристалла зависит от скорости выращивания и температуры расплава. Увеличение скорости выращивания ведет к выделению большей теплоты кристаллизации, перегреву расплава и уменьшению диаметра монокристалла, и, наоборот, уменьшение скорости выращивания приводит к уменьшению количества теплоты кристаллизации, понижению температуры расплава и увеличению диаметра монокристалла.
Аморфное состояние металлов
При сверхвысоких скоростях охлаждения из жидкого состояния диффузионные процессы настолько замедляются, что подавляется образование зародышей и рост кристаллов. В этом случае при затвердевании образуется аморфная структура. Материалы с такой структурой получили название аморфные сплавы или металлические стекла.
Аморфное состояние обеспечивает металлическим материалам свойства, значительно отличающиеся от свойств соответствующих материалов с кристаллической структурой. Так, аморфные магнитомягкие материалы характеризуются прямоугольной петлей гистерезиса, высокой магнитной проницаемостью и очень малой коэрцитивной силой. При этом магнитные свойства материала малочувствительны к механическим воздействиям на него.

Получены аморфные материалы и с высокой магнитной энергией. Удельное электрическое сопротивление аморфных металлических материалов в 2 — 3 раза выше, чем у аналогичных сплавов с кристаллической структурой. Аморфные металлические материалы удачно сочетают высокие прочность, твердость и износостойкость с хорошей пластичностью и коррозионной стойкостью. Большое практическое значение имеет также и возможность получения аморфных металлов в виде ленты, проволоки диаметром несколько микрометров непосредственно при литье, минуя такие дорогостоящие операции, как ковка, прокатка, волочение, промежуточные отжиги, зачистки, травление.
На рисунке показана связь характерных графиков изменения свободной энергии возможных фаз при трех определенных температурах t1, t2, t3 с диаграммой состояния. При температуре t2 между точками а и b в термодинамическом равновесии сосуществуют две фазы: жидкий раствор состава ха и твердый раствор состава xb. Значения свободных энергий этих растворов соответствуют точкам a' и b'. Для более точного построения линий ликвидус и солидус необходимо иметь несколько графиков для интервала температур между t1и t3.
Термодинамическое обоснование диаграммы состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях
Полиморфизм

Ряду веществ свойственны не одна, а две и более структур, устойчивых при различных температурах и давлениях. Такие структуры называются полиморфными модификациями, или полиморфными формами. Полиморфные модификации принято обозначать греческими буквами. Модификацию, устойчивую при низких температурах, обозначают буквой α, а при более высоких - β. Полиморфизм весьма распространенное явление.
Железо, титан, кобальт, олово, углерод, сегнетоэлектрики, кварц и многие другие материалы могут существовать в различных полиморфных модификациях.
Естественно, полиморфные, модификации отличаются между собой не только структурой, но и свойствами. Например, α-олово, устойчивое ниже 13° С, является хрупким полупроводником, а β-олово— весьма вязкий металл.

При полиморфизме особо резкие изменения свойств наблюдаются при изменении не только структуры, но и типа химической.
Полиморфизм играет в материаловедении и технологии важную практическую роль. Переводя материал из одной полиморфной модификации в другую, можно управлять его свойствами. Например, практически освоено получение алмазов из графита нагревом его под давлением 100000 атм. до температур примерно 2000° С.
Кристаллизация – процесс перехода металла из жидкого состояния в твердое при определенной температуре
приходящуюся на единицу объема V кристалла. Размерность плотности дислокаций см/см 3 или см -2 . В исходном состоянии плотность дислокаций в металлах около 10 6 - 10 3 . После пластической деформации плотность дислокаций значительно возрастает и может составлять 10 11 - 10 12 , что соответствует примерно 1 млн. километров дислокаций в 1 см 3 !
Плотность дислокаций определяется экспериментально по специальным методикам и при очень большом увеличении. Подсчитывается число выходов дислокаций на единицу площади поверхности металла.
Использование теории дислокаций позволило объяснить многие вопросы, связанные с изменением прочности металлов и сплавов.
ЛЕКЦИЯ 2
ПРОЦЕССЫ КРИСТАЛЛИЗАЦИИ
Рассмотрим термодинамические условия кристаллизации. Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии. Свободной энергией является такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Величина свободной энергии изменяется при изменении температуры:
F = U - TS, где
F — свободная энергия, U — полная внутренняя энергия системы, Т — температура, S — энтропия.
Согласно второму закону термодинамики всякая система стремится к минимальному значению свободной энергии. Любой самопроизвольный процесс идет только в том случае, если новое состояние более устойчиво, т.е. обладает меньшим запасом свободной энергии. Процесс кристаллизации подчиняется этому же закону. Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится в том случае, когда меньшей свободной энергией обладает жидкое состояние.
Изменение свободной энергии жидкого и твердого состояния при изменении температуры показано на рис.2.1. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояний вещества.
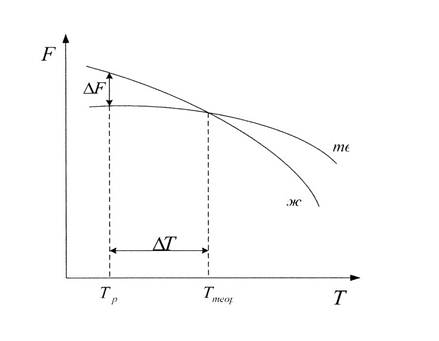
Рис. 2.1. Влияние температуры на изменение свободной энергии
жидкого и твердого состояния.
Различают теоретическую и реальную температуру кристаллизации. Tт — теоретическая, или равновесная температура кристаллизации, при которой Fж = Fmв. При этой температуре равновероятно существование металла как в жидком, так и в твердом состояниях. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе
для чего необходимо некоторое переохлаждение. Температура, при которой практически идет кристаллизация, называется реальной температурой кристаллизации Тр. Разность между теоретической и реальной температурами кристаллизации называется
степенью переохлаждения: ΔT=Tт ‑ Тр.
Чем больше степень переохлаждения ΔT, тем больше разность свободных энергий ΔF, тем интенсивнее будет идти кристаллизация.
Последовательность формирования кристаллов в процессе кристаллизации одинакова для всех металлических материалов независимо от их состава и включает в себя следующие стадии:
1 стадия кристаллизации — зарождение центров (зародышей) кристаллизации (рис.2.2, а). Вокруг образовавшихся центров начинают расти кристаллы. Одновременно в жидкой фазе образуются новые центры кристаллизации.
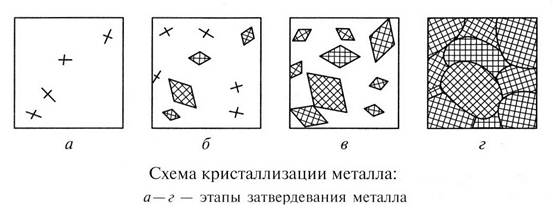
Рис.2.2. Последовательные стадии кристаллизации.
2 стадия кристаллизации — образование главной оси -- оси первого
порядка (рис.2.2, б). Главная ось кристаллизации определяет направление будущего кристалла. Увеличение общей массы затвердевшего металла происходит как за счет возникновения новых центров кристаллизации, так и за счет роста уже существующих.
3 стадия кристаллизации – образование осей кристаллизации 2 и 3 порядка, перпендикулярных к главной оси (рис. 2.2., а, б и рис. 2.3). Такая структура формирует основу будущего кристалла. Ее называют дендритной структурой (древовидный, древообразный).
4 завершающая стадия кристаллизации – кристаллизация межосного пространства (рис.2.2, г и рис. 2.4).
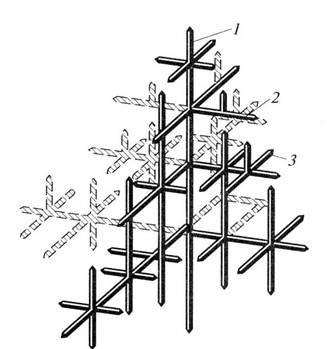
Рис. 2.3. Схема дендритной структуры
(1, 2, 3 – оси кристаллизации 1, 2, 3 порядка).
На первых стадиях кристаллизации образовавшиеся кристаллы (зерна) растут свободно и имеют почти правильную форму. Затем при соприкосновении растущих кристаллов их правильная форма нарушается. Дальнейший рост кристаллов продолжается только в тех направлениях, где есть свободный доступ оставшегося жидкого металла. В результате на завершающей стадии процесса кристаллизации строение кристаллов (зерен) получает неправильную форму (рис.2.2, г и рис.2.4).
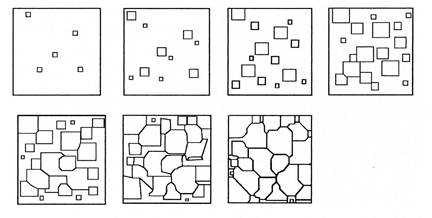
Рис. 2.4. Схема кристаллизации металла.
Таким образом, в результате кристаллизации в металлических материалах образуется зернистая структура (рис.2.3, г и рис.2.4).
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зернометалла.
В свою очередь на образование центров кристаллизации влияет скорость охлаждения и степень переохлаждения. Чем выше скорость охлаждения, тем мельче зерно.
Реальный процесс получения металла в больших объемах (называются слитки) показан на рис.2.5.
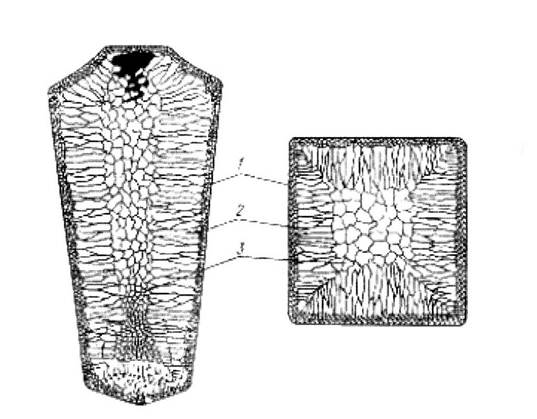
Рис. 2.5. Строение слитка.
Рассмотрим строение слитка в твердом состоянии. Слитки получают охлаждением в металлических формах (изложницах). Кристаллизация начинается у поверхности изложницы, где самый большой отвод тепла и самая высокая степень переохлаждения. Здесь образуются самые мелкие кристаллы. Это I зона кристаллизации -- мелкозернистая корка(рис.2.5, 1).
II зона кристаллизации — зона столбчатых кристаллов (рис.2.5, 2) связана с направленным отводом тепла — перпендикулярно к стенкам изложницы. При этом скорость охлаждения уменьшается и образуются более крупные зерна.
III зона кристаллизации -- зона равноосных кристаллов. Их главные оси не имеют одинаковой направленности и эти зерна являются самыми крупными по объему слитка, так как в центре слитка самая низкая скорость охлаждения.
Таким образом, металл после завершения кристаллизации (его называют литой металл), независимо от объема металла, имеет неоднородную структуру. Такую неоднородность металла называют зональной.
КРИСТАЛЛИЗАЦИЯ
чивому состоянию с меньшей энергией Гиббса (свободной энергией) G, т.е. когда энергия Гиббса кристалла меньше, чем энергия Гиббса жидкой фазы (рис.10). Если превращение происходит с небольшим изменением объема, то G=U-TS, где U – внутренняя энергия системы, T – абсолютная температура, S – энтропия.
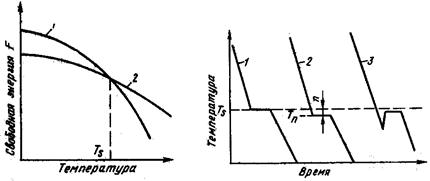
Рис.10 Изменение свободной энергии жидкого (1) и кристаллического (2) состояния в зависимости от температуры
Рис.11. Кривые охлаждения при кристаллизации: теоретический (1) и реальный (2) процессы кристаллизации, (3) – процесс кристаллизации со скачкообразным повышением температуры кристаллизации
Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже этой температуры – вещество в твердом состоянии. Тs – есть равновесная (теоретическая) температура кристаллизации, при которой металл в обоих состояниях находится в равновесии. Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при некотором переохлаждении жидкости. Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации. Разность между теоретической и фактической температурой кристаллизации есть величина или степень переохлаждения.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах температура – время (рис.11). Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым
охлаждением, так как при этом нет качественного изменения состояния. При достижении температуры кристаллизации на кривой температура – время появляется горизонтальная площадка, связанная с выделением скрытой теплоты кристаллизации. По окончании кристаллизации, т.е. полного перехода в твердое состояние, температура снова начинает снижаться, а твердое кристаллическое вещество охлаждается. Теоретически процесс кристаллизации изображен кривой 1. Кривая 2 показывает реальный процесс кристаллизации с переохлаждением. Кривая 3 иллюстрирует процесс кристаллизации для некоторых металлов, когда из-за большого переохлаждения скрытая теплота выделяется в первый момент настолько бурно, что температура кристаллизации скачкообразно повышается.
Процесс кристаллизации состоит из двух элементарных процессов: возникновение зародышей, или центров кристаллизации и рост кристаллов из этих центров. Схематически процесс зарождения и роста кристаллов показан на рис.12. По мере развития процесса кристаллизации в нем участвует все большее число кристаллов. Поэтому процесс вначале ускоряется, а затем, когда взаимное столкновение растущих кристаллов начинает препятствовать их росту, замедляется. Кроме того, при столкновении и срастании кристаллов их правильная форма нарушается. Поэтому реальные зерна имеют неправильную форму.
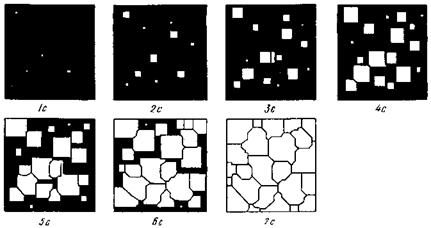
Рис.12. Модель процесса кристаллизации. Под рисунком указано время течения процесса в секундах
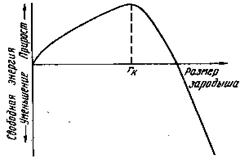
Процесс кристаллизации, как уже было сказано выше, может протекать только при условии уменьшения свободной энергии.
Рис.13. Изменение свободной энергии в зависимости от размера зародыша, rк – критический размер зародыша
Поэтому размер возникшего зародыша должен быть больше некоторого rk (рис.13), называемого критическим (устойчивым) размером.
Кроме самопроизвольного (гомогенного) образования зародышей кристаллизации может происходить и гетерогенное образование, когда в расплавленном материале присутствуют частички примесей, имеющих одинаковую кристаллическую решетку с исходным материалом. Эти примесные частицы и будут центрами кристаллизации.
Кристаллы, образующиеся в процессе затвердевания металла, могут иметь различную форму в зависимости от скорости охлаждения, характера и количества примесей. Чаще всего в процессе кристаллизации образуются разветвленные (древовидные) кристаллы, получившие название дендритов (рис.14).
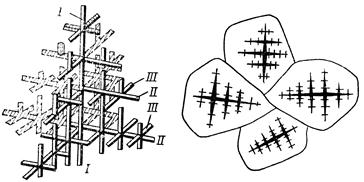
Рис.14. Схема роста кристалла и образования зерна: а – дендрит с осями I, II, III порядка; б – зерна из дендритов
При образовании кристаллов их развитие идет в основном в направлении, перпендикулярном к плоскостям с максимальной плотностью упаковки атомов. Это приводит к тому, что первоначально образуются длинные ветви, так называемые оси первого (I) порядка. Одновременно с удлинением осей первого порядка на их ребрах зарождаются и растут перпендикулярные к ним такие же ветви второго (II) порядка и т.д. Дендритное строение характерно для литого материала.
Структура литого слитка состоит из трех основных зон (рис.15). Первая зона – наружная мелкозернистая корка 1, состоящая из дезориентированных мелких кристаллов – дендритов. При первом соприкосновении со стенками формы в тонком прилегающем слое жидкого металла возникает сильное переохлаждение, сопровождающееся зарождением большого числа центров кристаллизации, что приводит к образованию мелкозернистой структуры. Вторая зона – зона столбчатых кристаллов 2. Степень переохлаждения меняется. В результате из небольшого числа центров кристаллизации начинают расти нормально ориентированные к поверхности корки столбчатые кристаллы. Третья зона – зона равноосных кристаллов 3. Температура застывающего металла почти полностью уравнивается во всем объеме слитка, что и вызывает образование равноосной структуры.
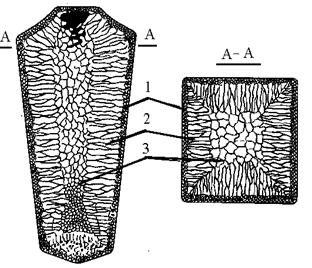
Рис.15. Схема строения стального слитка:
1 – мелкозернистая корка, 2 – столбчатые кристаллы, 3-равноосные кристаллы
Жидкий металл имеет больший объем, чем закристаллизовавшийся, поэтому залитый в форму металл в процессе кристаллизации сокращается в объеме, что приводит к образованию пустот, называемых усадочными
раковинами. Усадочная раковина обычно окружена наиболее загрязненной частью металла, в котором после затвердевания образуются микро- и макропоры и пузыри.
Резюме
Кристаллизацией называется переход металла из жидкого состояния в твердое (кристаллическое). Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура.
Процесс кристаллизации состоит из двух элементарных процессов: возникновение зародышей, или центров кристаллизации и рост кристаллов из этих центров.
Процесс образования зародышей кристаллизации может происходить самопроизвольно (гомогенное образование), а может идти и по гетерогенному пути образования.
Чаще всего в процессе кристаллизации образуются разветвленные (древовидные) кристаллы, получившие название дендритов.
Кристаллизовавшийся слиток имеет три основных зоны.
Первая зона – наружная мелкозернистая корка, состоящая из дезориентированных мелких кристаллов – дендритов. Вторая зона – зона столбчатых кристаллов. Третья зона – зона равноосных кристаллов.
В процессе кристаллизации происходит образование пустот, называемых усадочными раковинами. Усадочная раковина обычно окружена наиболее загрязненной частью металла, в котором после затвердевания образуются микро- и макропоры и пузыри.
Вопросы для повторения
1. Что такое кристаллизация? В каких условиях происходит этот процесс? Объяснить термодинамику процесса.
2. Какие элементарные процессы составляют процесс кристаллизации?
3. Что представляют собой образовавшиеся кристаллы? Какие основные зоны затвердевшего слитка Вы знаете?
Кристаллизация металлов
Схема роста кристаллов показана на рис. 2. Кристалл растет в направлении, противоположном отводу тепла. Сначала образуется главная ось кристалла 1, затем на главной оси образуются оси первого порядка 2, на них – оси второго порядка 3, на них – оси следующего порядка и т. д., пока в этом объеме есть жидкий металл.
Атомы жидкости пристраиваются к атомам кристаллов, создавая их форму и обеспечивая их рост. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму до момента их соприкосновения. В месте соприкосновения кристаллов рост их отдельных осей и граней прекращается. В результате к окончанию процесса кристаллизации кристаллы не имеют правильной геометрической формы, но сохраняют свое древовидное строение. Кристаллы древовидной формы называются дендритами (см. рис. 2).
Дендритное строение – признак литого состояния металла (слиток, отливка). При значительной пластической деформации литого металла форма и размеры кристаллов изменяются – дендриты дробятся, из них образуются новые кристаллы неопределенной формы, называемые зернами (рис. 3). Зернистое строение – признак деформированного металла (прокат, поковки, штампованные полуфабрикаты).
Рис. 2. Дендритная кристаллизация: а – схема дендритного строения
по Чернову; б – схема кристаллизации слитка; дендриты: Чернова (в),
на поверхности сурьмы (г) и алюминия (д)
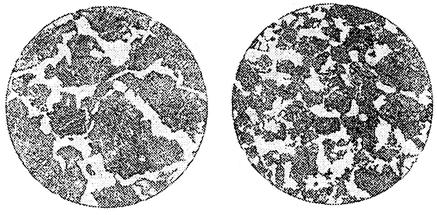
Рис. 3. Микроструктура доэвтектоидной стали:
а – крупнозернистая; б – мелкозернистая
Размер кристаллов металла во многом определяет его прочностные свойства: чем мельче кристаллы, тем выше сопротивление металла ударным и циклическим нагрузкам. Итак, в процессе кристаллизации два фактора определяют строение металла: число центров кристаллизации и скорость роста кристаллов из этих центров.
Проследим за изменением температуры металла при охлаждении жидкости через равные промежутки времени (рис. 4). Сначала температура жидкого металла понижается равномерно в зависимости от скорости охлаждения V1, V2, V3. Затем понижение температуры прекращается и на кривой охлаждения появляется горизонтальный участок (площадка). В это время отвод тепла компенсируется выделением скрытой теплоты кристаллизации и металл переходит в твердое состояние (образуются и растут кристаллы). После окончания кристаллизации температура вновь равномерно понижается, металл охлаждается в твердом состоянии.
При теоретической температуре кристаллизации (температуре плавления) жидкий металл и твердые кристаллы могут существовать одновременно и бесконечно долго. Следовательно, кристаллизация может происходить только при определенном переохлаждении металла ниже теоретической (равновесной) температуры. Разность между теоретическим и фактическим значениями температуры кристаллизации металла называется степенью переохлаждения:
где Тпл – теоретическая (равновесная) температура кристаллизации (плавления) металла;
Тк – фактическая температура кристаллизации данного металла.
Степень переохлаждения металла зависит от скорости охлаждения V1, V2, V3 (см. рис. 4).
Скорости охлаждения V1 соответствует малая степень переохлаждения DТ1. Охлаждение расплава со скоростью V2 вызывает увеличение степени переохлаждения DТ2, а большая скорость охлаждения V3 приведет к увеличению степени переохлаждения DТ3, и кристаллизация будет происходить при более низкой температуре. В итоге это скажется на факторах процесса кристаллизации:
Vохл ®DТ®ЧЦК – СРК, (2)
где ЧЦК – число центров кристаллизации;
СРК – скорость роста кристаллов из этих центров.
Однако не всегда имеется возможность регулировать скорость охлаждения жидкого металла. Методом получения мелких кристаллов при затвердевании металла является создание искусственных центров кристаллизации. Для этого в расплавленный металл вводят специальные вещества, называемые модификаторами. Процесс искусственного регулирования количества и размеров кристаллов называется модифицированием.
Конспект урока "Кристаллизация металлов и сплавов"
Цель: изучить механизм и закономерности кристаллизации; рассмотреть строение металлического слитка, научиться строить кривые охлаждения.
Основные понятия:
· Фактическая температура кристаллизации
План лекции:
1. Кристаллизация металлов и сплавов.
2. Механизм и закономерности кристаллизации металлов.
3. Условия получения мелкозернистой структуры.
4. Строение металлического слитка.
5. Кривая охлаждения железа.
1. Кристаллизация металлов и сплавов.
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 1.

Рис.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS. Температура, при которой практически начинается кристаллизация называется реальная температурой кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения:
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждении).
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое.
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 2.

Рис.2. Кривая охлаждения чистого металла
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. Оно компенсирует рассеивание теплоты в пространство, и поэтому температура остается постоянной. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
2. Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.
Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию.

Рис.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.4.

Рис.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.5).

Рис.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту. Объем жидкой фазы, в которой образуются кристаллы, уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 6).

Рис. 6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело. Для металлов, обладающих малой склонностью к переохлаждению, экспериментально обнаруживаются только восходящие ветви кривых.
3. Условия получения мелкозернистой структуры.
Стремятся к получению мелкозернистой структуры. Оптимальными условиями для этого являются: максимальное число центров кристаллизации и малая скорость роста кристаллов.
Размер зерен при кристаллизации зависит и от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации – оксиды, нитриды, сульфиды.
Чем больше частичек, тем мельче зерна закристаллизовавшегося металла.
Стенки изложниц имеют неровности, шероховатости, которые увеличивают скорость кристаллизации.
Мелкозернистую структуру можно получить в результате модифицирования, когда в жидкие металлы добавляются посторонние вещества – модификаторы,
По механизму воздействия различают:
1. Вещества, не растворяющиеся в жидком металле – выступают в качестве дополнительных центров кристаллизации.
2. Поверхностно - активные вещества, которые растворяются в металле, и, осаждаясь на поверхности растущих кристаллов, препятствуют их росту.
4. Строение металлического слитка.
Схема стального слитка, данная Черновым Д.К., представлена на рис.7.

Рис. 7. Схема стального слитка
Слиток состоит из трех зон:
1. мелкокристаллическая корковая зона;
2. зона столбчатых кристаллов;
3. внутренняя зона крупных равноосных кристаллов.
Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации. Образуется мелко
Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты (рис. 8). Растут дендриты с направлением, близким к направлению теплоотвода.

Рис.8. Схема дендрита по Чернову Д.К.
Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией.
Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией.
Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка.
В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15…20 % от длины слитка)
Методы исследования металлов: структурные и физические
Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
5. Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: ;
;
; (высокотемпературноеПревращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
6. Кривая охлаждения железа.
Порядковый номер железа в таблице Менделеева – 26, атомная масса - A= 55,85 а.е.м. (атомные единицы массы). Радиус атома - R = 1,27А. Температура плавления - Тпл = 1539 0 С. Плотность – 7,68 г/см 3 .
Железо существует в двух аллотропических модификациях: объемноцентрированного куба ( Fe a ) и гранецентрированного куба ( Fe g ). Из кривой охлаждения чистого железа (рис.9) видно, что Fe a существует в двух интервалах температур : ниже 911 0 С и от 1392 до 1539 0 С. Достигнув при охлаждении температуры 1392 0 С, Fe a претерпевает аллотропическое превращение, в процессе которого кристаллическая решетка объемно-центрированного куба при постоянной температуре перестраивается в решетку гранецентрированного куба Fe g . Второе аллотропическое превращение в процессе охлаждения происходит при температуре 911 0 С, когда Fe g (решетка гранецентрированного куба) перестраивается в объемноцентрированную кубическую решетку Fe a .
При температуре 768 0 С, называемой точкой Кюри, железо испытывает магнитное превращение: ниже 768 0 С железо становится магнитным. Магнитное превращение есть особый вид превращения и имеет ряд особенностей, отличающих его от аллотропического превращения.
Читайте также:
