Прочность связи с металлом
Обновлено: 05.05.2024
МЕТАЛЛЫ (от греч. metallon-первоначально, шахта, копи), в-ва, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлам относятся как собственно металлы (простые в-ва), так и их сплавы, металлические соединения, в т.ч. интерметаллиды. Иногда металлами наз. все в-ва, обладающие теми или иными металлич. св-вами, напр. т. наз. "синтетические" металлы (см. Интеркалаты), металлы органические.
Ранее характерными признаками металлов считались блеск, пластичность и ковкость - "светлое тело, которое ковать можно" (М. В. Ломоносов). Но металлич. блеском обладают и нек-рые неметаллы, напр. иод. Известны хрупкие металлы, хотя мн. из них в результате тщательной очистки получены в пластичном состоянии. В настоящее время важнейшим признаком металлов признается отрицат. температурный коэф. электрич. проводимости, т.е. понижение электрич. проводимости с ростом т-ры. Из 109 элементов в периодич. системе 86 относят к металлам. Граница между металлами и неметаллами в периодич. таблице (в ее длинном варианте) проводится по диагонали от В до At. О нек-рых элементах, напр. Ge, Sb, нет единого мнения, все же правильнее считать Ge неметаллом, т.к. он обладает полупроводниковыми св-вами, a Sb-металлом, хотя по физ. св-вам сурьма -полуметалл.
Олово существует как в металлической (b-Sn), в полупроводниковой (a-Sn) модификации. С др. стороны, у Ge, Si, P и нек-рых др. неметаллов при высоких давлениях обнаружены модификации с металлич. проводимостью. Можно предположить, что при достаточно высоких давлениях все в-ва могут приобретать металлич. св-ва. Поэтому вопрос об отнесении того или иного элемента к металлам или неметаллам следует, по-видимому, решать на основании рассмотрения не только физ. св-в простого в-ва, но и его хим. св-в. Иногда для элементов, лежащих на границе между металлами и неметаллами, применяют термин "полуметаллы", хотя этот термин в химии теперь не рекомендуется.
В металлах существует металлическая связь, характеризующаяся тем, что кристаллич. решетка образована положит. ионами, тогда как валентные электроны делокализованы по всему пространству решетки. Металлы можно представить в виде остова из положит. ионов, погруженного в "электронный газ", к-рый компенсирует силы взаимного отталкивания положит. ионов. Энергия этих делокализованных электронов-электронов проводимости - отвечает зоне проводимости. Согласно зонной теории, у металлов отсутствует запрещенная зона между валентной зоной и зоной проводимости (см. Твердое тело).
В кристаллах металлов атомы ионизированы лишь частично и часть валентных электронов остается связанной, в результате возможно появление частично ковалентных связей между соседними атомами. Прочность связи в кристаллич. структуре металлов характеризуется энтальпией атомизации, к-рая меняется от 61,4 кДж/молъ у Hg до 850 кДж/моль у W. Макс. энтальпия атомизации характерна для металлов рядов Nb-Ru и Hf-Ir. Относящиеся к ним металлы отличаются макс. т-рами плавления и высокой мех. прочностью.
Классификация металлов.Все металлы делятся на четыре группы (см. форзац): s-металлы (все s-элементы, кроме Н и Не), р-металлы (элементы гр. IIIа, кроме В, а также Sn, Рb, Sb, Bi, Ро), d-металлы и f-металлы, к-рые объединяются под назв. "переходных" (см. Переходные элементы). Металлы первых двух групп иногда наз. "простыми". Из этих групп выделяются нек-рые более узкие группы: из s-металлов- щелочные металлы и щелочноземельные элементы, из d-металлов- платиновые металлы. Группа редкоземельных элементов включает как d-, так и f-металлы (подгруппа Sc и лантаноиды).
Существует также, хотя и не общепринятая, техн. классификация металлов. В известной мере она перекликается с геохимическими классификациями элементов. Обычно выделяют след. группы: черные металлы (Fe); тяжелые цветные металлы - Сu, Pb, Zn, Ni и Sn (к этой группе примыкают т.наз. малые, или младшие, металлы - Со, Sb, Bi, Hg, Cd, нек-рые из них иногда относят к редким металлам); легкие металлы (с плотностью менее 5 г/см 3 )-Аl, Mg, Ca и т.д.; драгоценные металлы-Au, Ag и платиновые металлы; легирующие (или ферросплавные) металлы - Mn, Cr, W, Mo, Nb, V и др.; редкие металлы (см. Редкие элементы), разбиваемые в свою очередь на неск. групп; радиоактивные металлы-U, Th, Pu и др.
Кристаллическая структура.Большинство металлов кристаллизуется в одном из трех структурных типов (см. Металлические кристаллы), а именно-в кубич. и гексагoн. плот-нейших упаковках (см. Плотная упаковка)или в объем-ноцентрированной кубич. решетке. В плотнейших упаковках каждый атом на равных расстояниях имеет 12 ближайших соседей. В объемноцентрированной кубич. решетке у каждого атома 8 равноудаленных соседей, еще 6 соседей расположены на большем (на 15%) расстоянии. Поэтому ко-ординац. число в этой структуре считают равным 14 (8 + 6). Межатомные расстояния в кристаллич. структуре металлов характеризуются металлич. радиусом (см. Атомные радиусы).
При обычных условиях щелочные металлы, а также Ва, Ra, элементы подгрупп V и Сr кристаллизуются в объемно-центрированной кубич. решетке типа a-Fe. Плотнейшая кубич. упаковка (гранецентрированная кубич. решетка) типа Си характерна для Al, Ni, металлов подгруппы Сu, платиновых металлов (кроме Ru и Os) и т. д. В гексагoн. плотнейшей упаковке типа Mg кристаллизуются Be, Са, Sr, Zn, Cd, Co, Ru, Os, элементы подгрупп Ti и Sc, мн. РЗЭ. Более сложными являются структуры разл. модификаций Мn, Ра, U, трансурановых элементов.
Многие металлы претерпевают при изменении т-ры или давления полиморфные превращения. Металлы, к-рые при низких т-рах образуют плотнейшие упаковки, напр. Са, La, Zr,часто имеют высокотемпературные модификации с объемноцентрированной кубич. структурой.
При плавлении металлы сохраняют свои электрич., тепловые и оптич. св-ва. Вблизи т-ры плавления в жидких металлах наблюдается примерно такой же ближний порядок, как и в кристаллических металлах. С повышением т-ры ближний порядок нарушается вплоть до полного разупорядочения.
Физические свойства.Физ. св-ва металлов меняются в очень широких пределах. Так, т-ра плавления изменяется от - 38,87 °С (Hg) до 3380 °С (W), плотность - от 0,531 г/см 3 (Li) до 22,5 г/см 3 (Os). Уд. электрич. сопротивление р при 25 °С имеет значения от 1,63 (Ag) до 140 (Мn) мкОм . см. Сопротивление движению электронов (рассеяние электронов) возникает вследствие нарушения кристаллич. решетки из-за теплового движения атомов, а также дефектов (вакансий, дислокаций, примесных атомов). Мерой его является длина своб. пробега электрона. При комнатной т-ре она равна ~ 10 -6 см у металлов обычной чистоты и ~ 10 -2 см у высокочистых. Температурный коэф. р (в интервале 0-100°С) меняется в пределах 1,0 . 10 -3 (Hg)-9,0 . 10 -3 К -1 (Be). При гелиевых т-рах (4,2 К) р практически не зависит от т-ры (rост). Его измерение используют для характеристики чистоты и совершенства кристаллов металла. Чем больше отношение r273/r4,2, тем чище металл. В монокристаллах высокой чистоты оно достигает 10 4 -10 5 . Нек-рые металлы при низких т-рах становятся сверхпроводниками, при этом критич. т-ра у чистых металлов от сотых долей до 9 К.
У металлов наблюдается термоэлектронная эмиссия (способность испускать электроны при высокой т-ре). Эмиссия электронов возникает также под действием электромагн. излучения в видимой и УФ областях спектра (фотоэлектронная эмиссия), внеш. электрич. поля высокой напряженности (туннельная, или автоэлектронная, эмиссия), при бомбардировке пов-сти металлов электронами (вторичная электронная эмиссия) или ионами (ионно-электронная эмиссия), при взаимод. пов-сти металла с плазмой (взрывная электронная эмиссия). Перепад т-ры вызывает в металлах появление электрич. тока (термоэдс).
Теплопроводность металлов обусловлена в осн. движением электронов, поэтому уд. коэф. теплопроводности ( /(s•Т) = L = 2,45•10 -8 Вт•Ом/К 2 (закон Видемана-Франца). Уд. коэф. теплопроводности металлов имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
Температурный коэф. линейного расширения металлов в интервале 0-100°С имеет значения от 4,57 . 10 -6 (для Os) до 10 -4 K -1 (для Sr). Согласно эмпирич. правилу Грюнайзена, относит. увеличение объема металла в интервале от О К до т-ры плавления приблизительно равно 0,06. Поэтому температурный коэф. объемного расширения у тугоплавких металлов меньше, чем у легкоплавких.
У большинства металлов магн. восприимчивость по абс. величине сравнительно мала (~ 10 -9 ) и слабо зависит от т-ры. Среди металлов есть диамагнетики, напр. Bi (Излучения оптич. диапазона почти полностью отражаются пов-стью металлов, вследствие чего они непрозрачны и обладают характерным металлическим блеском (порошки мн. металлов матовые). Нек-рые металлы, например Аu в виде тонкой фольги, просвечивают. Отраженный от поверхности металлов плоскополяризованный свет становится эллиптически поляризованным.
Для использования металлов в качестве конструкц. материалов важнейшее значение имеет сочетание мех. св-в - пластичности и вязкости с значит. прочностью, твердостью и упругостью. Эти св-ва зависят не только от состава (чистоты металла), но и от совершенства кристаллич. решетки (наличия дефектов) и структуры, определяемых предварительной термич. и мех. обработкой образца.
Мех. св-ва реальных металлов определяются наличием дефектов, в первую очередь дислокаций, т. к. перемещение дислокаций по плоскостям кристаллич. решетки с наиб. плотной упаковкой является осн. механизмом пластич. деформации металлов. Взаимод. дислокаций с др. дефектами увеличивает сопротивление пластич. деформации. В процессе деформации число дислокаций растет, соотв. растет и сопротивление деформации (деформац. упрочнение, или наклеп). Напряженное состояние и наклеп после деформации ликвидируются при отжиге. Рост напряжений в местах "сгущения" дислокаций вызывает зарождение трещин - очагов разрушения. Важнейшая характеристика мех. св-в металлов-модуль упругости Е (модуль Юнга). Предел текучести, т. е. сопротивление пластич. деформации, 10 -3 -10 -4 Е.
Химические свойства.Металлы обладают низкими значениями первого потенциала ионизации и сродства к электрону. Вследствие этого в хим. р-циях они выступают как доноры электронов (восстановители), а в соед. и их р-рах образуют положительно заряженные ионы (в большинстве случаев аквакатионы). Электроотрицательности атомов металлов ниже электроотрицательностей атомов неметаллов. Металлы могут входить в состав сложных анионов, напр. МnО - 4, или ацидокомплексов, напр. [Fe(CN)6] 4- , однако в них атомы металлов всегда являются центрами положит. заряда. Только для нек-рых металлов, находящихся на границе с неметаллами, таких, как Sn, Po, Sb и т.п., известны соед., напр. гидриды, в к-рых металлы имеют формально отрицат. степень окисления. Но во всех этих соед. хим. связь ковалентная.
Способность металлов к окислению меняется в очень широких пределах. Большинство металлов окисляется кислородом воздуха уже при обычной т-ре, однако скорость и механизм р-ции очень сильно зависят от природы металлов. В большинстве случаев при этом образуются оксиды, а у щелочных металлов, кроме Li,-пepоксиды. Устойчивость металлов на воздухе определяется св-вами образующегося оксида, в частности отношением молярных объемов Vокс/VM.. Если Vокс/VМ > 1, на металлах образуется защитная пленка, предохраняющая металлы от дальнейшего окисления. Такая пленка характерна, напр., для Al, Ti, Сr, к-рые устойчивы на воздухе, хотя и обладают высокой активностью. Металлы, для к-рых это отношение меньше 1 (напр., щелочные), на воздухе неустойчивы.
С N2 реагирует ряд металлов, напр. Li при обычной т-ре , a Mg, Zr, Hf, Ti-при нагревании. Мн. металлы активно взаимод. с Н2, галогенами, халькогенами. Все металлы, чьи стандартные электродные потенциалы отрицательнее, чем —0,413 В, окисляются водой с выделением Н2. Щелочные и щел.-зем. металлы реагируют с водой при обычных т-рах, а такие металлы, как Zn или Fe, реагируют с водяным паром при высоких т-рах. С р-рами щелочей взаимод. металлы, образующие р-римые анионные гидроксокомплексы (Be, Zn, Al, Ga, Sn).
Большинство металлов окисляется теми или иными к-тами. Металлы, имеющие отрицат. стандартные электродные потенциалы, т.е. стоящие в электрохимическом ряду напряжений до водорода, окисляются ионами Н + и растворяются поэтому при действии неокисляющих к-т (соляная или разб. H2SO4), если не образуются нер-римые продукты. Р-ции способствует образование анионных комплексов. Азотная к-та, даже разбавленная, окисляет мн. металлы. При этом, если ионы металлов устойчивы в низших степенях окисления, образуются ка-тионные комплексы, если в высших, как в случае, напр., Re,-анионные (ReO - 4 ). Нек-рые металлы реагируют с разб. HNO3 и H2SO4 с образованием катионных комплексов и пас-сивируются в конц. р-рах этих к-т. Для растворения малоактивных металлв, напр. Аu или Pt, используют смеси, содержащие окислитель и поставщик лигандов для образования р-римых комплексов, таких, как, напр., царская водка или смесь HNO3 с HF.
О взаимод, металлов со средой, ведущем к разрушению металлов, см. в ст. Коррозия металлов.
Важная характеристика металлич. элементов-их способность образовывать основные оксиды и соотв. гидроксиды. У металлов главных подгрупп периодич. системы основность оксидов и гидроксидов растет сверху вниз, в побочных подгруппах (кроме I - III) - обратная зависимость. По периодам и рядам с ростом порядкового номера элемента основность убывает. У металлов, имеющих неск. степеней окисления, как d- и f-металлы, с ростом степени окисления основность оксидов уменьшается и высшие оксиды имеют кислотный характер.
Получение металлов.Извлечение металлов из прир. сырья и др. источников - область металлургии. Можно отметить двоякий характер технологии металлов. Технология железа, тяжелых цветных металлов, а также малых металлов и большинства рассеянных элементов (халькофильных элементов) имеет "металлур-гич." характер. Это означает, что конечный продукт получают без предварит. выделения к.-л. чистого соединения, что обусловлено сравнит. легкостью восстановления до металлов как пирометаллургич. (см. Пирометаллургия), так и гидроме-таллургич. (электролиз р-ров, цементация и т.п.; см. Гидрометаллургия)путем.
Иной характер имеет технология легких, а также редких металлы (литофильных элементов). Это связано с трудностями их получения в своб. состоянии. Для этих металлов технология разбивается четко на два этапа - получение чистого соед., напр. Аl2О3, и получение металла из этого соединения. Сами металлы в произ-ве их соед. обычно не используют. Поэтому можно сказать, что технология этих металлов имеет более "химический" характер.
Способность металлов к взаимному растворению с образованием при кристаллизации твердых растворов и интерметал-лидов, разнообразным фазовым превращениям дает возможность получения большого числа сплавов, отличающихся разл. структурой и самыми разнообразными сочетаниями св-в. В совр. технике применяют св. 30 000 разл. сплавов - легкоплавких и тугоплавких, очень твердых и пластичных, с большой и малой электрич. проводимостью, ферромагнитных и др. В сплавах ныне используют практически все известные металлы (кроме искусственно полученных трансплутониевых элементов). Мера использования в значит. степени определяется доступностью металла-содержанием в земной коре, а также степенью концентрирования в месторождениях и трудностью получения. Использование сплавов (бронзовый век) было одним из важнейших этапов становления человеческой цивилизации. И в настоящее время сплавы-важнейшие конструкционные материалы. В последние годы наблюдается тенденция нек-рого снижения роли железа и увеличение использования легких металлов (Al, Mg) и наиб. доступных редких металлов (Ti, Nb, Zr).
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическая связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, напр. Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда N атомов Li образуют кристаллич. решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на N уровней, расстояния между к-рыми из-за большой величины N настолько малы, что их совокупность может считаться практически непрерывной зоной энергетич. уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, напр., в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координац. число (число ближайших соседей) в кристаллич. решетках металлов обычно 8 или больше 8. Для наиб. часто встречающихся кристаллич. структур координац. числа равны 8 (объемноцентрир. кубич.), 12 (гранецентрир. кубическая и гексаген. плотно-упакованная). Расчеты параметров металлич. решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в 2 до 2,9 . 10 -19 Дж для кристаллич. Li.
Во мн. металлах металлическая связь между атомами включает вклады ионной или ковалентной составляющей. Особенности металлической связи у каждого металла м. б. связаны, напр., с электростатич. отталкиванием ионов друг от друга с учетом распределения электрич. зарядовое них, с вкладом в образование связи электронов внутр. незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и нек-рыми др. причинами.
Металлическая связь характерна не только для металлов и их сплавов, но и для металлических соединений (см. также Интерметал-лиды), она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Большая Энциклопедия Нефти и Газа
Прочность ковалентной связи близка по величине к прочности ионной связи и значительно превышает межмолекулярную. Твердость, температура плавления, тепловое расширение не являются признаками отличия ионных кристаллов от кристаллов, связанных чисто ковалентной связью. Соединения с ковалентной связью отличаются по физическим свойствам в гораздо большей степени, чем ионные. [1]
Прочность ковалентной связи определяется удаленностью электронов, участвующих в образовании молекул от ядер атомов. Электронная пара, близко расположенная к ядрам двух атомов, создает высокую электронную плотность между ними. Этим обеспечивается более прочная связь между атомами. Например, связь между атомами хлора в молекуле С12 прочнее связи между атомами иода в молекуле 12, и метан СН4 прочнее моносилана SiUt, так как электроны, участвующие в образовании ковалентных связей с водородом, у углерода ближе расположены к ядру, чем у кремния. [2]
Чем же определяется прочность ковалентной связи . [3]
Таким образом, прочность ковалентной связи обусловлена тем, что для ее разрыва всегда необходима затрата некоторой энергии. [5]
С увеличением атомного номера для элементов данной группы прочность ковалентной связи и тенденция к образованию решетки по правилу ( 8 - N) уменьшаются. Свинец ( та же группа, VI период) является металлом. [7]
В некоторых случаях прочность водородных связей может приблизиться к прочности ковалентной связи . Например, ди-польный момент звеньев поливинилового спирта составляет около 1 6 D, что намного меньше дипольного момента звеньев поливи-нилиденхлорида. [8]
В структуре ( в) связь Н - Y и прочность ковалентной связи будет незначительной. На этом основании было показано, что относительные количества этих структур соответственно равны 61, 34 и 5 % 14, а следовательно, вполне законно считать водородную связь по существу электростатической. [9]
В структуре ( 0) связь Н - Y и прочность ковалентной связи будет незначительной. [10]
В структуре ( в) связь Н - Y и прочность ковалентной связи будет незначительной. На этом основании было показано, что относительные количества этих структур соответственно равны 61, 34 и 5 % 14, а следовательно, вполне законно считать водородную связь по существу электростатической. [11]
Если для чистого карбида титана повышение дефектности по углероду вызывает снижение прочности преимущественно ковалентной связи Me-С ( с увеличением общей доли нелокализованных электронов) и, в свою очередь, уменьшение модуля упругости, то для твердых растворов ( Ti, W) CX влияние вклада связей ( ковалентных) между атомами разнородных металлов ( Ti-W) настолько велико, что снижение прочности связи Me1 ( Me11) - С не играет существенной роли и модуль упругости сложных карбидов нечувствителен к изменению содержания углерода. [12]
Металлические связи могут иметь различную прочность, однако она сопоставима с прочностью ионных и ковалентных связей . [13]
Теперь можно получить качественное объяснение направленной валентности, если предположить, что прочность ковалентной связи примерно пропорциональна величине перекрывания. Рассмотрим некоторые перекрывающиеся орбитали с этой точки зрения. [14]
Несмотря на бесспорность того, что rf - электроны оказывают влияние на условия образования и прочность ковалентных связей , возникающих при адсорбции на металлах, нельзя ожидать простой зависимости между теплотой хемосорбции и каким-либо свойством, связанным с rf - электронами, так как хемосорб-ция зависит также от других свойств металлов. Последний член в выражении ( 32), учитывающий электроотрицательность металла, до некоторой степени характеризует легкость потери металлом электронов. Следует указать, что порядок расположения металлов по уменьшению теплот хемосорбции ( ем. V, 86) почти совпадает с порядком их расположения по возрастанию работ выхода. Для образования диполей с участием адсорбированных атомов и металла необходимо совершить работу против работы выхода, свойственной металлу. Поэтому можно предположить, что чем меньше работа выхода, тем меньшую работу необходимо совершить для образования этих диполей и тем больше будет дипольный момент. [15]
Прочность металлической связи возрастает с ростом числа валентных электронов, участвующих в ее образовании, о чем можно судить по температурам плавления. Титан, цирконий и гафний имеют по 4 валентных электрона ( хотя точно не известно, сколько электронов они отдают на образование металлической связи), их температуры плавления выше температур плавления, например, металлов третьей группы, но ниже температур плавления металлов V и VI групп, имеющих большее число валентных электронов. [1]
Действительно, прочность металлической связи возрастает в периоде системы элементов при переходе от металла к металлу слева направо. Так, в шестом периоде, например, температура плавления значительно повышается от цезия к лантану. Это означает, что кристаллическая решетка цезия по прочности уступает решетке бария, а прочность последней-решетке лантана. [2]
От чего зависит прочность металлической связи . [3]
Почему деформация металлов не сказывается на прочности металлической связи . [4]
Высокие или низкие температуры плавления и кипения металлов определяются прочностью металлических связей . Понятие энергии связи к металлическим связям не применяется из-за их многоцентровой природы. [5]
Теория взаимодействия водорода с решеткой металла; водород является разновидностью дефекта, понижающего прочность коге-зионной металлической связи . [6]
Прочность металлической связи зависит от энергии притяжения и отталкивания между катионами и электронами. Электроположительная ионная решетка и электроотрицательный электронный газ взаимно нейтрализуют друг друга. Свободные электроны могут перемещаться между ионами. [7]
Методологической основой для работ Г. В. Ужика является идея функциональной связи между сопротивлением отрыву, как физической константой материала, и техническим пределом текучести материала ( сго 2) - Между тем связь между сопротивлением отрыву и техническим условным пределом текучести принципиально недопустима. Сопротивление отрыву, как физическая константа материала, действительно существует и представляет собой прочность металлической связи при разрушении металла без пластической деформации. Технический же предел текучести - это текущая ордината кривой деформации, условно задаваемая в технике величиной остаточной деформации. Определение сопротивления отрыва по Г. В. Ужику тем самым превращается в определение переменной величины, являющейся тенью текущей ординаты кривой деформации и послушно следующей за ее значением; сопротивление отрыву по Ужику теряет смысл физической константы, имеющей определенное количественное значение. [8]
Все металлы VIII группы имеют небольшой объем атомов, плотную упаковку кристаллической решетки п, как следствие этого, прочность металлической связи и высокие температуры плавления. Важной особенностью железа, кобальта и никеля является способность этих металлов к намагничиванию. Переменная степень окисления членов подгруппы VIПВ обусловливает отчасти и их разнообразнейшие каталитические свойства. Способность образовывать кислородные соединения з каждом ряду VIII группы быстро уменьшается с возрастанием порядкового номера. [9]
В работе Бонда [11] анализируются физические и каталитические свойства металлов VIII группы и Си, Ag и Аи. Подчеркивается, что при переходе в VIII группе слева направо отношение электрон: атом увеличивается, а вместе с этим уменьшается прочность металлической связи за счет уменьшения количества неспаренных электронов, что ведет к ослаблению прочности связей с адсорбированной молекулой. [10]
Например, сравним теплоты испарения магния и алюминия. Более высокое значение для алюминия показывает, что металлическая связь действительно становится более прочной при увеличении числа валентных электронов и заряда ядра. Таким образом, прочность металлической связи возрастает при переходе от элемента к элементу вдоль периода периодической таблицы слева направо. Кристаллические решетки переходных металлов являются более прочными, и эти металлы плавятся и кипят при более высоких температурах, чем щелочные и щелочно-земельные металлы. [12]
Металлическая связь осуществляется путем образования из внешних, относительно слабо связанных с ядром электронов отрицательно заряженного электронного газа, организующего положительно заряженные ионы в - плотную, но довольна пластичную кристаллическую решетку. Электроны легко перемещаются от атома к атому, обусловливая высокую электропроводность металла. Большинство металлов имеет одну из трех кристаллических решеток: гексагональную плотноупакованную, гранецентрированную кубическую или объ-емноцентрированную кубическую. Прочность металлической связи увеличивается с повышением концентрации электронного газа. [13]
В этом и состоит сущность металлической связи. Металлическая связь отличается от ковалентной связи тем, что в обобществлении принимают участие электроны всех атомов металла. Она будет гораздо сильнее в тех элементах, которые имеют больше одного наружного электрона и более высокий заряд ядра. В этом случае в электронном газе находится больше электронов и каждый электрон связан с ядром более прочно благодаря увеличенному его заряду. Действительно, прочность металлической связи возрастает в периоде системы элементов при переходе от металла к металлу слева направо. Так, в шестом периоде, например, температура плавления значительно повышается от цезия к лантану. [15]
Металлическая связь. Свойства металлической связи
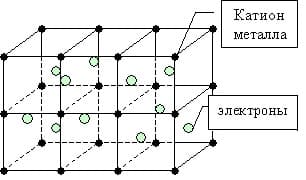
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Читайте также:
