Радиоактивные металлы в таблице менделеева
Обновлено: 18.05.2024
химические элементы, все изотопы которых радиоактивны. К числу Р. э. принадлежат Технеций (атомный номер 43), Прометий (61), Полоний (84) и все последующие элементы в периодической системе Менделеева. К 1975 известно 25 Р. э. Те из них, которые расположены в периодической системе за ураном, называются трансурановыми элементами (См. Трансурановые элементы). 14 Р. э. с атомным номером 90—103 во многом сходны между собой; они составляют семейство актиноидов (См. Актиноиды). Из природных Р. э. только два — Торий (атомный номер 90) и Уран (92) имеют изотопы, периоды полураспада которых (T1/2) сравнимы с возрастом Земли. Это 232 Th (T1/2 = 1,41․10 10 лет), 235 U (T1/2 = 7,13․10 8 лет) и 238 U (T1/2 = 4,51․10 9 лет). Поэтому торий и уран сохранились на нашей планете со времён её формирования и являются первичными Р. э. Изотопы 232 Th, 235 U и 238 U дают начало естественным радиоактивным рядам (См. Радиоактивные ряды), в состав которых входят в качестве промежуточных членов вторичные природные Р. э. с атомный номер 84—89 и 91. Периоды полураспадов всех изотопов этих элементов сравнительно невелики, и, если бы их запасы не пополнялись непрерывно за счёт распада долгоживущих изотопов U и Th, они давно бы уже полностью распались.
Р. э. с атомный номер 43, 61, 93 и все последующие называются искусственными, т.к. их получают с помощью искусственно проводимых ядерных реакций. Это деление Р. э. на природные и искусственные довольно условно; так, Астат (атомный номер 85) был сначала получен искусственно, а затем обнаружен среди членов естественных радиоактивных рядов. В природе найдены также ничтожные количества технеция, прометия, нептуния (См. Нептуний) (атомный номер 93) и плутония (См. Плутоний) (94), возникающих при делении ядер урана — либо спонтанном, либо вынужденном (под действием нейтронов космических лучей и др.).
Два Р. э. — Th и U — образуют большое число различных минералов. Переработка природного сырья позволяет получать эти элементы в больших количествах. Р. э. — члены естественных радиоактивных рядов — могут быть выделены радиохимическими методами из отходов производства Th и U, а также из торий- или урансодержащих препаратов, хранившихся долгое время. Np, Pu и др. лёгкие трансурановые элементы получают в атомных реакторах за счёт ядерных реакций изотопа 238 U с нейтронами. С помощью различных ядерных реакций получают и тяжёлые трансурановые элементы Tc и Pm образуются в атомных реакторах и могут быть выделены из продуктов деления.
Многие Р. э. имеют важное практическое значение. U и Ри используют как делящийся материал в ядерных реакторах и в ядерном оружии. Облучение тория (его природного изотопа 232 Th) нейтронами позволяет получить изотоп 233 U — делящийся материал. Pm, Po, Pu и др. Р. э. применяют для изготовления атомных электрических батареек со сроком непрерывной работы до нескольких лет. См. статьи об отдельных радиоактивных элементах, а также Радиоактивные минералы, Ториевые руды, Урановые руды.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Радиоактивный металл и его свойства. Какой самый радиоактивный металл
Среди всех элементов периодической системы значительная часть принадлежит таким, о которых большинство людей говорят со страхом. А как же иначе? Ведь они являются радиоактивными, а это означает прямую угрозу здоровью людей.
Попробуем разобраться, какие же именно элементы являются опасными, и что они собой представляют, а также выясним, в чем заключается их вредоносное действие на организм человека.

Общее понятие о группе радиоактивных элементов
В данную группу входят металлы. Их достаточно много, располагаются они в периодической системе сразу после свинца и до самой последней ячейки. Главный критерий, по которому принято относить тот или иной элемент к группе радиоактивных, - это его способность обладать определенным периодом полураспада.
Другими словами, радиоактивный распад - это преобразование ядра металла в другое, дочернее, которое сопровождается испусканием излучения определенного вида. При этом происходят превращения одних элементов в другие.
Радиоактивный металл - это тот, у которого хотя бы один изотоп является таковым. Даже если всего разновидностей будет шесть, и при этом лишь одна из них будет носителем данного свойства, весь элемент станет считаться радиоактивным.
Виды излучений
Основными вариантами излучения, которое испускается металлами при распадах, являются:
- альфа-частицы;
- бета-частицы или нейтринный распад;
- изомерный переход (гамма-лучи).
Есть два варианта существования подобных элементов. Первый - это естественный, то есть когда радиоактивный металл встречается в природе и самым простым путем под влиянием внешних сил с течением времени преобразуется в иные формы (проявляет свою радиоактивность и распадается).

Вторая группа - это искусственно созданные учеными металлы, способные к быстрому распаду и мощному выделению большого количества радиационного излучения. Делается это для использования в определенных сферах деятельности. Установки, в которых производятся ядерные реакции по превращениям одних элементов в другие, называются синхрофазотронами.
Разница между двумя обозначенными способами полураспада очевидна: в обоих случаях он самопроизвольный, однако лишь искусственно полученные металлы дают именно ядерные реакции в процессе деструктуризации.
Основы обозначения подобных атомов
Так как у большей части элементов лишь один или два изотопа являются радиоактивными, принято указывать конкретный вид при обозначениях, а не весь элемент в целом. Например, свинец - это просто вещество. Если же принимать во внимание, что он - радиоактивный металл, то следует называть его, например, "свинец-207".
Периоды полураспада рассматриваемых частиц могут сильно варьироваться. Есть изотопы, которые существуют лишь 0,032 секунды. Но наравне с ними встречаются и те, что распадаются миллионы лет в земных недрах.
Радиоактивные металлы: список
Полный перечень всех принадлежащих к рассматриваемой группе элементов может быть достаточно внушительным, ведь всего к ней относятся около 80 металлов. В первую очередь это все, стоящие в периодической системе после свинца, включая группу лантаноидов и актиноидов. То есть висмут, полоний, астат, радон, франций, радий, резерфордий и так далее по порядковым номерам.

Выше обозначенной границы располагается множество представителей, каждый из которых также имеет изотопы. При этом некоторые из них могут быть как раз радиоактивными. Поэтому важно, какие разновидности имеет химический элемент. Радиоактивный металл, точнее одна из его изотопных разновидностей, есть практически у каждого представителя таблицы. Например, их имеют:
- кальций;
- селен;
- гафний;
- вольфрам;
- осмий;
- висмут;
- индий;
- калий;
- рубидий;
- цирконий;
- европий;
- радий и другие.
Таким образом, очевидно, что элементов, проявляющих свойства радиоактивности, очень много - подавляющее большинство. Часть из них безопасна из-за слишком длинного периода полураспада и содержится в природе, другая же создана искусственно человеком для различных нужд в науке и технике и является крайне опасной для организма людей.
Характеристика радия
Название элементу дано его первооткрывателями - супругами Кюри, Пьером и Марией. Именно эти люди впервые обнаружили, что один из изотопов этого металла - радий-226 - это наиболее устойчивая форма, обладающая особыми свойствами радиоактивности. Это произошло в 1898 году, и о подобном явлении только стало известно. Подробным его изучением как раз и занялись супруги химики.
Этимология слова берет корни из французского языка, на котором оно звучит как radium. Всего известно 14 изотопных модификаций данного элемента. Но наиболее устойчивые формы с массовыми числами:
Ярко выраженной радиоактивностью обладает форма 226. Сам по себе радий - химический элемент под номером 88. Атомная масса [226]. Как простое вещество способен к существованию. Представляет собой серебристо-белый радиоактивный металл с температурой плавления около 670 0 С.

С химической точки зрения проявляет достаточно высокую степень активности и способен реагировать с:
- водой;
- органическими кислотами, формируя устойчивые комплексы;
- кислородом, образуя оксид.
Свойства и применение
Также радий - химический элемент, который формирует ряд солей. Известны его нитриды, хлориды, сульфаты, нитраты, карбонаты, фосфаты, хроматы. Также есть двойные соли с вольфрамом и бериллием.
То, что радий-226 может быть опасен для здоровья, его первооткрыватель Пьер Кюри узнал не сразу. Однако сумел убедиться в этом, когда провел эксперимент: сутки он ходил с привязанной к плечевой части руки пробиркой с металлом. На месте контакта с кожей появилась незаживающая язва, избавиться от которой ученый не мог больше двух месяцев. От своих экспериментов над явлением радиоактивности супруги не отказались, поэтому и умерли оба от большой дозы облучения.
Помимо отрицательного значения, существует и ряд областей, в которых радий-226 находит применение и приносит пользу:
Плутоний и его изотопы
Данный элемент был открыт в сороковых годах XX века американскими учеными. Впервые его выделили из урановой руды, в которой он сформировался из нептуния. Последний при этом - результат распада уранового ядра. То есть все они между собой тесно взаимосвязаны общими радиоактивными превращениями.

Существует несколько устойчивых изотопов данного металла. Однако наиболее распространенной и важной практически разновидностью является плутоний-239. Известны химические реакции данного металла с:
- кислородом,
- кислотами;
- водой;
- щелочами;
- галогенами.
По своим физическим свойствам плутоний-239 является хрупким металлом с температурой плавления 640 0 С. Основные способы воздействия на организм - это постепенное формирование онкологических заболеваний, накапливание в костях и вызывание их разрушения, заболевания легких.
Область использования - в основном ядерная промышленность. Известно, что при распаде одного грамма плутония-239 выделяется такое количество теплоты, которое сравнимо с 4-мя тоннами сгоревшего угля. Именно поэтому этот вид металла находит такое широкое применение в реакциях. Ядерный плутоний - источник энергии в атомных реакторах и термоядерных бомбах. Он же используется при изготовлении электрических аккумуляторов энергии, срок службы которых может достигать пяти лет.
Уран - источник радиации
Данный элемент был открыт в 1789 году химиком из Германии Клапротом. Однако исследовать его свойства и научиться применять их на практике люди сумели лишь в XX веке. Основная отличительная особенность в том, что радиоактивный уран способен при естественном распаде образовывать ядра:
- свинца-206;
- криптона;
- плутония-239;
- свинца-207;
- ксенона.
В природе этот металл светло-серого цвета, обладает температурой плавления свыше 1100 0 С. Встречается в составе минералов:
- Урановые слюдки.
- Уранинит.
- Настуран.
- Отенит.
- Тюянмунит.
Известны три стабильных природных изотопа и 11 искусственно синтезированных, с массовыми числами от 227 до 240.

В промышленности широко используется радиоактивный уран, способный быстро распадаться с высвобождением энергии. Так, его используют:
- в геохимии;
- горном деле;
- ядерных реакторах;
- при изготовлении ядерного оружия.
Влияние на организм человека ничем не отличается от предыдущих рассмотренных металлов - накопление приводит к повышенной дозе облучения и возникновению раковых опухолей.
Трансурановые элементы
Самыми главными из металлов, стоящих вслед за ураном в периодической системе, являются те, что были открыты совсем недавно. Буквально в 2004 году в свет вышли источники, подтверждающие рождение на свет 115 элемента периодической системы.
Им стал самый радиоактивный металл из всех известных на сегодняшний день - унунпентий (Uup). Его свойства остаются не изученными до сих пор, ведь период полураспада составляет 0,032 секунды! Рассмотреть и выявить подробности строения и проявляемые особенности при таких условиях просто невозможно.
Однако его радиоактивность во много раз превосходит показатели второго по данному свойству элемента - плутония. Тем не менее используется на практике не унунпентий, а более "медленные" его товарищи по таблице - уран, плутоний, нептуний, полоний и прочие.
Еще один элемент - унбибий - теоретически существует, однако доказать это практически ученые разных стран не могут с 1974 года. Последняя попытка была совершена в 2005 году, однако оказалась не подтвержденной общим советом ученых-химиков.
Торий
Был открыт еще в XIX веке Берцелиусом и назван в честь скандинавского бога Тора. Является слаборадиоактивным металлом. Такой особенностью обладают пять из его 11-ти изотопов.
Основное применение в ядерной энергетике основано не на способности испускать огромное количество тепловой энергии при распаде. Особенность в том, что ядра тория способны захватывать нейтроны и превращаться в уран-238 и плутоний-239, которые уже и вступают непосредственно в ядерные реакции. Поэтому и торий можно отнести к группе рассматриваемых нами металлов.

Полоний
Серебристо-белый радиоактивный металл под номером 84 в периодической системе. Открыт был все теми же ярыми исследователями радиоактивности и всего, что с ней связано, супругами Марией и Пьером Кюри в 1898 году. Главная особенность этого вещества в том, что оно свободно существует около 138,5 дней. То есть таков период полураспада данного металла.
В природе встречается в составе урановых и других руд. Используется как источник энергии, причем достаточно мощной. Является стратегическим металлом, так как применяется для изготовления ядерного оружия. Количество строго ограничено и находится под контролем каждого государства.
Также используется для ионизации воздуха, устранения статического электричества в помещении, при изготовлении космических обогревателей и прочих схожих предметов.
Воздействие на организм человека
Все радиоактивные металлы обладают способностью проникать сквозь кожу человека и накапливаться внутри организма. Они очень плохо выводятся с продуктами жизнедеятельности, вообще не выводятся с потом.
Со временем начинают поражать дыхательную, кровеносную, нервную системы, вызывая в них необратимые изменения. Воздействуют на клетки, заставляя их функционировать неправильно. В результате происходит образование злокачественных опухолей, возникают онкологические заболевания.
Поэтому каждый радиоактивный металл - большая опасность для человека, особенно если говорить о них в чистом виде. Нельзя трогать их незащищенными руками и находиться в помещении вместе с ними без специальных защитных приспособлений.
Полный список металлов, известных науке
Посмотрите вокруг на секунду. Сколько металлических вещей вы можете увидеть? Обычно, когда мы думаем о металлах, мы вспоминаем о веществах, которые являются блестящими и прочными. Однако они также находятся в нашей пище и в наших телах. Давайте познакомимся с полным списком металлов, известных науке, узнаем их основные свойства и выясним, почему они такие особенные.

Элементы, легко теряющие электроны, которые являются блестящими (отражающими), податливыми (могут быть отлиты в другие формы) и считаются хорошими проводниками тепла и электричества, называют металлами. Они имеют решающее значение для нашего образа жизни, так как не только являются частью структур и технологий, но и важны для производства почти всех предметов. Металл есть даже в человеческом теле. Взглянув на этикетку состава мультивитаминов, вы увидите десятки перечисленных соединений.
Возможно, вы не знали, что такие элементы, как натрий, кальций, магний и цинк, необходимы для жизни, и, если они отсутствуют в наших телах, наше здоровье может быть в серьезной опасности. Например, кальций необходим для здоровых костей, магний - для метаболизма. Цинк усиливает функцию иммунной системы, а железо помогает клеткам крови переносить кислород по всему телу. Однако металлы в наших телах отличаются от металла в ложке или стальном мосте тем, что они потеряли электроны. Они называются катионами.
Металлы также обладают антибиотическими свойствами, поэтому перила и ручки в общественных местах часто изготавливаются из этих элементов. Известно, что многие инструменты делаются из серебра для предотвращения размножения бактерий. Искусственные суставы изготавливаются из титановых сплавов, которые одновременно предотвращают заражение и делают реципиентов сильнее.
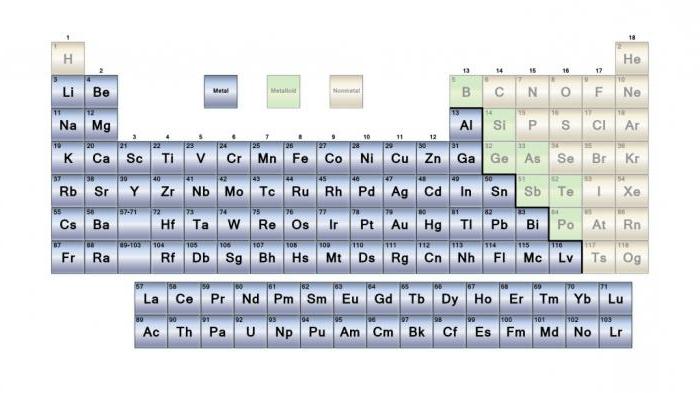
Металлы в периодической таблице
Все элементы в периодической системе Дмитрия Менделеева делятся на две большие группы: металлы и неметаллы. Первая является самой многочисленной. Большинство элементов - металлы (синий). Неметаллы в таблице изображены на желтом фоне. Есть также группа элементов, которые относят к металлоидам (красный). Все металлы сгруппированы в левой части таблицы. Обратите внимание, что водород сгруппирован с металлами в верхнем левом углу. Несмотря на это, он считается неметаллическим. Однако некоторые ученые теоретизируют, что в ядре планеты Юпитер может быть металлический водород.

Металлическое связывание
Многие из замечательных и полезных качеств элемента связаны с тем, как его атомы соединяются друг с другом. При этом возникают определенные связи. Металлическое взаимодействие атомов приводит к созданию металлических структур. Любой образец этого элемента в повседневной жизни, от автомобиля до монет в кармане, включает в себя металлическое соединение.

Во время этого процесса атомы металла разделяют свои внешние электроны равномерно друг с другом. Электроны, протекающие между положительно заряженными ионами, легко передают тепло и электроэнергию, делая эти элементы такими хорошими проводниками тепла и электричества. Медные провода используются для электроснабжения.

Реакции металлов
Реакционная способность относится к тенденции элемента реагировать с химическими веществами в его окружении. Она бывает разная. Некоторые металлы, например, калий и натрий (в колонках 1 и 2 в периодической таблице), легко реагируют со многими различными химическими веществами и редко встречаются в своей чистой, элементарной форме. Оба обычно существуют только в соединениях (связанных с одним или несколькими другими элементами) или как ионы (заряженная версия их элементарной формы).

С другой стороны, существуют и другие металлы, их еще называют ювелирными. Золото, серебро и платина являются не очень реактивными и обычно встречаются в чистом виде. Эти металлы легче теряют электроны, чем неметаллы, но не так легко, как реактивные металлы, например, натрий. Платина относительно нереакционноспособна и очень устойчива к реакциям с кислородом.
Свойства элементов
Когда вы изучали алфавит в начальной школе, вы обнаружили, что все буквы имеют свой собственный уникальный набор свойств. Например, у некоторых были прямые линии, у некоторых - кривые, а у других были линии обоих типов. То же самое можно сказать и об элементах. Каждый из них имеет уникальный набор физических и химических свойств. Физические свойства - это качества, присущие определенным веществам. Блестящий или нет, насколько он хорошо проводит тепло и электричество, при какой температуре тает, насколько большую имеет плотность.

Химические свойства включают те качества, которые наблюдаются при реагировании на воздействие кислородом, если они будут гореть (то, насколько сложно им будет удерживать их электроны во время химической реакции). Различные элементы могут иметь общие свойства. Например, железо и медь являются одновременно элементами, которые проводят электричество. Однако они не имеют одинаковых свойств. Например, когда железо подвергается воздействию влажного воздуха, оно покрывается ржавчиной, но когда медь оказывается под действием тех же условий, она приобретает специфический зеленый налет. Вот почему статуя Свободы зеленая, а не ржавая. Она сделана из меди, а не железа).

Организация элементов: металлы и неметаллы
Тот факт, что элементы имеют некоторые общие и уникальные свойства, позволяет сортировать их в красивую, аккуратную диаграмму, которая называется периодической таблицей. Она организует элементы на основе их атомного числа и свойств. Итак, в периодической таблице мы находим элементы, сгруппированные вместе, которые имеют общие свойства. Железо и медь находятся близко друг к другу, оба являются металлами. Железо обозначено символом «Fe», а медь обозначается символом «Cu».

Большинство элементов периодической таблицы - это металлы, и они, как правило, находятся в левой части таблицы. Они группируются вместе, потому что обладают определенными физическими и химическими свойствами. Например, металлы плотные, блестящие, они хорошие проводники тепла и электричества, и они легко теряют электроны в химических реакциях. Напротив, неметаллы имеют противоположные свойства. Они не плотные, не проводят тепло и электричество, и стремятся получить электроны, а не отдать их. Когда мы смотрим в периодическую таблицу, мы видим, что большинство неметаллов сгруппированы справа. Это такие элементы, как гелий, углерод, азот и кислород.

Что такое тяжелые металлы?
Список металлов достаточно многочисленный. Некоторые из них могут накапливаться в организме и не наносить ему при этом вреда, как например, природный стронций (формула Sr), который является аналогом кальция, так как продуктивно откладывается в костной ткани. Какие из них называются тяжелыми и почему? Рассмотрим четыре примера: свинец, медь, ртуть и мышьяк.
Где находятся эти элементы и как они влияют на окружающую среду и здоровье человека? Тяжелые металлы представляют собой металлические, встречающиеся в природе соединения, которые имеют очень высокую плотность по сравнению с другими металлами - по меньшей мере, они в пять раз больше плотности воды. Они токсичны для людей. Даже небольшие дозы могут привести к серьезным последствиям.

- Свинец. Это тяжелый металл, являющийся токсичным для людей, особенно для детей. Отравление этим веществом может привести к проблемам неврологического характера. Несмотря на то что когда-то он был весьма привлекательным из-за его гибкости, высокой плотности и способности поглощать вредное излучение, свинец был выведен из употребления по многим направлениям. Этот мягкий серебристый металл, который встречается на Земле, является опасным для людей и накапливается в организме в течение долгого времени. Самое страшное, что от него нельзя избавиться. Он сидит там, накапливается и постепенно отравляет тело. Свинец токсичен для нервной системы и может вызвать серьезное повреждение головного мозга у детей. Он широко использовался в 1800-х годах для создания макияжа и вплоть до 1978 года использовался в качестве одного из ингридиентов в краске для волос. Сегодня свинец используется в основном в больших батареях, в качестве экранов для рентгеновских лучей или изоляции для радиоактивного материала.
- Медь. Это красновато-коричневый тяжелый металл, у которого есть множество применений. Медь по-прежнему является одним из лучших проводников электричества и тепла, и многие электрические провода сделаны из этого металла и покрыты пластиком. Монеты, в основном мелочь, также делают из этого элемента периодической системы. Острые отравления медью встречаются редко, но, как и свинец, она может накапливаться в тканях, что в конечном итоге приводит к токсичности. Люди, которые подвергаются воздействию большим количеством меди или медной пыли, также находятся в зоне риска.
- Ртуть. Этот металл токсичен в любой форме и может даже поглощаться кожей. Его уникальность состоит в том, что он является жидким при комнатной температуре, его иногда называют «быстрым серебром». Его можно увидеть в термометре, потому что в качестве жидкости он поглощает тепло, изменяя объем даже с малейшей разницей в температуре. Это позволяет ртути подниматься или падать в стеклянной трубке. Поскольку это вещество является мощным нейротоксином, многие компании переходят на спиртовые термометры, окрашенные в красный цвет.
- Мышьяк. Со времен Римской империи вплоть до викторианской эпохи мышьяк считался «королем ядов», а также «ядом царей». История пронизана бесчисленными примерами как королевских лиц, так и простых людей, совершающих убийства для личной выгоды, используя соединения мышьяка, у которых не было ни запаха, ни цвета, ни вкуса. Несмотря на все отрицательные влияния, этот металлоид также имеет свои области применения, даже в медицине. Например, триоксид мышьяка является очень эффективным препаратом, используемым для лечения людей с острым промиелоцитарным лейкозом.

Что такое драгоценный металл?
Драгоценный металл представляет собой металл, который может быть редким или трудно добываемым, а также экономически очень ценным. Каков список металлов, являющихся драгоценными? Всего их три:
- Платина. Несмотря на свою тугоплавкость, она используется в ювелирных изделиях, электронике, автомобилях, в химических процессах и даже в медицине.
- Золото. Этот драгоценный металл используется для изготовления ювелирных изделий и золотых монет. Однако он имеет много других применений. Он используется в медицине, производстве и лабораторном оборудовании.
- Серебро. Этот благородный металл серебристо-белого цвета является очень ковким. в чистом виде является достаточно тяжелым, оно легче свинца, но тяжелее меди.

Металлы: виды и свойства
Большинство элементов можно рассматривать как металлы. Они сгруппированы в середине в левой стороне таблицы. Металлы бывают щелочные, щелочноземельные, переходные, лантаноиды и актиниды.

- твердое вещество при комнатной температуре (за исключением ртути);
- обычно блестящее;
- с высокой температурой плавления;
- хороший проводник тепла и электричества;
- с низкой способностью к ионизации;
- с низкой электроотрицательностью;
- податливый (способный принимать заданную форму);
- пластичный (можно вытянуть в проволоку);
- с высокой плотностью;
- вещество, которое теряет электроны в реакциях.

Список металлов, известных науке
- литий;
- бериллий;
- натрий;
- магний;
- алюминий;
- калий;
- кальций;
- скандий;
- титан;
- ванадий;
- хром;
- марганец;
- железо;
- кобальт;
- никель;
- медь;
- цинк;
- галлий;
- рубидий;
- стронций;
- иттрий;
- цирконий;
- ниобий;
- молибден;
- технеций;
- рутений;
- родий;
- палладий;
- серебро;
- кадмий;
- индий;
- коперниций;
- цезий;
- барий;
- олово;
- железо;
- висмут;
- свинец;
- ртуть;
- вольфрам;
- золото;
- платина;
- осмий;
- гафний;
- германий;
- иридий;
- ниобий;
- рений;
- сурьма;
- таллий;
- тантал;
- франций;
- ливерморий.

Всего известно около 105 химических элементов, большая часть из которых - металлы. Последние являются очень распространенным элементом в природе, который встречается как в чистом виде, так и в составе всевозможных соединений.

Металлы залегают в недрах земли, их можно найти в различных водоемах, в составе тел животных и человека, в растениях и даже в атмосфере. В периодической системе они располагаются начиная с лития (металл с формулой Li) и заканчивая ливерморием (Lv). Таблица она продолжает пополняться новыми элементами, и в основном это металлы.
Радиоактивные металлы
Радиоактивные металлы — это металлы, которые самопроизвольно излучают поток элементарных частиц во внешнюю среду. Этот процесс называют альфа(α), бета(β), гамма(γ) излучением или просто радиоактивным излучением.
Все радиоактивные металлы со временем распадаются и превращаются в стабильные элементы (иногда проходя целую цепочку превращений). У разных элементов радиоактивный распад может длиться от нескольких миллисекунд до нескольких тысяч лет.
Рядом с названием радиоактивного элемента часто указывается массовое число его изотопа. Например, Технеций-91 или 91 Tc. Разные изотопы одного и того же элемента как правило имеют общие физические свойства и различаются лишь длительностью радиоактивного распада.

Список радиоактивных металлов
| Название рус. | Название eng. | Самый стабильный изотоп | Период распада |
|---|---|---|---|
| Технеций | Technetium | Tc-91 | 4.21 x 10 6 лет |
| Прометий | Promethium | Pm-145 | 17.4 года |
| Полоний | Polonium | Po-209 | 102 года |
| Астат | Astatine | At-210 | 8.1 часов |
| Франций | Francium | Fr-223 | 22 минут |
| Радий | Radium | Ra-226 | 1600 лет |
| Актиний | Actinium | Ac-227 | 21.77 лет |
| Торий | Thorium | Th-229 | 7.54 x 10 4 лет |
| Протактиний | Protactinium | Pa-231 | 3.28 x 10 4 лет |
| Уран | Uranium | U-236 | 2.34 x 10 7 лет |
| Нептуний | Neptunium | Np-237 | 2.14 x 10 6 лет |
| Плутоний | Plutonium | Pu-244 | 8.00 x 10 7 лет |
| Америций | Americium | Am-243 | 7370 лет |
| Кюрий | Curium | Cm-247 | 1.56 x 10 7 лет |
| Беркелий | Berkelium | Bk-247 | 1380 лет |
| Калифорний | Californium | Cf-251 | 898 лет |
| Эйнштейний | Einsteinium | Es-252 | 471.7 дней |
| Фермий | Fermium | Fm-257 | 100.5 дней |
| Менделевий | Mendelevium | Md-258 | 51.5 дней |
| Нобелий | Nobelium | No-259 | 58 минут |
| Лоуренсий | Lawrencium | Lr-262 | 4 часа |
| Резенфордий | Rutherfordium | Rf-265 | 13 часов |
| Дубний | Dubnium | Db-268 | 32 часа |
| Сиборгий | Seaborgium | Sg-271 | 2.4 минуты |
| Борий | Bohrium | Bh-267 | 17 секунд |
| Ганий | Hassium | Hs-269 | 9.7 секунд |
| Мейтнерий | Meitnerium | Mt-276 | 0.72 секунды |
| Дармштадий | Darmstadtium | Ds-281 | 11.1 секунды |
| Рентгений | Roentgenium | Rg-281 | 26 секунд |
| Коперниций | Copernicium | Cn-285 | 29 секунд |
| Унунтрий | Ununtrium | Uut-284 | 0.48 секунд |
| Флеровий | Flerovium | Fl-289 | 2.65 секунд |
| Унунпентий | Ununpentium | Uup-289 | 87 миллисекунд |
| Ливерморий | Livermorium | Lv-293 | 61 миллисекунда |
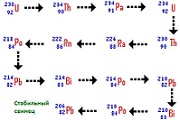
Радиоактивные элементы делятся на естественные (существующие в природе) и искусственные (получаемые в результате лабораторного синтеза). Естественных радиоактивных металлов не много — это полоний, радий, актиний, торий, протактиний и уран. Их наиболее стабильные изотопы встречаются в природе, чаще в виде руды. Все остальные металлы из списка созданы человеком.
Самый радиоактивный металл
Самый радиоактивный металл на данный момент — ливерморий. Его изотоп Ливерморий-293 распадается всего за 61 милисекунду. Впервые этот изотоп был получен в Дубне, в 2000 году.
Другой очень радиоактивный металл — унунпентий. Изотоп унунпентий-289 имеет чуть больший период распада (87 милисекунд).
Из более-менее стабильных, практически применяемых веществ, самым радиоактивным металлом считается полоний (изотоп полоний-210). Это серебристый белый радиоактивный металл. Хотя его период полураспада достигает 100 и более дней, даже один грамм этого вещества раскаляется до 500°C, а излучение может мгновенно убить человека.
Что такое радиация
Всем известно, что радиация очень опасна и лучше держаться подальше от радиоактивного излучения. С этим трудно поспорить, хотя в реальности мы постоянно подвержены влиянию радиации, где бы не находились. В земле залегает довольно большое количество радиоактивной руды, а из космоса на Землю постоянно прилетают заряженные частицы.
Кратко говоря, радиация это самопроизвольное испускание элементарных частиц. От атомов радиоактивного вещества отделяются протоны и нейтроны, «улетая» во внешнюю среду. Ядро атома при этом постепенно изменяется, превращаясь в другой химический элемент. Когда все нестабильные частицы отделяются от ядра, атом перестает быть радиоактивным. Например, торий-232 в конце своего радиоактивного распада превращается в стабильный свинец.
Наука выделяет 3 основных вида радиоактивного излучения
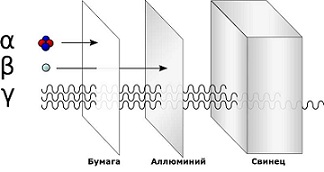
Альфа излучение(α) — поток альфа-частиц, положительно заряженных. Они сравнительно большие по размеру и плохо проходят даже через одежду или бумагу.
Бета излучение(β) — поток бета-частиц, негативно заряженных. Они довольно малы, легко проходят через одежду и проникают внутрь клеток кожи, что наносит большой вред здоровью. Но бета-частицы не проходят через плотные материалы, такие как алюминий.
Гамма излучение(γ) — это высокочастотная электромагнитная радиация. Гамма-лучи не имеют заряда, но содержат очень много энергии. Скопление гамма-частиц излучает яркое свечение. Гамма-частицы проходят даже через плотные материалы, что делает их очень опасными для живых существ. Их останавливают только самые плотные материалы, например, свинец.
Все эти виды излучения так или иначе присутствуют в любой точке планеты. Они не представляют опасности в малых дозах, но при высокой концентрации могут причинить очень серьезный ущерб.
Изучение радиоактивных элементов



Первооткрывателем радиоактивности является Вильгельм Рентген. В 1895 году этот Прусский физик впервые наблюдал радиоактивное излучение. На основе этого открытия был создан знаменитый медицинский прибор, названый в честь ученого.
В 1896 г изучение радиоактивности продолжил Анри Беккерель, он экспериментировал с солями урана.
В 1898 г Пьер Кюри в чистом виде получил первый радиоактивный металл — Радий. Кюри хоть и открыл первый радиоактивный элемент, однако, не успел толком его изучить. И выдающиеся свойства радия привели к быстрой гибели ученого, который беспечно носил свое «детище» в нагрудном кармане. Великое открытие отомстило своему первооткрывателю — Кюри умер в возрасте 47 лет от мощной дозы радиоактивного облучения.
В 1934 г был впервые синтезирован искусственный радиоактивный изотоп.
Сейчас изучением радиоактивности занимаются множество ученых и организаций.
Добыча и синтез



Даже естественные радиоактивные металлы не встречаются в природе в чистом виде. Их синтезируют из урановой руды. Процесс получения чистого металла чрезвычайно трудоемок. Состоит он из нескольких стадий:
- концентрирование (дробление и выделение осадка с ураном в воде);
- выщелачивание - то есть, перевод уранового осадка в раствор;
- выделение чистого урана из полученного раствора;
- перевод урана в твердое состояние.
В итоге, из тонны урановой руды можно получить всего несколько граммов урана.
Синтез искусственных радиоактивных элементов и их изотопов проходит в специальных лабораториях, в которых создаются условия для работы с подобными веществами.
Практическое применение
Чаще всего, радиоактивные металлы используют для выработки энергии.
Ядерные реакторы — это устройства, использующие уран для нагревания воды и создания потока пара, который вращает турбину, с помощью чего вырабатывается электричество.


Вообще, сфера применения радиоактивных элементов довольно широка. Они используются для изучения живых организмов, диагностирования и лечения болезней, выработки энергии и для мониторинга промышленных процессов. Радиоактивные металлы являются основой для создания ядерного оружия — самого разрушительного оружия на планете.
Радиоактивные элементы
Строго говоря, радиоактивным элементом следует называть такой химический элемент, все изотопы которого радиоактивны. Однако на практике этим термином часто называют всякий элемент, в природной смеси которого присутствует хотя бы один радиоактивный изотоп, то есть если элемент проявляет радиоактивность в природе. Кроме того, радиоактивными оказываются все изотопы всех синтезированных на сегодняшний день искусственных элементов.
Радиоактивными элементами в строгом смысле являются все элементы, идущие в таблице Менделеева после свинца (включая висмут), а также элементы технеций и прометий. Следующие элементы содержат в природных смесях хотя бы один радиоактивный изотоп: калий, кальций, ванадий, германий, дубний селен, рубидий, цирконий, молибден, кадмий, индий, теллур, лантан, неодим, самарий, гадолиний, лютеций, гафний, вольфрам, рений, осмий, платина, висмут, торий, уран (в список не включены дочерние элементы из рядов урана и тория, такие как радий, радон и астат, а также образующиеся в атмосфере под действием космических лучей, такие как углерод-14).
Все элементы, идущие за ураном, называются трансурановыми элементами. Есть предположения, что некоторые далёкие трансурановые элементы могут быть не радиоактивными или, во всяком случае, иметь достаточно долгоживущие изотопы, чтобы присутствовать в природе.
Многие радиоактивные элементы имеют важное практическое значение. Уран и плутоний используют как делящийся материал в атомных реакторах и в ядерном оружии. Некоторые радиоактивные элементы применяют для изготовления атомных электрических батареек со сроком непрерывной работы до нескольких лет. Долгоживущие изотопы природных радиоактивных элементов используются в геохронологии.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Радиоактивные элементы" в других словарях:
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — химические элементы (криптон 85, цезий 137, рутений 106, стронций 90, йод 131) с нестабильным атомным ядром, которые при самопроизвольном распаде испускают характерное излучение. Могут вызывать мутагенные, канцерогенные, тератогенные и другие… … Экологический словарь
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — хим. элементы, все изотопы которых радиоактивны (см. ). К ним относятся технеций, прометий, полоний и все последующие элементы конца таблицы Д. И. Менделеева до урана, а также «трансурановые» элементы, что составляет больше 1 /4 всех известных… … Большая политехническая энциклопедия
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — химические элементы, все изотопы которых радиоактивны (технеций, прометий, полоний и все следующие за ним элементы в периодической системе Менделеева) … Большой Энциклопедический словарь
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — химические элементы, все изотопы которых радиоактивны: технеций, прометий, полоний и все последующие элементы периодической системы Д. И. Менделеева. Р. э., расположенные (в периодической системе химических элементов) за ураном, называются… … Российская энциклопедия по охране труда
Радиоактивные элементы — химические элементы, все изотопы которых радиоактивны. К числу Р. э. принадлежат Технеций (атомный номер 43), Прометий (61), Полоний (84) и все последующие элементы в периодической системе Менделеева. К 1975 известно 25 Р. э. Те из них,… … Большая советская энциклопедия
радиоактивные элементы — химические элементы, все изотопы которых радиоактивны (технеций, прометий, полоний и все следующие за ним элементы в периодической системе химических элементов). * * * РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ, химические элементы, все… … Энциклопедический словарь
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — хим. элементы, все изотопы к рых радиоактивны. К числу Р. э. относят технеций Тс (ат. н. Z=43), прометий Pm (Z=61), полоний Ро (Z=84) и все последующие элементы периодич. системы Менделеева. Те из них, к рые расположены в системе Менделеева за… … Большой энциклопедический политехнический словарь
РАДИОАКТИВНЫЕ ЭЛЕМЕНТЫ — хим. элементы, все нуклиды к рых радиоактивны (технеций, прометий, полоний и все следующие за ним элементы в периодич. системе хим. элементов) … Естествознание. Энциклопедический словарь
радиоактивные элементы — химические элементы, все изотопы которых радиоактивны … Большой медицинский словарь
ЭЛЕМЕНТЫ ЦИКЛИЧЕСКИЕ — по Вернадскому, гр. из 44 хим. элементов, геохим. история которых может быть выражена круговыми процессами (циклами). Э. ц. составляют более 99,7% массы земной коры. В эту гр. не включались: благородные газы (5), благородные металлы (7),… … Геологическая энциклопедия
Читайте также:
