Растворимость металлов и сплавов
Обновлено: 16.05.2024
Взаимная растворимость металлов не является обратимым свойством. Из этого обобщения имеются исключения, тем не менее оно является все же полезным правилом. Приводимые ниже цифры, взятые из значительно более подробных данных Юм-Розери, дают некоторое представление о поразительной разнице в растворимости в тех случаях, когда размеры атомов благоприятствуют растворимости. [1]
Взаимная растворимость металлов А и В часто увеличивается с ростом температуры. Если быстро охладить однофазный твердый раствор А - В, равновесный при некоторой температуре TI Гкомн, то образуется пересыщенный твердый раствор. Выдержка закаленного сплава при комнатной или повышенной температуре Т2 ( ТКОМН Т2Тг) приводит к изменению его механических и физических свойств вследствие структурных изменений. Этот процесс называется старением и широко используется как один из весьма эффективных способов обработки сплавов. Старение при комнатной температуре называется естественным, при повышенной - искусственным. [2]
Взаимная растворимость металлов в твердом состоянии зависит от следующих условий. [3]
На взаимную растворимость металлов , кроме геометрического фактора ( близкие размеры атомов), большое влияние оказывает валентный фактор - разница валентности элементов, образующих систему, а также химическая природа атомов. Чем более электроотрицателен один из компонентов и более электроположителен другой, тем больше вероятность образования химического соединения, а не твердого раствора. [4]
Между величинами взаимной растворимости металлов Д руг в друге пет однозначного соответствия. Юм-Розерл обнаружил, что при прочих равных условиях металл с более низкой валентностью растворяет в себе значительно больше мет ал. Несмотря на то что из этого правила возможны исключения, оно бывает полезно. Приведенные - ниже значения, являющиеся частью намного более полных данных Юм-Розери, дают некоторое представление об относительно-резком различии растворимостей даже в тех случаях, когда размерный фактор достаточно благоприятен. [5]
При наличии взаимной растворимости металлов соединение их хорошо осуществляется сваркой плавлением, а также и сваркой давлением в твердом состоянии. [6]
При отсутствии взаимной растворимости металлов в системе вольфрам-медь оба металла растворимы в никеле, вследствие чего при определенных соотношениях компонентов можно получить, используя методы металлокерамики, тройные сплавы с высоким содержанием вольфрама ( напр. Сплавы обладают большой плотностью ( 16), повышенной коррозионной стойкостью и высоким коэфф. Применяются в атомной и авиационной технике, приборостроении и др. областях. [7]
При отсутствии взаимной растворимости металлов в системе вольфрам-медь оба металла растворимы в никеле, вследствие чего при определенных соотношениях компонентов можно получить, используя методы металлокерамики, тройные сплавы с высоким содержанием вольфрама ( напр. Сплавы обладают большой плотностью ( - 16), повышенной коррозионной стойкостью и высоким коэфф. Применяются в атомной и авиационной технике, приборостроении и др. областях. [8]
В связи с тем что взаимная растворимость металлов ( и полуметаллов) в жидком состоянии часто бывает ограниченной и поскольку после завершения взаимодействия основных компонентов металл-растворитель должен быть удален из образовавшегося соединения, применение этого метода ограничено соединениями, практически индифферентными по отношению к тому растворителю, который, применяется для удаления третьего металла. Таким растворителем служит преимущественно разб. В большинстве случаев прз растворении не удается избежать некоторых потерь выделяемого соединения. Этот метод применяется в основном при получении силицидов, бо-ридов, фосфидов н полуметаллов, например GaSe, GaTe, особенно в виде монокристаллов. Другими успешно применяемыми металлами-растворителями являются свинец, алюминий, магний, медь и серебро. Благодаря иногда весьма значительным различиям в растворимости металлов-реагентов в металле-растворителе часто удается, варьируя количества реагентов, получать в расплаве металла-растворителя вполне определенное бинарное соединение из нескольких возможных в данной системе. Как металл-растворитель можно рассматривать и ртуть при образовании амальгам ( см. ниже разд. [9]
При наличии той или иной степени взаимной растворимости металлов , определяемой типом диаграммы фазового состояния, соединение их путем сварки плавлением, а равно и в твердом состоянии осуществить всегда возможно. Наиболее благоприятные результаты получаются при сварке металлов, образующих непрерывный ряд твердых растворов. Сварка металлов с ограниченной растворимостью более сложна. [10]
При наличии той или иной степени взаимной растворимости металлов , определяемой типом диаграммы фазового состояния, соединение их путем сварки плавлением, а равно и в твердом состоянии осуществить всегда возможно. Наиболее благоприятные результаты получаются при сварке металлов, образующих непрерывный ряд твердых растворов. Сварка металлов с ограниченной растворимостью более сложна. [11]
Ошибочно причислять к КМ гомогенные сплавы со взаимной растворимостью металлов ( например, Ni-Си) и плакированные металлы [19] или любые слоистые ( сэндвич) и сотовые структуры, как и многослойные покрытия или изделия с покрытием, поскольку отдельные компоненты таких систем во многих случаях проявляют только свои индивидуальные свойства, несмотря на то что между ними существует межфазная граница. Сотовые и слоистые системы [24] следует рассматривать скорее как композиционные конструкции, а не материалы. Слоистые системы можно условно причислить к композиционным материалам в тех случаях, когда при эксплуатации и наличии диффузии или при малых толщинах пластин одна из них может образовать непрерывную фазу во всем объеме материала. [12]
Определенных данных о существовании особой сингулярной суб-окисной фазы между металлическим цирконием и Zr02 не имеется, однако взаимная растворимость металла и двуокиси при высокой температуре значительна. [13]
Исследованиями, выполненными методами термического 1, микроструктурного [1-3, 5], рентгеновского [2] и термодинамического анализов [4, 6], согласно установлено образование индием и цинком диаграммы состояния эвтектического типа с небольшой взаимной растворимостью металлов в твердом состоянии. [14]
Если сплавляемые элементы принадлежат к разным ( притом, достаточно далеким) группам Периодической системы, взаимодействие между разнородными атомами будет иное, чем взаимодействие между атомами одного и того же элемента; энергия смешения будет велика и взаимная растворимость металлов будет ограничена. [15]
Растворимость металлов в различных жидкостях
а) Хорошо растворяется в соляной кислоте. Медленно растворяется в концентрированной и разбавленной HNO3 н разбавленной Н2SO4.
б) Алюминий и его сплавы хорошо растворяются в концентрированных растворах едких щелочей (20—40% NaOH или KОН).
Бериллий
Хорошо растворяется в соляной и серной кислотах, а также в азотной кислоте при нагревании. Холодная азотная кислота пассивирует металл вследствие образования пленки окиси бериллия.
Растворяется в кислотах-окислителях: в концентрированных азотной и серной, а также в хлорной при нагревании до белого дыма. Сплавляется с едкими щелочами, образуя метабораты.
Ванадий
Растворяется на холоду в «царской водке» и в азотной кислоте. При нагревании растворяется в концентрированной серной и плавиковой кислотах. Сплавляется со щелочами, образуя соли ванадиевой кислоты (ванадаты). Нерастворим в разбавленных серной и соляной кислотах.
Висмут
Хорошо растворяется в разбавленной азотной кислоте, в смеси азотной и соляной кислот, в горячей концентрированной серной кислотах. Нерастворим в разбавленных соляной и серной кислотах.
Вольфрам
Нерастворим в серной и соляной кислотах. Концентрированная азотная кислота и «царская водка» окисляют вольфрам с поверхности, переводя его в нерастворимую вольфрамовую кислоту. Растворяется в смеси плавиковой и азотной кислот. Растворим в смесях кислот, содержащих фосфорную кислоту, вследствие образования комплексной вольфрамо-фосфорной кислоты H7[P(W2O7)6]*xH2O
Растворяется в насыщенном растворе щавелевой кислоты в присутствии перекиси водорода. Сплавляется со щелочами или Na2CO3 в присутствии окислителей (например, КСlO3) с образованием солей вольфрамовой кислоты.
Гафний
Германий
Хорошо растворяется в «царской водке», а также в щелочном растворе перекиси водорода. Кислоты на германий действуют слабо; в азотной кислоте образуется гидрат двуокиси германия.
Железо
Легко растворяется в азотной кислоте, разбавленной серной, а также в соляной кислоте. Чистейшее железо растворяется в азотной кислоте, но не растворяется в соляной.
Золото
Индий
Легко растворяется в соляной кислоте, медленно — в серной, с трудом в концентрированной азотной кислоте.
Кадмий
Растворяется в горячей разбавленной азотной кислоте. Плохо растворяется в разбавленной соляной и серной кислотах; растворение ускоряется в присутствии перекиси водорода.
Кобальт
Растворяется в разбавленной азотной кислоте, а также в разбавленной соляной и серной кислотах. Концентрированные серная и азотная кислоты пассивируют кобальт.
Лантан
Магний
Легко растворяется во всех разбавленных кислотах, в т. ч. и в уксусной. Растворяется в концентрированных растворах хлорида аммония.
Марганец
Растворяется в разбавленных азотной, соляной и серной кислотах с образованием солей двухвалентного марганца (Мn 2+ ). В концентрированной серной кислоте растворяется с выделением SO2
Легко растворяется в азотной кислоте. Нерастворима в соляной и в разбавленной серной кислотах. Концентрированная серная кислота растворяет медь при нагревании до паров Н2SO4. Соляная кислота растворяет медь в присутствии окислителей (например, Fe 3+ , Н2О2, НNО3 и т. д.).
Молибден
Легко растворяется в «царской водке» и в смеси плавиковой и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4. В разбавленной соляной кислоте растворяется при нагревании очень медлепно.
Сплавляется со щелочами в присутствии окислителей. Концентрированная азотная кислота пассивирует молибден.
Мышьяк
Растворяется в смеси азотной и соляной кислот, в концентрированной серной кислоте при нагревании до паров Н2SO4. Нерастворим в соляной и разбавленной серной кислотах.
Никель
Растворяется в разбавленной азотной кислоте. В концентрированной азотной кислоте пассивируется и не растворяется. Плохо растворяется в разбавленных соляной и серной кислотах.
Ниобий
Нерастворим в «царской водке» и концентрированной азотной кислоте. Растворяется в плавиковой кислоте с добавкой азотной кислоты. Концентрированная серная кислота с добавкой (NH4)2SO4 или К2SO4 растворяет ниобий при нагревании до паров Н2SO4. Сплавляется со щелочами, образуя солн-ниобаты.
Олово
Растворяется в соляной кислоте и в смеси соляной и азотной кислот. Растворяется в концентрированной серной кислоте при нагревании. В азотной кислоте образуется нерастворимый осадок метаоловянной кислоты H2SnO3
Платина
Рений
Растворяется в азотной кислоте с образованием раствора рениевой кислоты. Концентрированная серная кислота при нагревании медленно растворяет рений. Соляная и разбавленная серная кислоты очень медленно растворяют его.
Ртуть
Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной.
Свинец
Хорошо растворяется в разбавленной азотной кислоте. Соляная и серная кислоты растворяют свинец лишь при нагревании. Растворяется в уксусной кислоте.
Селен
Растворяется в азотной кислоте с образованием растворимой селенистой кислоты H2SeO3. Растворяется также в «царской водке».
Серебро
Легко растворяется в азотной кислоте; при нагревании растворяется в концентрированной серной кислоте. Нерастворимо в соляной, а также на холоду в серной кислотах.
Сурьма
Растворяется в концентрированной серной кислоте при нагревании до паров Н2SO4, в смеси азотной и соляной кислот, в смеси азотной кислоты с винной.
Таллий
Легко растворяется в азотной кислоте. В серной кислоте растворяется труднее, в соляной — плохо вследствие образования малорастворимого хлорида одновалентного таллия.
Тантал
Нерастворим в «царской водке» и в азотной кислоте. На него не действует плавиковая кислота (в отсутствие платины). Концентрированная серная кислота лишь при нагревании действует на металл. Растворяется в плавиковой кислоте с добавкой азотной. Металл сплавляется со щелочами, образуя танталаты.
Теллур
Растворяется в азотной кислоте с образованием растворимой теллуристой кислоты H2TeO3. Растворим в «царской водке», в концентрированной серной кислоте, в растворах NaOH и KCN.
Титан
Растворяется в разбавленной 1 : 1 соляной и разбавленной 1 : б серной кислотах с образованием солей трех валентного титана фиолетового цвета. Очень легко растворяется в разбавленной плавиковой кислоте и в смеси плавиковой и азотной кислот.
Азотная кислота пассивирует титан вследствие образования нерастворимой метатитановой кислоты. Такой пассивированный титан плохо растворяется в соляной и серной кислотах.
Торий
Легко растворяется в концентрированной соляной кислоте и в смеси соляной и азотной кислот. Одна азотная кислота пассивирует металл.
Растворяется в разбавленных серной и соляной кислотах, а также в хлорной кислоте. Азотная кислота на холоду пассивирует уран (при растворении образуется нитрат уранила UO2(NO3)2 ).
Легко растворяется в соляной и хлоркой кислотах, а также в разбавленной серной кислоте. В азотной кислоте хром с поверхности пассивируется, и дальнейшее растворение его протекает крайне медленно.
Церий
Цирконий
Растворяется в «царской водке» и плавиковой кислоте, а также в смеси плавиковой и азотной кислот. Медленно растворяется в серной и концентрированной соляной кислоте. Устойчив к действию 5%-ной соляпой кислоты даже при нагревапии.
Легко переводится в раствор мокрым сплавлением (на 10 мл концентрированной Н2SO4 добавляют 3 грамма K2SO4).
--> Растворимость металлов в различных жидкостях. Ртуть Хорошо растворяется в азотной кислоте, а также в концентрированной серной при нагревании. Нерастворима в соляной кислоте и в разбавленной серной. | растворимость, металл, химия, кислота
Поведение в жидком состоянии
Для классификации металлов не существует единой системы. Все традиционные виды классификации металлов по группам основаны на практической необходимости, конкретных технических задачах и на специальных, важных для того или иного случая свойствах: по плавкости, например, различают легко-, средне- и тугоплавкие металлы, а по плотности одни металлы (с р до 5 г/см 3 ) относятся к легким, а другие (с р более 5 г/см 3 ) — к тяжелым; по технологическим качествам и назначению выделяют конструкционные металлы, упругие и твердые.
В ювелирном деле металлы в зависимости от степени их окисляемости на воздухе принято разделять на благородные и неблагородные. Последние по внешнему виду делятся на цветные (Сu и ее сплавы) и белого цвета (Sn, Zn, Sb, Bi, Pb и их сплавы). Необходимо, однако, сказать, что такого рода классификация, хотя она и порождена многолетней практикой, не может считаться однозначно последовательной. Теперь, например, известно, что благородные металлы не так стойки к окислению, как утверждалось ранее, а цветные сплавы золота не относятся к цветным металлам, даже когда, к примеру, в сплаве Аи 333 медь доминирует по содержанию; нейзильбер же белого цвета является цветным металлом.
Принято говорить: «украшение из драгоценного металла» и «подлинное или настоящее украшение», что, разумеется, неправильно. Любое высокохудожественное украшение остается всегда таковым, из какого бы металла при этом оно не было сделано.
Сплав представляет собой смесь двух или нескольких металлов или металла с неметаллами. Он образуется посредством совместного плавления различных компонентов, в исключительных случаях — диффузии твердых, жидких или газообразных веществ в металл. Эти смеси также имеют металлические свойства. Варьируя компонентами, их количеством, можно не только изменить свойства металлов, придав им совершенно новые качества, но и снизить их стоимость.
При расплавлении металлов наблюдаются следующие их возможные взаимодействия:
Полная нерастворимость. В этом случае в расплавленном состоянии взаимная растворимость компонентов отсутствует; металлы, в зависимости от их плотности, располагаются друг над другом отчетливо различающимися слоями (и при литье они затвердели бы в кокиле тоже раздельно).
Полная растворимость. В данном случае, независимо от соотношения компонентов, они, растворяясь, образуют однородный расплав, исходные металлы в котором уже неразличимы, что, кстати, и является главным условием
получения пригодного для использования сплава.
Образование сплава из однородного расплава (схема): 1 — однородный твердый раствор; 2 — образование ограниченного твердого раствора; 3 — гетерогенная смесь кристаллов.
Ограниченная растворимость. В расплаве одного металла растворяется только ограниченное количество другого, избыток же выделяется в расплаве в виде слоя нерастворившегося компонента. В качестве примера возьмем систему Ag-Ni, когда в расплаве никеля растворяется до 2% серебра, а в жидком серебре растворяется до 0,4% никеля. Если же доля присадочного металла оказывается выше, то расплав получается состоящим как бы из двух, расположенных друг над другом слоев. К примеру, расплав Ag-Ni, содержащий 50% серебра, состоял бы из слоя никеля с 2% серебра и слоя серебра с 0,4% никеля.
Однородные (гомогенные) твердые растворы. Если исходные металлы имеют одинаковую по строению кристаллическую решетку и приблизительно одинаковые по величине атомы, то их полная растворимость может сохраниться и в твердом состоянии, так как кристаллическую решетку образуют совместно атомы обоих металлов, а компоненты сплава в кристаллите находятся в таком же соотношении, как и во всем сплаве, почему, собственно, микрошлиф сплава Au-Ag или Au-Cu схож с микрошлифом чистого металла.
Гетерогенная смесь кристаллов. Если компоненты по своему строению различны, то в процессе перехода из жидкого состояния в твердое единый расплав распадается и образующиеся при этом кристаллические решетки состоят только из одного вида атомов, а кристаллиты — из одного из исходных компонентов. Такая форма абсолютной нерастворимости встречается на практике очень редко.
Образование твердых растворов с ограниченной растворимостью. В то время как компоненты в жидком состоянии образуют абсолютно однородный расплав, при их затвердевании возникает твердый раствор, в котором преобладает один тип металла, а в кристаллическую решетку этого металла внедряется ограниченное количество атомов другого металла. Такие сплавы встречаются довольно часто и имеют большое значение на практике, так как их свойства особенно сильно отличаются от свойств чистых металлов, например в системе Ag-Cu.
Интерметаллические соединения (металлиды). В их кристаллической решетке содержатся атомы исходных металлов в количественном соотношении, выраженном целыми числами, что на практике отображается записями типа AuCu, Au2Cu3, на первый взгляд напоминающими химические формулы .молекул, в действительности здесь указывается на количественное соотношение компонентов сплава. При целочисленных соотношениях атомы в кристаллической решетке располагаются в упорядоченном виде таким образом, что, например, атомы одного металла занимают углы кубической ячейки, а атомы другого размещаются в ее центре. Кроме расположения атомов в элементарной ячейке, имеет значение и упорядоченность занимаемых ими мест в кристаллической решетке, которая называется сверхструктурой. Могут образовываться очень сложные кристаллические структуры, значительно отличающиеся от кристаллических решеток чистых металлов, и компоненты которых могут находиться в таких количественных соотношениях, как, например, Cu,Znfi и CiL.SrL. Все металлиды— твердые, хрупкие и почти не поддаются обработке давлением.
Химические свойства металлов.
Растворимость. Это - способность вещества растворятся в том или ином растворителе. Металлы растворяются в сильных кислотах и едких щелочах.
В промышленном производстве наиболее часто употребляется серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи - едкий натр и едкое кали.
Растворение может быть частичным, затрагивающим только поверхностные слои, или полным, когда металл полностью переходит в раствор.
Частичное растворение происходит, например, при травлении изделий для получения гладкой поверхности или для нанесения рисунка на изделие, полное - при растворении цинка в соляной кислоте в целях получения флюса для пайки.
Окисляемость. Она характеризует способность металлов соединяться с кислородом и образовывать оксиды.
Интенсивность окисления металлов пропорциональна энтальпии их оксидов (таблица 14). Для сравнения отметим, что энтальпия монооксида углерода СО составляет 111 кДЖ/моль.
Таблица 14. Устойчивость оксидов.
| Оксид | Энтальпия, кДЖ/моль | Оксид | Энтальпия, кДЖ/моль |
| CuO | 157 | MgO | 602 |
| FeO | 265 | TiO | 944 |
| ZnO | 351 | Al2O3 | 1533 |
| SnO2 | 581 | - | - |
В ряде случаев образование прочной оксидной пленки на поверхности изделия желательно, так как пленка предохраняет металл от дальнейшего окисления. При пайке и сварке алюминиевых сплавов пленка препятствует соприкосновению припоя с чистой поверхностью металла.
Коррозионная стойкость. Это - способность металла сопротивляться разрушению, которое вызвано химическим воздействием окружающее среды.
Чисто химическая коррозия определяется главным образом окислением, электрохимическая коррозия возникает из-за физико-химической неоднородности металлов в присутствии жидкости, способной проводить электрический ток.
Электрохимическая активность металлов характеризуется электронным потенциалом, измеренным относительно водорода (таблица 15).
Таблица 15. Электрохимический ряд напряжений.
| Металл | Электрический потенциал | Металл | Электрический потенциал |
| Калий | -2,92 | Олово | -0,14 |
| Магний | -1,55 | Свинец | -0,13 |
| Алюминий | -1,32 | Водород | 0 |
| Цинк | -0,76 | Медь | +0,34 |
| Хром | -0,51 | Серебро | +0,81 |
| Железо | -0,44 | Ртуть | +0,86 |
| Никель | -0,25 | Золото | +1,50 |
Каждые два металла образуют гальваническую пару. При этом электродвижущая сила будет тем больше, чем дальше друг от друга они стоят в эклектическом ряду.
Взаимодействие металлов с газами. Количество отливки во многом зависит от взаимодействия металлов (особенно их жидких расплавов) с газами. Это взаимодействие представляет собой комплекс сложных физико-химических процессов, направленных в строну равновесия.
В реальных условиях полное равновесие между газообразной и жидкой фазами достигается крайне редко. Поэтому термодинамические расчеты, относящиеся к состоянию равновесия, как правило, показывают лишь направление взаимодействия.
Возможны три случая взаимодействия газов с расплавами.
1. Полная взаимная интенсивность. Она наблюдается, например, при плавлении любых металлов в среде интерных газов (аргона, гелия идр.)
2. Газ практически нерастворим в металле. Образующиеся химические соединения в виде жидких капель, плен или кристаллов, проникая в металл, загрязняют его.
3. Газы образуют с металлом растворы. Как известно, растворимость в металле двухатомного газа [Г]ме зависит от давления газа рr и от температуры Т:
[Г]ме = к√рr exp [ - ΔQ/ (RT)].
где, k - постоянный коэффициент, R - газовая постоянная, ΔQ - теплота растворения 1 модуля газа в расплаве. Значение ΔQ может быть положительным и отрицательным.
При ΔQ > 0 процесс растворения газа сопряжен с поглощением теплоты и является эндоремическим. В этом случае повышение температуры вызывает увеличение содержания газа в металле.
При ΔQ МеО + 2 [Н];
СаНm > nC + m [H].
Растворение водорода в металлах ряда Mq - Fe (см. таблицу 16) сопровождается поглощением теплоты. Снижение температуры вызывает уменьшение содержания газа в растворе. В этих металлах возможно образование газовой пористости, если расплав содержит большое количество водорода. Растворение водорода в титане является экзотермическим процессом, растворимость расет с понижением температуры и образование водородной пористости невозможно.
Взаимодействие с кислородом. Все жидкие металлы взаимодействуют с кислородом.
Легкоплавкие металлы - от олова до алюминия (см. таблицу 16) - практически не растворяют кислород. Взаимодействие этих металлов с кислородом сводится к образованию оксидных плен на поверхности металла.
Остальные металлы способны растворять кислород в определенных количествах, после чего начинается образование оксидов.
Взаимодействие с азотом. Растворение азота в марганце, никеле и железе является эндотермическим процессом, вследствие чего эти металлы подвержены образованию газовой пористости, вызванной выделением азота из расплавов.
В титане азот растворяется с выделением теплоты, что исключает образование газовой пористости.
Растворение азота в жидких сплавах металлов в общем случае пропорционально содержанию компонентов. Исключение составляют сплавы железа и никеля с добавками алюминия и титана. В этих сплавах образуются твердые нитриды титана и алюминия в виде включений.
Для металлов от олова до меди (см. таблицу 16) азот практически является инертным газом.
Взаимодействие с водой. Большая часть металлов в жидком состоянии располагает воду. Результаты взаимодействия расплава с водой зависят от характера его взаимодействия с водородом и кислородом.
Если расплав не растворяет ни водород, ни кислород, то в результате контакта с влагой расплав покроется пленой оксидов, а водород уйдет в атмосферу. Так ведут себя олово , цинк, свинец и все сплавы на их основе.
Если же расплав не растворяет кислород, но растворяет водород происходит окисление поверхности расплава и насыщение его растворенным водородом.
Если расплав способен растворять и кислород, и водород, то именно это и будет происходить. Конечное равновесие в системе определяется парциальным давлением паров воды и концентрациями кислорода и водорода в расплаве.
Взаимодействие металлов с оксидом углерода. Взаимодействие металлов с оксидом углерода определяется возможностью прохождения реакции:
Ме + СО >МеО + С;
Ме + СО > [Ме + О] + С;
Ме + СО > [Ме + С + О].
Свинец, олово и медь с оксидом углерода практически не взаимодействуют, для этих металлов его модно рассматривать как нейтральный газ.
Для цинка, магния, алюминия СО является окислительным газом, взаимодействие с ним приводит к образованию нерастворимых оксидов на поверхности расплава.
Для остальных металлов, представленных в таблице 16. понижение температуры равновесие между содержанием кислорода и углерода в расплаве сдвигается в влево, т.е. в строну образований СО. Следовательно, расплавы, содержащие растворенные углерод и кислород, при охлаждении и кристаллизации могут поражаться газовой пористостью, образованной оксидом углерода. Подобное, например, происходит в литейных углеродистых сталях в случае недостаточного раскисления.
Взаимодействие металлических расплавов с огнеупорными материалами. Огнеупорные материалы, которыми футеруют плавильные печи и из которых изготавливают плавильные тигли, должны быть при высоких температурах механически прочными и химически стойкими, чтобы не вступать во взаимодействие с металлическим расплавом, оксидами, шлаками, флюсами.
Наиболее часто применяют шамот (60-75 % SiО2 , остальное - Al2O3), динас (более 95 % SiO2, остальные - примеси), магнезит (80 % MqO), хромомагнезит (45-50 % МqО, 30-35 % Cr2O3, остальное - SiO2), циркон (65 % ZrO2,, 35 % SiO2), высокоглиноземистые огнеупоры (более 50 % Al2O3, остальное - SiO2). Самым дешевым и доступным огнеупорным материалом является шамот.
Основной характеристикой этих материалов является огнеупорность - температура, o С, при которой материал способен выдержать напряжение сжатие 0,2 МПа (таблице 17). (Огнеупорность формовочных смесей оценивается температурой, при которой происходит деформация специальных образцов - конусов.
Таблица 17. Огнеупорность материалов.
| Материал | Огнеупорность, o С |
| Циркон | 1700 |
| Динас | 1600 |
| Магнезит | 1550 |
| Хромомагнезит | 1500 |
| Высокоглиноземистые материалы | 1500 |
| Шамот | 1300 |
Химическая стойкость огнеупоров определяется возможностью происхождения реакции между жидким металлом и огнеупорным оксидом
Ме + RO > MeO + [R]С Me;
Ме + RO > [Me + O + R].
где, R - металл, входящий в состав оксида.
В результате этих реакций разрушается футеровка, расплав загрязняется оксидами и примесью R или кислородом и примесью R.
Кроме того, возможно взаимодействие оксидов огнеупора и оксидов металла, выражающееся во взаимном растворении. Оценить такое взаимодействие можно по виду диаграммы состояния МеО - RO. Если в системе МеО - RO.имеются эвтектики с температурой плавления ниже температуры расплава, то при плавке на воздухе обязательно будет происходить активное разъедание футеровки.
Легкоплавкие металлы - олово, свинец, цинк - имеют столь низкие температуры огнеупорных материалов. Однако при плавке свинца и его сплавов в шамоте перегревы до 750 o С приводит к оплавлению футеровки вследствие того, что в системе PbO - SiO имеется эвтектика с температурой плавления 715 o С.
Поскольку магний при температурах расплава около 850 o С активно восстанавливает кремний из шамота, магниевые сплавы плавят в печах с магнезитовой футеровкой или в стальных тиглях.
При плавке алюминия также происходит восстановление кремния из кремнезема шамота. Поскольку шамот - наиболее дешевый материал, его используют для приготовления алюминиевых сплавов, если примесь кремния допустима в определенных пределах.
Медь и многие медные сплавы плавят в шамотной футеровки. Сплавы меди с цирконием, хромом и титаном получают в печах с магнезитовой футеровкой.
Для сплавов на основе никеля и железа шамот непригоден из-за недостаточной огнеупорности. Эти сплавы изготавливают в динасе, магнезите, хромомагнезите и цирконии.
Иногда металл плавят в графитовых тиглях, но чистый графит пригоден лишь для сплавов, не растворяющих углерод. Кроме того, его применение требует защитной атмосферы, поскольку при температурах, превышающих 600 o С, графит на воздухе быстро сгорает. Как добавка в оксидные огнеупоры графит повышает стойкость материала. Широко известен графитошамот (40-50 % графита), из которого делают плавильные тигли.
Расплавы, рабочие температуры которых не превышают 900 o С, можно получать в стальных и чугунных тиглях. Главная опасность при этом - возможность насыщения расплава железом. Ее оценивают по диаграмме состояния "железо - расплавленных металл".
Основы теории сплавов
Чистые металлы характеризуются низким пределом прочности, поэтому в машиностроении применяют главным образом их сплавы. Металлическим сплавом называют сложное вещество, полученное сплавлением (или спеканием) нескольких металлов или металлов с неметаллами. При этом улучшаются эксплуатационные и технологические свойства металлического материала.
Компонентами называют вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов — двухкомпонентную систему и т.д. Фазой называют однородную часть системы, имеющую одинаковый состав, одно и то же агрегатное состояние и отделенную от остальных частей системы поверхность раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно. Совокупность фаз, находящихся в равновесии при определенных внешних условиях (давлении, температуре), называют системой.
Сплав называют однородным (гомогенным), если его структура однофазна, и разнородным (гетерогенным), если его структура состоит из нескольких фаз.
Под структурой сплава понимают видимое в микроскоп взаимное расположение фаз, их форму и размеры. Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов. Твердые растворы бывают следующих типов: твердые растворы замещения и твердые растворы внедрения. Независимо от типа твердые растворы однофазны.
Химические соединения образуются при сплавлении различных металлов или металла с неметаллом. Химическое соединение — однородное кристаллическое тело, имеющее кристаллическую решетку с упорядоченным расположением атомов, которая отлична от решеток элементов, образующих это соединение.
Механическая смесь двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава неспособны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В.
Температуры, при которых изменяется строение металлов и сплавов, называют критическими точками. При плавлении и затвердевании чистые металлы имеют одну критическую точку, а сплавы — две. В интервале между этими двумя точками в сплавах существуют две фазы — жидкий сплав и кристаллы.
2. Диаграмма состояний для случая неограниченной растворимости компонентов в твердом состоянии
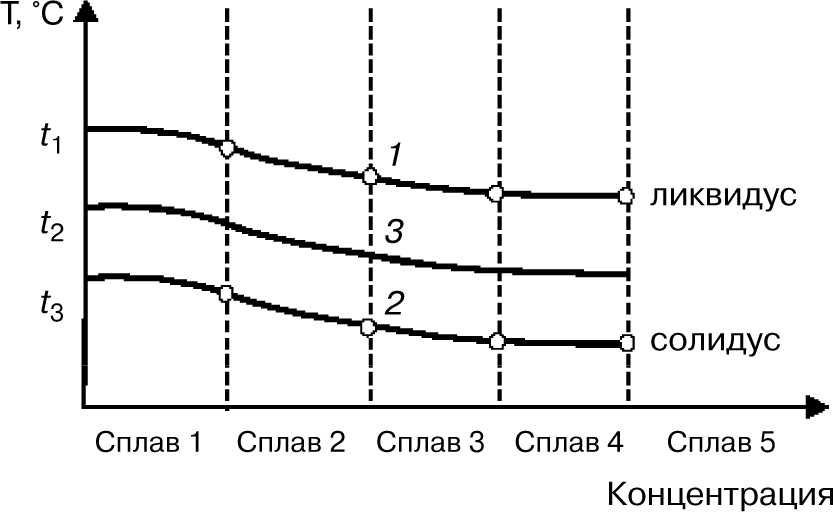
Диаграмма состояния — графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Рассмотрим диаграмму состояния сплавов системы «медь — никель», которая является диаграммой для случая неограниченной растворимости компонентов в твердом состоянии (рис. 3).
Температура плавления меди 1083°С, никеля — 1445°С. Чистые металлы имеют одну критическую точку — температуру затвердевания (кристаллизации), а сплавы — две, т.е. сплавы, в отличие от чистых металлов, кристаллизуются в интервале температур. Например, кристаллизация сплава начинается при температуре t1, при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого раствора, а заканчивается кристаллизация при температуре t3. При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется.
Для построения диаграммы состояния рассматриваемой системы на оси абсцисс сетки в координатах температура — концентрация откладывают составы пяти сплавов и восстанавливают из каждой точки вертикальные линии. После этого переносят на эти вертикальные линии с кривых охлаждения сплавов критические точки, а на левой и правой ординатах температур отмечают температуры кристаллизации чистых металлов — меди (100%) и никеля (100%). Соединив плавными кривыми температуры начала и конца кристаллизации всех сплавов, получают диаграмму состояния сплавов системы «медь — никель» с неограниченной растворимостью компонентов в твердом состоянии.
Верхняя линия на диаграмме обозначает начало затвердевания при охлаждении или конец расплавления при нагреве, нижняя — соответственно конец затвердевания или начало плавления. Эта диаграмма состояния сплава меди и никеля имеет три области. Область существования жидкого расплава
(1) лежит выше верхней линии, соединяющей точки плавления меди и никеля, а область существования кристаллических твердых растворов (2) — ниже нижней линии. Между этими линиями находится двухфазная область (3), в которой одновременно существуют расплав и кристаллы твердого раствора. Верхнюю границу этой области называют линией ликвидус, а нижнюю — линией солидус («ликвидус» в переводе с латинского означает жидкий, «солидус» — твердый). По диаграмме состояния можно определить концентрации твердой и жидкой фаз в сплаве при его кристаллизации.
3. Диаграмма состояний сплавов, образующих механические смеси из чистых компонентов
Диаграммы состояния — показатели фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т.е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко.
Рассмотрим диаграмму состояний одного из сплавов, образующих механические смеси из чистых компонентов, системы «висмут — кадмий» (рис. 4).
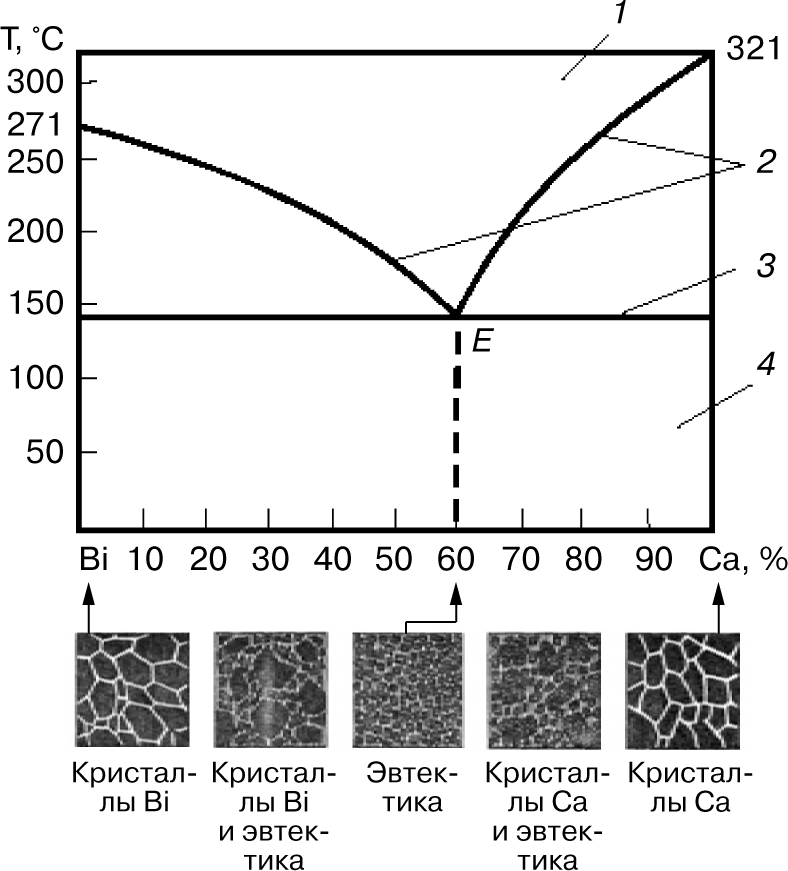
Область существования жидкого расплава ограничена сверху ломаной линией, соединяющей точки плавления висмута и кадмия через точку Е. В точке Е сплав (40% висмута и 60% кадмия) имеет одинаковые температуры ликвидуса и солидуса. Все остальные сплавы системы затвердевают и плавятся в пределах температурного интервала, который снизу ограничен горизонтальной линией солидуса. Сплав в точке Е имеет очень мелкие кристаллы висмута и кадмия, находящиеся в определенном взаимном расположении. Этот сплав называется эвтектикой, что в переводе с греческого означает легко плавящийся. Эвтектика — это механическая смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкого сплава. Твердые сплавы, лежащие левее эвтектической точки Е, и сплавы, содержащие до 40% висмута, называют доэвтектическими, а лежащие правее точки Е и содержащие более 40% висмута — заэвтектическими. Доэвтектические сплавы состоят из смеси кристаллов висмута и эвтектики (кристаллы висмута + кристаллы кадмия), а заэвтектические — из смеси кристаллов кадмия с эвтектикой.
По этому типу диаграммы состояния кристаллизуются также сплавы систем Zn—Sn, Pb—Ag, Ni—Cr, Cr—Mn, Cu—Bi, Al—Si.
4. Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии
Эта диаграмма состояний содержит три фазы — жидкий раствор, твердый раствор компонента В в компоненте А () и твердый раствор компонента А в компоненте В (α). Линия диаграммы KCD — линия ликвидуса, линия KECFD — линия солидуса (рис. 5). Кристаллы α выделяются из жидкого сплава (ж. с.) по линии ликвидуса КС, а кристаллы β — по линии CD. Затвердевание сплавов происходит по линии солидуса КЕ с образованием кристаллов α и по линии DF — с образованием кристаллов β. Одновременная кристаллизация α- и β-фаз с образованием механической смеси кристаллов этих фаз происходит на линии солидуса ECF.
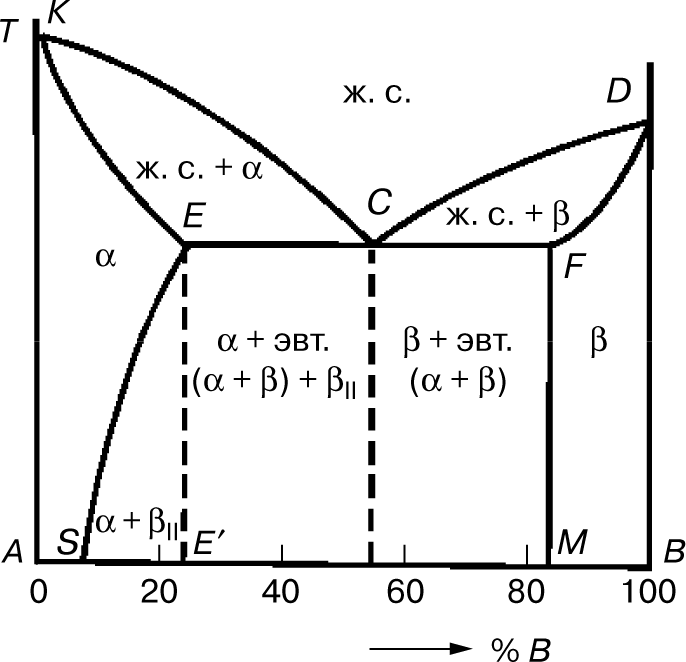
Сплав состава точки С после затвердевания называется эвтектическим, поскольку он состоит только из одной эвтектики α + β. Составы сплавов, лежащих левее эвтектической точки С на линии ЕС после затвердевания, называются доэвтектическими сплавами и имеют структуру α + эвтектика (α + β). Составы сплавов, лежащих правее точки С на линии CF после затвердевания, называются заэвтектическими сплавами и имеют структуру β + эвтектика (α + β).
Предельная растворимость компонента В в А характеризуется точкой Е, а А в В — точкой F. При кристаллизации сплавов, состав которых находится левее точки S (или правее точки М), при любой температуре в твердом состоянии все количество компонента В (или А) находится в твердом растворе, и структура таких сплавов состоит из зерен α (или β).
В сплавах, состав которых находится между точками S и Е′, образовавшихся при затвердевании, кристаллы α при понижении температуры ниже линии ES пересыщены компонентом В, и поэтому из них происходит выделение избыточных кристаллов. Это кристаллы β концентрации точки М, называемые вторичными (βII). Такие сплавы после полного охлаждения имеют структуру, состоящую из кристаллов α состава точки S и кристаллов βII, т.е. α + βII.
В сплавах состава линии ЕС, имеющих после затвердевания структуру α + эвтектика (α + β), из кристаллов α выделяются кристаллы β, и после полного охлаждения структура будет α + эвтектика (α + β) + βII.
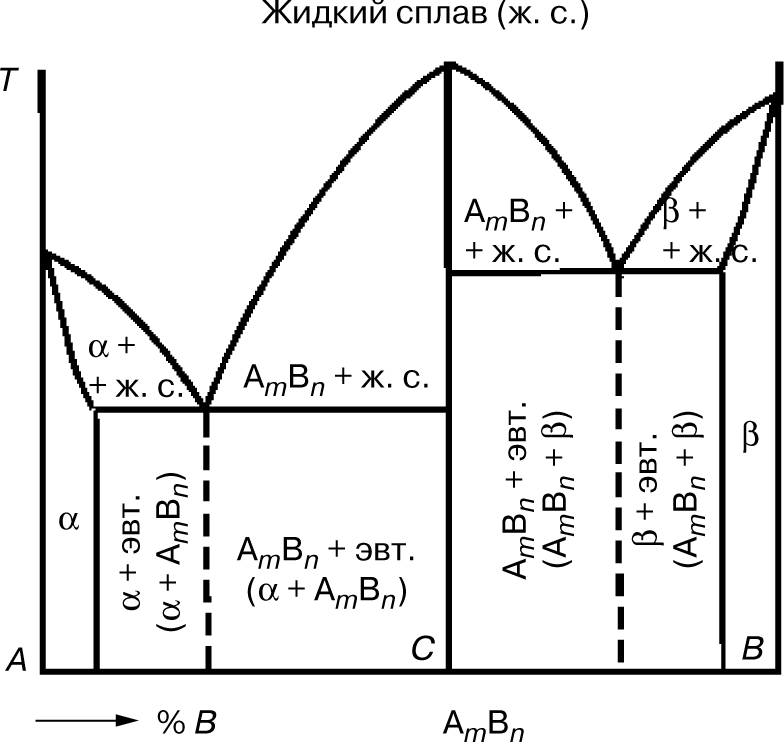
5. Диаграмма состояния сплавов, образующих химические соединения
Сплавы, представляющие собой химическое соединение компонентов А и В, имеют сложную диаграмму состояния. Химическое соединение обозначают АmВn, т.е. в соединении на m атомов компонента А приходится n атомов компонента В. Химические соединения представляют собой сложное соединение с одной точкой плавления, в отличие от сплавов, у которых таких точек две.
В данной системе различают три фазы:
- жидкий раствор;
- твердый раствор компонента В в компоненте А (фаза α) (рис. 6);
- твердый раствор компонента А в компоненте В (фаза β).
Эта диаграмма как бы составлена из диаграмм для двух систем:
- компонент А — химическое соединение АmВn;
- компонент В — химическое соединение АmВn.
В сплавах левее точки С компонента А больше, чем входит
в химическое соединение АmВn. В этих сплавах левее точки промежуточного состояния образуется эвтектика α + АmВn. В сплавах правее точки С компонента В больше, чем может
входить в химическое соединение АmВn. В этих сплавах образуется эвтектика АmВn+ β.
Между составом и структурой сплава, определяемой типом, диаграммой состояния и свойствами сплава, существует определенная зависимость (правило Н.С. Курнакова). В механических смесях свойства (твердость Н, электропроводность Е, вязкость, хрупкость и др.) изменяются линейно. В твердых растворах свойства изменяются по криволинейной зависимости. В химических соединениях свойства выражаются ломаными линиями.
При концентрации, соответствующей химическому соединению, отмечается характерный перелом на кривой свойств, так как химические соединения обладают индивидуальными свойствами, отличающимися от свойств компонентов. По диаграммам можно определять и технологические свойства сплавов, что облегчает выбор материала для изготовления изделий.
6. Структурные составляющие железоуглеродистых сплавов
Основными компонентами, от которых зависят структура и свойства железоуглеродистых сплавов, являются железо и углерод. Чистое железо — металл серебристо-белого цвета; температура плавления 1539°С. Железо имеет две полиморфные модификации: α и γ. Модификация α существует при температурах ниже 91°С и выше 1392°С; γ-железо — при температуре 911…1392°С. В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие структурные составляющие:
- Феррит (Ф) — твердый раствор внедрения углерода в α-железе. Растворимость углерода в α-железе при комнатной температуре до 0,005%; наибольшая растворимость — 0,02% при 727°С. Феррит имеет незначительную твердость (НВ = 80…100) и прочность (σв = 250 МПа), но высокую пластичность (δ = 50%; Ψ = 80%), где σв — предел прочности; δ — относительное удлинение; Ψ — относительное сужение.
- Аустенит (А) — твердый раствор внедрения углерода в γ-железе. В железоуглеродистых сплавах он может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе — 2,14% при температуре 1147°С и 0,8% — при 727°С. Аустенит имеет твердость НВ = 160…200 и весьма пластичен (δ = 40…50%).
- Цементит (Ц) — химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6,67% углерода. Температура плавления цементита около 1600°С. Он очень тверд (НВ » 800), хрупок и практически не обладает пластичностью.
- Графит — это свободный углерод, мягкий (НВ = 3) и обладает низкой прочностью. В чугунах и графитизированной стали содержится в виде включений различных форм (пластинчатой, шаровидной и др.). С изменением формы графитовых включений меняются механические и технологические свойства сплава.
- Перлит (П) — механическая смесь феррита и цементита, содержащая 0,8% углерода. Перлит может быть пластинчатым и зернистым (глобулярным), что зависит от формы цементита и определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет предел прочности σв ≈ 800 МПа; относительное удлинение δ =15%; твердость НВ = 160.
- Ледебурит (Л) — механическая смесь аустенита и цементита, содержащая 4,3% углерода. Ледебурит образуется при затвердевании жидкого расплава при 1147°С. Ледебурит имеет твердость НВ = 600…700 и большую хрупкость.
Помимо перечисленных структурных составляющих, в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды — соединения с кислородом, азотом, серой и фосфором.
7. Диаграмма состояния «железо — цементит»
Диаграмма (рис. 7) показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67%). Сплавы с содержанием углерода 2,14% называют сталью, а от 2,14 до 6,67% — чугуном.
Первичная кристаллизация, т.е. затвердевание жидкого сплава, начинается при температурах, соответствующих линии ликвидуса. Точка А на этой диаграмме соответствует температуре плавления 1539°С (затвердевания) железа, точка D — температура плавления (затвердения) ~ 1600°С цементита.
Линия солидуса AEСF соответствует температурам конца затвердевания. При температурах, соответствующих линии АС, из жидкого сплава кристаллизуется аустенит, а линии CD — цементит, называемый первичным цементитом.
В точке С при 1147°С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуются аустенит (А) и цементит (Ц) (первичный), образуя эвтектику — ледебурит (Л).
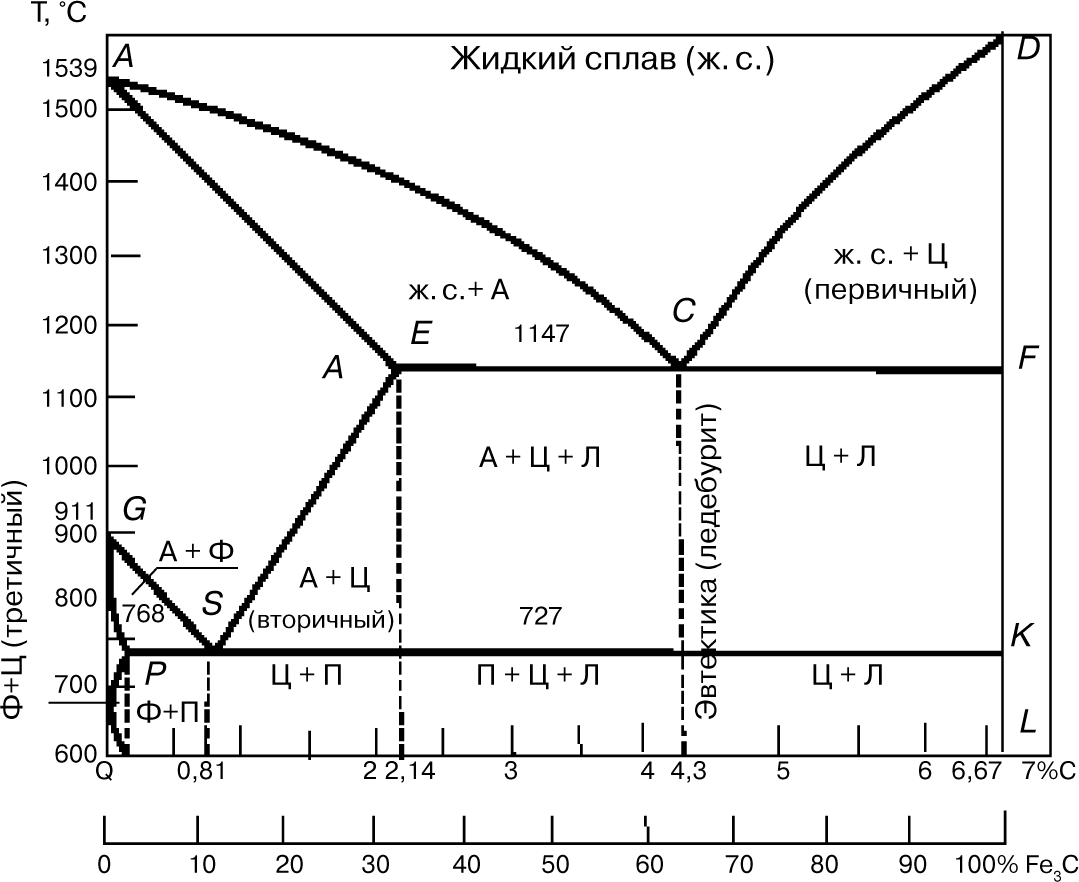
При температурах, соответствующих линии солидуса АЕ, сплавы с содержанием углерода до 2,14% окончательно затвердевают с образованием аустенита. На линии солидуса ECF сплавы с содержанием углерода от 2,14 до 6,67% окончательно затвердевают с образованием эвтектики (ледебурита) и структур, образовавшихся ранее из жидкого сплава, а именно: в интервале 2,14…4,3%, С — аустенита, а в интервале 4,3…6,67% С — цементита первичного.
В результате первичной кристаллизации во всех сплавах с содержанием углерода до 2,14% (т.е. в сталях) образуется однофазная структура — аустенит. В сплавах с содержанием углерода более 2,14% (т.е. в чугунах) при первичной кристаллизации образуется эвтектика ледебурита.
Вторичная кристаллизация (превращение в твердом состоянии) происходит при температурах, соответствующих линиям GSE, PSK и GPQ. Превращения в твердом состоянии происходят вследствие перехода железа из одной аллотропической модификации в другую ( в ) и в связи с изменением растворимости углерода в аустените и феррите. С понижением температуры растворимость уменьшается. Избыток углерода выделяется из твердых растворов в виде цементита. В области диаграммы AGSE находится аустенит.
8. Диаграмма состояния «железо — графит»
Систему «железо — цементит» называют метастабильной, т.е. неустойчивой, так как при определенных условиях цементит распадается на аустенит и свободный углерод в виде графита. При очень медленном охлаждении из расплава в процессе кристаллизации углерод выделяется в виде графита. Систему «железо — графит» называют стабильной.
Процесс кристаллизации графита в сплавах железа с углеродом называют графитизацией. Она может происходить и в твердом состоянии, поскольку цементит при высоких температурах неустойчив. В этом случае графитизация происходит в несколько накладывающихся стадий:
- распад цементита и растворение атомов углерода в аустените;
- образование центров графитизации в аустените;
- диффузия атомов углерода в аустените к центрам графитизации;
- рост выделений графита.
На рис. 8 показана совмещенная диаграмма: сплошными линиями изображена метастабильная диаграмма «железо — цементит», штриховыми линиями — стабильная диаграмма. По диаграмме «железо — цементит» в области чугунов получают белые чугуны, а по диаграмме «железо — графит» — серые чугуны.
На диаграмме «железо — графит» горизонтальные линии E′C′F ′ и P ′S′K′ лежат несколько выше, а наклонные линии C′D′ и E′S′ — несколько левее соответствующих линий диаграммы «железо — цементит». На диаграмме «железо — графит» линия AC′D′ — линия ликвидуса. При охлаждении расплава по ветви АС выделяется аустенит, а по ветви C′D′ — графит (первичный).
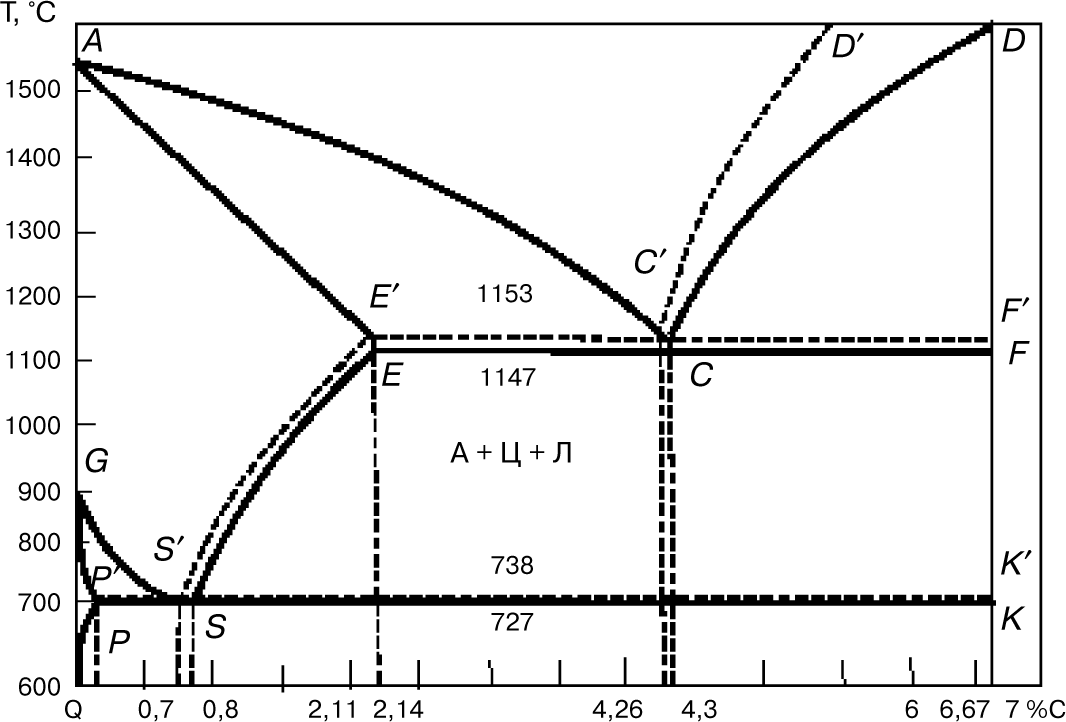
На линии солидуса E′C′F′ при температуре 1153°С образуется эвтектика, состоящая из графита и аустенита. Ее называют графитной эвтектикой. При понижении температуры в системе «железо — графит» из аустенита будет выделяться графит, который называют вторичным. На линии P′S′K′ при температуре 738°С аустенит, содержащий 0,7% углерода (точка S′), распадается, образуя эвтектоид, состоящий из феррита и графита. Этот эвтектоид называют графитным. После полного охлаждения структура состоит из феррита и графита (эвтектического, вторичного и эвтектоидного).
Читайте также:
