Растворимость водорода в металлах таблица
Обновлено: 30.04.2024
Впервые установлена четкая закономерная связь между растворимостью водорода в переходных металлах первого большого периода и степень заполнения электронами 3d и 4s-подуровней, показано, что увеличение количества 3d-электронов от 2-х до 7-и или снижение числа электронов на 4sподуровне от 2-х до 1-го сопровождается уменьшением растворимости водорода. Установлена линейная зависимость между lg(C) и отношением зарядов электронов 4s/3d для всех исследованных элементов (Ti, V, Cr, Mn, Fe, Co, Ni, Cu).
Похожие темы научных работ по физике , автор научной работы — Ткаченко Константин Игоревич
Модельные квантовохимические расчеты электронного строения и спектра одноэлектронных состояний алициклических нанотубуленов, модифицированных функциональными группами с атомами переходных металлов
The close bonding between hydrogen solubility and 3d (4s) electrons quantity was found for the first time in transition metals (Ti, V, Cr, Mn, Fe, Co, Ni, Cu). It was determined that increasing of 3d-electrons or 4selectrons quantity decreasing results in decreasing of hydrogen solubility. The linear dependence between 4s/3d ratio and hydrogen solubility logarithm was obtained.
Текст научной работы на тему «Зависимость растворимости водорода в металлах первого, большого периода от электронной конфигурации внешних подуровней»
В1СНИК ПРИАЗОВСЬКОГО ДЕРЖАВНОГО ТЕХН1ЧНОГО УН1ВЕРСИТЕТУ
Вип.№16 Ткаченко К.И.*
ЗАВИСИМОСТЬ РАСТВОРИМОСТИ ВОДОРОДА В МЕТАЛЛАХ ПЕРВОГО БОЛЬШОГО ПЕРИОДА ОТ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ
Впервые установлена четкая корреляционная связь между растворимостью водорода в переходных металлах первого большого периода и степенью заполнения электронами 3с1 и 4$-подуровней. Показано, что увеличение количества Зё-электронов от 2-х до 7-и или снижение числа электронов на 4$-подуровне от 2-х до 1-го сопровождается уменьшением растворимости водорода. Установлена линейная зависимость между ^(С) и отношением зарядов электронов 4з/3с1 для всех исследованных элементов (П, V, Сг, Мп, Ре, Со, №, Си).
В связи с расширением использования водорода в качестве высокоэффективного топлива, возрастает необходимость разработки новых сплавов, обладающих водородонепроницаемо-стью и стойкостью к развитию в них негативных процессов, снижающих их служебные характеристики.
Известно 1, что водород имеет простейшее атомное строение. Он состоит из одного протона и одного электрона, и характеризуется малыми геометрическими размерами. Кова-лентный радиус атома водорода составляет г11 = 0.030 нм . В ионизированном состоянии, находясь в виде протона, водород приобретает размер гн+ ~ 10 " нм, принимая электрон, атом водорода становится анионом - г" = 0.21 нм . Благодаря малому размеру, водород растворяется в металлах по типу внедрения, занимая в решетке растворителя октаэдрические или тетраэдриче-ские междоузлия. Согласно [4], тип междоузлия, занимаемого атомом водорода в решетке металла, зависит не только от размера междоузлия, но и от уровня потенциальной энергии, который определяется характером взаимодействия атома водорода с окружающими его атомами металла. Совершенно очевидно, что такое взаимодействие внедренного атома водорода с окружающими атомами металла неизбежно должно включать перераспределение электронов валентных уровней. Детальный обзор работ по этим вопросам дан авторами [11, 12]. Исходя из вышесказанного, учитывая то, что растворимость водорода в металлах определяется его энергетическим состоянием, в настоящей работе выполнен анализ связи уровня растворимости водорода в металлах первого большого периода с электронной конфигурацией валентных уровней элементов: Т1, V, Сг, Мп, Бе, Со, N1 и Си. Исходными данными для анализа служили: физико-химические характеристики указанных элементов, взятые из работ 3; данные о распределении электронов на 3с1 и 4з-подуровнях, а также обобщенные результаты определения растворимости водорода в указанных металлах, представленные в работе [5]. Численные значения необходимых для расчета параметров приведены в табл. 1.
Задача исследования заключалась в установлении закономерных связей между уровнем растворимости водорода и числом электронов на внешних 3с1 и 4з-подуровнях и расширении на этой основе представлений о характере взаимодействия и состояния водорода, растворенного в металлах указанной выше группы. На рис. 1а представлены результаты, отражающие связь между величиной логарифма растворимости водорода в исследуемых металлах при 800 К и парциальном давлении водорода 100 КПа от числа электронов на Зс1-подуровне. Из рисунка видно, что в металлах: Т1, V, Мп, Бе, Со и N1, имеющих заполненную 4з-орбиталь, растворимость водорода с увеличением числа Зс1-электронов от двух до восьми, с высокой степенью достоверности, Я2 = 0.9956 , аппроксимируется уравнением вида:
log (Ся ) = 0.0432х3 - 0.4593x2 + 0.332x + 5 , где x— число Зс1-электронов.
Таблица 1 - Физико-химические характеристики переходных металлов первого большого периода^_
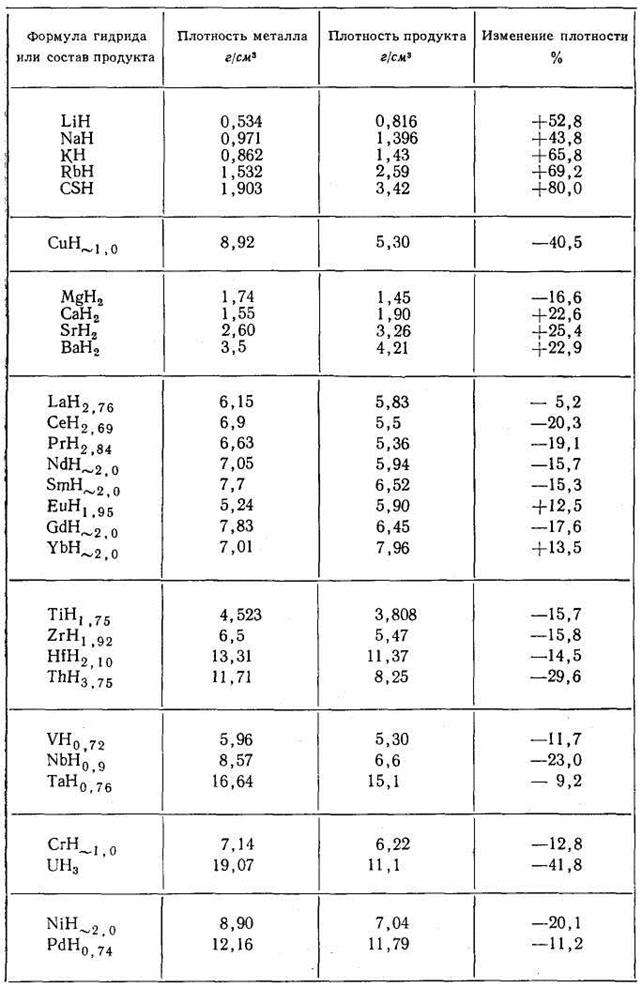
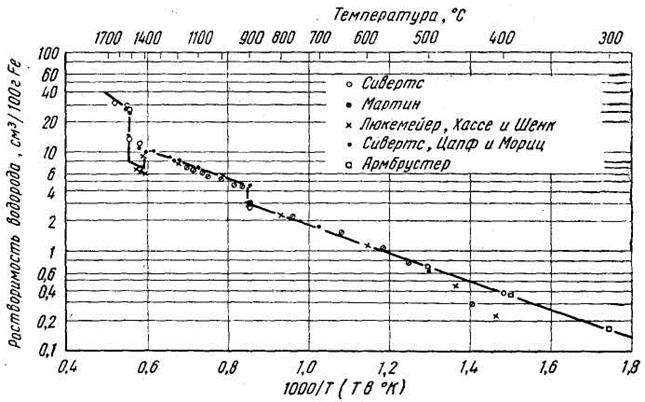
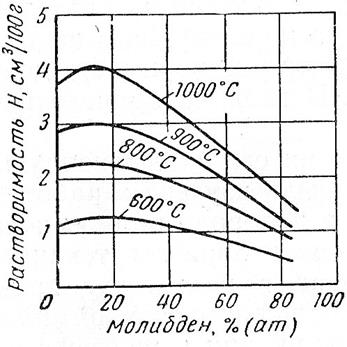
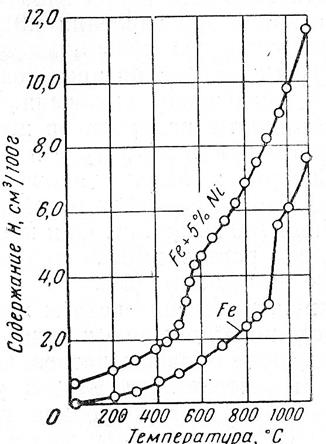
£ ч W Ат.№ тЗ СП сл 4s/3d 3d+4s 1 | сл + 43 СП £ | © СП (4S)/AT.№ 1 Ti 22 2 2 1.000 4 0.182 0.091 0.091 1.32 6.830 4.233 17100 2 V 23 3 2 0.667 5 0.217 0.130 0.087 1.45 6.740 2.886 769.1 3 Сг 24 5 1 0.200 6 0.250 0.208 0.042 1.56 6.764 -0.739 0.182 4 Мп 25 5 2 0.400 7 0.280 0.200 0.080 1.60 6.432 0.773 5.929 5 Fe 26 6 2 0.333 8 0.308 0.231 0.077 1.64 7.900 -0.318 0.481 6 Со 27 7 2 0.286 9 0.333 0.259 0.074 1.70 7.860 -0.443 0.361 7 Ni 28 8 2 0.250 10 0.357 0.286 0.071 1.75 7.633 0.398 2.500 8 Си 29 10 1 0.100 11 0.379 0.345 0.034 1.75 7.724 -1.112 0.077 Согласно приведенной кривой, при переходе от Ti к Fe и соответствующем увеличении числа Зс1-электронов от 2-х до 6-и, растворимость водорода снижается более, чем на три порядка. Для железа и кобальта она остается практически на одном уровне, а при переходе к никелю (3d7) растворимость водорода снова увеличивается примерно на порядок. Обращает на себя внимание существенное отклонение Сг и Си от указанной закономерности. При двухкратном увеличении числа 3d-3neKTp0H0B (от 3d5 у хрома до 3d10 у меди) растворимость снижается примерно в такой же степени. Аналогичный характер зависимости растворимости для всей группы рассматриваемых элементов наблюдается при изменении относительного заряда электронов 3 d-подуровня, выраженного через отношение 3d / N ат. рис. 16. Это, очевидно, свидетельствует о слабом влиянии экранированного подвалентными электронами ядра на изменение состояния 3d-3neKTp0H0B при растворении водорода в исследуемых металлах. Анализ зависимости растворимости от суммарного числа (3d+4s)-3.iCKTp0H0B. как видно из рис. 16 и в, дает совершенно аналогичный результат. Полученные зависимости логарифма растворимости водорода log (Сн ) от числа (3d+4s)-3.iCKTp0H0B с высоким уровнем достоверности (It ~ 0.996) описываются полиномом третьей степени log (Ся ) = 0.0432xf -0.7182х2 +2.687^ +12.36 где Xj - число (3d+4s)-3.iCKTp0H0B. И в этом случае влияние заряда ядра атомов всех элементов не оказывает заметного влияния на характер зависимости растворимости водорода от концентрации внешних электронов. В связи с этим, обратим внимание на следующее обстоятельство: из сравнения рис. 1а и 1в видим, что при одинаковом числе электронов 3d5 у Мп и Сг и меньшем на единицу числе электронов на 4s-подуровне у Сг, растворимость в нем примерно в 30 раз меньше, чем в марганце. Если допустить, что реально существующая электронная конфигурация атома хрома 3d 4s1 сформировалась за счет перемещения одного из 4з2-электронов в направлении 4s —> 3d, то, очевидно, обратный переход одного из 3d-3neKTp0H0B на 4з-орбиталь, приведет к образованию конфигурации 3d44s2, соответствующей гипотетическому элементу Сг , растворимость водорода в котором должна определяться точкой Сг , приведенной на рис. 1а и в. Как видно, растворимость предположительно должна возрасти более чем в 100 раз. Высказанное предположение о существенном влиянии 4s-3.iCKTp0H0B на растворимость водорода в переходных металлах первого большого периода, подтверждается данными, приведенными на рис. 1д и е. По оси абсцисс на у = 0.0432Х 0.7182* 2 + 2.687Х + 2.1535 |!2 = 0.9956 0.250 0.300 3(н45/№т 0.020 0.040 0080 0-100 0 02 °'4 08 1 12 Рис. 1 - Зависимость логарифма растворимости водорода при Т = 800 К и рн. =100 КПав переходных металлах первого большого периода от их атомных характеристик: Из проведенного анализа следует, что для группы элементов: V, Сг, Мп, Бе и Со проявляется явна тенденция снижения растворимости водорода при увеличении числа Зс1-электронов. Эта тенденция ослабляется по мере заполнения Зс1-подуровня электронами. Из сравнения данных, приведенных на рис. 2, следует, что для водорода параметры 3 и%, имеют максимальные значения: 13.595 эВи 2.1, соответственно, в то время как для эле- ментов-растворителей они существенно ниже. Обратим внимание на то, что минимальное значение % = 1,45 , при максимальной разнице А% = 0.65, характерно для ванадия, обладающего растворимостью водорода наибольшей из приведенных на рис. 2 элементов. У марганца, железа и кобальта величина % непрерывно возрастает, принимая, соответственно, значения: 1.60, 1.64 и 1.70. Разность А% = %н — Хме ПРИ этом снижается до 0.4, что указывает на снижение уровня электрохимического взаимодействия водорода в растворе и его растворимости. Отклонение от этой закономерности наблюдается для хрома. Причины его «аномального поведения» требуют отдельного рассмотрения. 1. В результате выполненных исследований впервые установлено, что растворимость водорода в переходных металлах первого большого периода Ti, V, Mn, Fe, Со и Ni (исключая Cr и Си), имеющих заполненную 4з-орбиталь, находится в тесной зависимости от степени заполнения электронами Зс1-подуровня: с увеличением числа Зс1-электронов от 2-х у Ti до 7-и у Со растворимость водорода снижается, а затем, при переходе к Ni, она слабо увеличивается. 2. Металлические элементы этого же периода, имеющие незаполненную 4з-орбиталь (Cr и Си), независимо от степени заполнения Зс1-подуровня, характеризуются минимальной растворимостью водорода. 4. Установлено, что для элементов с заполненной 4з-орбиталью, наблюдается четко выраженная тенденция к росту растворимости водорода с увеличением разности электроот-рицательностей (%н - %иг), что свидетельствует об увеличении доли ионной составляющей в образовании связи между атомами водорода и металла-растворителя. 1. Коулсон У. Валентность / У. Коулсон,- М.: Мир, 1965,- 426 с. 2. Дей К. Теоретическая неорганическая химия. IК.Дей, Д.Селбин. - М.: Химия, 1969,- 432 с. 3. Пирсон У. Кристаллохимия и физика металлов и сплавов / У. Пирсон,- Мир, 1977,- 415 с. 4. Смирнов A.A. Теория сплавов внедрения / A.A. Смирнов,- М.: Наука, 1979,- 265 с. 5. Маклеллан Р.Б. Термодинамика разбавленных твердых растворов внедрения / Р.Б. Маклел-лан //Устойчивость фаз в металлах и сплавах. - М.: Мир, 1970,- С.330-355. 6. Кауфман Л. Расчет диаграмм состояния с помощью ЭВМ. / Л. Кауфман, X. Берштейн,-М.: Мир, 1972- 326с. 7. Фаст Дж. Взаимодействие металлов с газами: Пер. с англ. / Дж. Фаст,- М.: Металлургия, 1975 -Т.2.-350 с. 8. Максимов Е.Г. Водород в металлах / Е.Г. Максимов, O.A. Панкратов //Успехи физических наук - 1975,- №3,- С.385-412 9. Галактионова H.A. Водород в металлах / H.A. Галактионова,- М.: Металлургия, 1967,— 302 с. 10. Самсонов Г.В. О состоянии водорода в гидридах переходных металлов / Г.В. Самсонов II Докл. АН СССР - 1973 - №3,- С.621-623. 11. Похмурсъкий B.I. Вплив водню на дифузшш процеси в металах / B.I. Похмурсъкий, В.В. Федоров,- JlbBiB.: HAH Украши, ФХ1 i\i. Г.В. Карпенка, 1998,- 206 с. 12. Oriani R.A. The Physical and Metallurgical Aspects of Hydrogen in Metals / R.A. Oriani II Fourth International Conference on Cold Fusion.- Lahaina: Electric Power Research Institute, 1993,— P. 200-241 По влиянию на растворимость водорода температуры принято делить металлы на 2 группы: в одних с повышением температуры окклюзия водорода увеличивается (эндотермически окклюдирующие металлы), в других — уменьшается (экзотермически окклюдирующие). Однако в силу того, что некоторые металлы не могут быть причислены ни к одной из групп (имеют экстремальные точки на кривой зависимости), это деление считают не отвечающим реальной сущности процесса. На основании термодинамических представлений температурная зависимость растворимости водорода в металлах обычно выражается уравнением где ЕS — теплота растворимости 1 моля газа. Коэффициент 2 в знаменателе показателя степени указывает на то, что водород входит в кристаллическую решетку в диссоциированном состоянии. Для всех без исключения металлов при переходе из твердого состояния в жидкое наблюдается скачкообразное увеличение растворимости водорода. Менее резкие, но вполне ощутимые изменения растворимости наблюдаются при температурах аллотропических превращений. Поэтому процесс окклюзии водорода каким-либо металлом значительно более сложен и не может быть описан одной простой экспоненциальной кривой. К эндотермически окклюдирующим металлам можно отнести Ni, Fe, Co, Pt, Ti, U, Zr и др. Что касается состояния водорода, поглощенного путем эндотермической окклюзии, то оно очевидно характеризуется не образованием твердых растворов типа раствора внедрения и не гидридообразованием, как долгое время считалось. Гипотезой, которая полностью подтверждается экспериментальными данными, является представление о том, что водород находится в решетке металла в виде протона и проникает в электронные оболочки металлических атомов. Это подтверждено опытами А. И. Красникова, а позже Н. А. Галактионовой, В. И. Явойского и Г. И. Баталина. Дополнительным подтверждением является зависимость между значениями температурных коэффициентов электросопротивления и растворимостью водорода, влияние водорода на магнитные свойства железа и других металлов и сплавов и др. Изменение температуры в пределах области эндотермической окклюзии приводит к перераспределению протонов между металлическими атомами вследствие высокой подвижности протона. Вне пределов указанной области температур поведение и состояние водорода может быть иным. К экзотермическим окклюдерам относят Ti, Zr, V, Th, Nb, Ta, Pd, La, Ce, Hf и др. Перечисленные металлы способны окклюдировать значительно большие количества водорода, чем рассмотренные выше эндотермические металлы. Растворению водорода в металлах этой группы также предшествует его диссоциация. Однако в этих случаях окклюзия не всегда пропорциональна корню квадратному из давления газа. Если окклюзия водорода никелем и железом является полностью обратимым процессом, то окклюзия водорода титаном, палладием, цирконием и другими элементами протекает не вполне обратимо, обнаруживая определенный гистерезис. При повышении температуры общее количество водорода, окклюдированного металлами этой группы, убывает, но в большинстве случаев изобары растворимости не являются плавными кривыми, а имеют довольно сложную форму. Количества водорода, окклюдируемого металлами 2 группы при низких температурах, довольно значительны, и в некоторых случаях (например, ТI — Н, Zr — Н, Рd — Н) приближаются к атомным соотношениям. Это обстоятельство послужило основанием для того, чтобы считать металлы второй группы гидридообразующими, а уменьшение их окклюзионной способности при повышении температуры объяснять разложением гидридов. В отличие от гидридов щелочных металлов, представляющих собой химические соединения с ионной или ковалентной связью, предполагаемые в этих системах образования называют сплавообразными гидридами, или псевдогидридами. Эти данные показывают, что образование ионных гидридов щелочных и щелочноземельных металлов, в которых водород присутствует в виде отрицательного иона Н - , сопровождается значительным увеличением плотности по сравнению с чистым металлом. Образование гидридов, в которых ион водорода положителен (протон), и установлено наличие химической связи, также вызывает столь же значительное уменьшение плотности (UH3 и, по-видимому, ThH4). При рассмотрении химических соединений водорода с металлами следует учитывать, что широко распространенное деление металлов на «гидри-дообразующие» и «не образующие гидридов», на «растворяющие» и «не растворяющие» и т. д. является чисто искусственным, не соответствующим истинной физической сущности процесса, и обусловлено тем, что и отдельные явления и вся совокупность процессов в целом недостаточно изучены. Точно так же искусственным является деление металлов на «экзотермически окклюдирующие» и «эндотермически окклюдирующие» водород. Оба процесса (и с выделением, и с поглощением тепла) свойственны всем металлам. Но для одних металлов, к которым принадлежит большинство, в исследованной области температур лежит лишь одна часть кривой — ее эндотермическая или экзотермическая ветвь, а обратный процесс либо протекает в весьма узком интервале температур, либо имеет место при температурах, выходящих за пределы изученных. Для других же металлов в изученном интервале температур находятся оба возможных процесса, и тогда на кривой растворимости наблюдаются экстремальные точки. Из вышепоказанного следует, что особенности химического взаимодействия водорода с другими элементами соответствуют положениям этих элементов в периодической системе, по всем остальным видам взаимодействия также наблюдается отчетливая аналогия в поведении элементов, близких друг к другу по своем атомному строению. Все многообразие процессов взаимодействия водорода с различными элементами обусловлено при прочих равных условия особенностями атомной структуры данного элемента в данных конкретных условиях. А структура, в свою очередь, зависит от таких внешних факторов, как температура, давление и др. Таблица 5. Характер изменения плотности металлов при взаимодействии с водородом 2. Водород в стали 2.1 Растворимость Растворимость водорода в техническом железе зависит от состава сплава, температуры и давления водорода. С понижением температуры растворимость падает и в жидком, и в твердом состоянии (рис. 15), причем в точке перехода из жидкого состояния в твердое она изменяется скачкообразно. В твердом состоянии водород внедряется в α - и γ - решетку, т. е. образует твердые растворы внедрения. γ - железо способно растворять водорода больше, чем α - или δ - железо. Поэтому переходы железа из δ - в γ - и γ - в α - состояние отмечаются скачкообразными изменениями растворимости. Во всех фазах растворимость изменяется по логарифмическому закону в функции обратных значений температуры (рис. 15). Рис. 15. Растворимость водорода в железе в зависимости от температуры при атмосферном давлении. Растворимость водорода в железе пропорциональна квадратному корню из давления водорода. Соответствующие величины приведены на рис. 16, на котором представлена зависимость растворимости от температуры для различных давлений, полученная пересчетом из экспериментальных данных для давления 1 ат. Такая зависимость справедлива, конечно, только тогда, когда может быть достигнуто равновесие и прежде всего при высоких температурах. При низких температурах, порядка комнатной, кажущаяся повышенная растворимость может быть обусловлена образованием соединений или выделением водорода в пустоты. способность железа окклюдировать водород. По имеющимся данным, присадки кремния, алюминия, хрома, молибдена и вольфрама уменьшают растворимость водорода в железе, а присадки никеля, ванадия, ниобия, титана и марганца увеличивают окклюзию водорода железом. На рис. 70-73 показаны некоторые из полученных данных. Растворимость водорода в двойных сплавах имеет сложный характер: например, по данным Мартина, при температурах 400-1200 0 С в сплавах Fe - С, лежащих в α-области, растворимость водорода ниже, а в сплавах γ -области - выше, чем в чистом железе. Очевидно, окклюзия водорода двойными и тройными металлическими сплавами зависит не только от растворимости водорода в каждом металле в отдельности, но также и от характера взаимосвязи металлических компонентов сплава при заданной температуре и концентрациях, их взаимной растворимости, образования интерметаллических соединений и других факторов, вызывающих изменения в электронной структуре металлических атомов. В равной степени это может быть отнесено к некоторым присутствующим в железе неметаллическим элементам. Рис. 70. Влияние молибдена на растворимость водорода в железе (Сивертс) Рис. 71. Влияние никеля на растворимость водорода в железе Достоверных данных о влиянии углерода на растворимость водорода в твердом железе нет, так как экспериментальное определение. осложняется выделением газообразной окиси углерода. Имеющиеся по этому вопросу данные не вполне определенны. М. М. Карнаухов и А. Н. Морозов, исследовавшие влияние углерода на растворимость водорода в жидком железе, нашли, что с увеличением содержания углерода растворимость водорода в сплаве железо - углерод несколько уменьшается. Позднее растворимость водорода в жидких железоуглеродистых сплавах изучалась. Полученные данные приведены на рис. 74. Девес и Эванс [244] нашли, что при повышении температуры растворимость водорода увеличивается во всех железоуглеродистых сплавах. Растворимость водорода в чугунах с содержанием; до 3,4% углерода определяется, по мнению авторов, содержанием графита . Рис. 72. Влияние ванадия на растворимость водорода в железе (Сивертс) р = 22 мм рт. ст.. Основным источником водорода, окклюдируемого железом и его сплавами в процессе выплавки, являются влага и водяные пары, поэтому особый интерес представляет вопрос о влиянии кислорода на процесс окклюзии водорода железом и о совместной растворимости обоих газов в железе. Н. А. Галактионовой было высказано предположение, что кислород является одним из элементов, наиболее активно препятствующих поглощению водорода металлами, и введение в жидкий металл значительных количеств кислорода (кислородное дутье) может значительно уменьшить абсорбционную способность металла по отношению к водороду. А. Н. Морозов совместно с С. Чучмаревым и другими авторами исследовал совместную растворимость водорода и кислорода в жидком железе; полученные ими данные приведены на рис. 75. С повышением содержания кислорода в металле растворимость водорода в нем существенно понижается, а произведение концентраций водорода и КИС.1Iорода в металле имеет примерно постоянное значение при определенной температуре. Весьма характерно, что постоянным сохраняется произведение[Н]· [О], а не [Н2] ·,[0]. Последующие работы Нейгауза [245], Троута 1[246] и других авторов полностью подтвердили, что между концентрациями водорода и кислорода в металле существует жесткая связь и повышение степени окисленности металла сопровождается понижением количества окклюдированного водорода. На основе ранее разработанного подхода, учитывающего существование тесных корреляционных связей между характеристиками физико-химических свойств 3d-переходных металлов и электронной конфигурацией внешних электронных уровней их атомов, исследовано влияние состава двойных и тройных растворов указанных металлов в Fe на растворимость в них водорода. Показано, что в максимальной степени растворимость водорода в сплавах Fe-Mn-Me повышается при замещении марганца титаном; в меньшей степени в том же направлении действует ванадий. Снижение растворимости водорода в железе достигается с возрастающей интенсивностью при легировании: Co, Ni,Cr, Zn и Cu. Зависимость растворимости водорода в металлах первого, большого периода от электронной конфигурации внешних подуровней К теории влияния малых добавок палладия на растворимость водорода в железе и флокенообразование в сталях В1СНИК ПРИАЗОВСЬКОГО ДЕРЖАВНОГО ТЕХН1ЧНОГО УН1ВЕРСИТЕТУ 2008 р. Вип. № 18 РАСТВОРИМОСТЬ ВОДОРОДА В ТРЕХКОМПОНЕНТНЫХ СПЛАВАХ НА ОСНОВЕ ЖЕЛЕЗА На основе ранее разработанного подхода, учитывающего существование тесных корреляционных связей между характеристиками физико-химических свойств 3d-переходных металлов и электронной конфигурацией внешних электронных уровней их атомов, исследовано влияние состава двойных и тройных растворов указанных металлов в Fe на растворимость в них водорода. Показано, что в максимальной степени растворимость водорода в сплавах Fe-Mn-Me повышается при замещении марганца титаном; в меньшей степени в том же направлении действует ванадий. Снижение растворимости водорода в железе достигается с возрастающей интенсивностью при легировании: Со, Ni,Cr, Zn и Си. Прогнозирование уровней растворимости и других показателей, характеризующих состояние водорода в комплексно-легированных сталях и сплавах является одной из важных проблем теоретического и прикладного металловедения. В работах 2 вопросы, связанные с решением этой проблемы, рассматриваются на основе анализа корреляционных связей физико-химических характеристик 3d- переходных элементов: Ti, V, Cr, Mn, Fe, Со, Ni, Cu и Zn с их электронным строением. Учитывая аналогичный характер распределения электронов на подва-лентных уровнях, соответствующих конфигурации Аг, исходили из того, что характер и степень взаимодействия атомов элементов этой группы при образовании сплавов определяется перераспределением электронов на внешних уровнях. На основе такого подхода, установлен ряд важных зависимостей между характеристиками физико-химических свойств твердых растворов замещения и электронной конфигурацией внешних энергетических уровней изолированных атомов. Целью настоящей работы является исследование влияния состава двойных и тройных твердых растворов указанных выше элементов в железе на растворимость в них водорода, используя полученные ранее зависимости. Основанием для такого исследования служило установленное в работе [1] соотношение логарифма растворимости водорода Сн в Зс1-переходных металлах и количества электронов на 4s и Зс1-уровнях изолированных атомов. Для температуры Т = 1230 К такая зависимость с точностью R2 = 0,964 аппроксимируется уравнением: lgCjf0 =4,136—-0,638, (1) где q4S и q3d - число электронов, соответственно на 4s и 3d -уровне изолированного атома каждого из элементов исследуемой группы. Учитывая линейный характер зависимости (1), при замещении в решетке Fe одного атома с зарядами q4sFe и q3dFe, атомом другого элемента с зарядами q4sMe и q3dMe, изменение концентрации электронов на 4s и 3d - подуровнях сплава выразим в виде: где N - атомная доля растворенного элемента. С учетом этих соотношений, выражение, характеризующее зависимость lgCH в твердом растворе на основе одного из элементов, в частности Fe, от атомной концентрации любого другого элемента данного периода, запишется в виде: С использованием приведенных в таблице исходных данных, выполнены расчеты ^СнРе при изменении N для двойных растворов металлов первого большого периода в уБе при 1230 К. Полученные зависимости !§С„ от концентрации растворенного элемента (Рис. 1), очевидно, от- Таблица - Исходные данные для расчетов Элемент Ti V Сг Мп Fe Со № Си Zn q4s 2 3 5 5 6 7 8 10 10 qjd 2 2 1 2 2 2 2 1 2 Сн, см /моль 342 119 1,13 17,74 2,79 1,87 5,66 0,79 0,0871 lgCH 3,537 2,077 0,052 1,249 0,446 0,271 0,753 -0,102 -1,06 ражают истинную картину растворимости водорода в двойных сплавах только в области разбавленных растворов всех элементов в Ре и, наоборот, железа в чистых металлах первого большого периода: Т1 V, Сг, Мп, Ре, Со, №, и Си. Как видно из рис. 1, в максимальной степени повышает растворимость водорода в уРе добавка к нему Тк в меньшей степени увеличивают 1§СнРе элементы V и Мп. Все они характеризуются меньшим, чем у Ре числом 3(1-электронов при заполненной 4з-орбитали. Заметим, что Сг, как и Мп, имеет пять 3(1- электронов, но при незаполненной 4з-орбитали снижает растворимость водорода в уРе. Остальные элементы: Со, N1, Си и 2п. по мере увеличения в них числа Зё-электронов, снижают растворимость водорода в уРе с ростом их концентрации. Установлено, что характер влияния легирующих элементов на растворимость водорода в а и уРе, а также в жидком железе при 1600 °С [3] является аналогичным, что, очевидно, свидетельствует о доминирующем воздействии электронного строения внешних уровней атомов легирующих элементов на процессы, обусловливающие уровень растворимости. На основе изложенного выше подхода выполнено исследование влияния изменения составов трехкомпо-нентных растворов Зс1-переходных металлов на растворимость в них водорода. Основой для такого исследования служила установленная зависимость (1) 1§СН от распределения электронов Учитывая непрерывный характер этой зависимостей для ряда переходных металлов: П. V, Сг, Мп, Ре, Со, №, Си и Ж% число электронов на и Зс! - уровнях в трехкомпонентных растворах определяется с помощью уравнений: О 0.2 0.4 0.6 0.! I Концентрашя легугочоро елемента, ат.часш Рис. 1 - Влияние концентрации легирующего элемента на растворимость водорода в уРе при 1230 К - заряда электронов на 4s и 3(1-подуровнях металла растворителя; - заряды электронов на 4s и Зс1-подуровнях растворенного металла Ме2; - заряды электронов на 4s и 3(1-подуровнях растворенного металла Mes; у - доля электронов металлов Мет и Мез в тройном (Mei+Me2 +Мез)-твердом растворе; х - доля электронов металла Мез в двойном (Мез+ Мез)- твердом растворе. Расчетное определение зависимости lgCH от состава (Ме1+Ме2+Мез)- раствора выполнено для условий: у = 0,05 и х = 0 : 1. что соответствует разбавленному трехкомпонентному раствору, в котором атомная доля растворителя Mei составляет 0,95, а суммарная доля растворенных компонентов (Мез + Мез) равна 0,05. Воспользовавшись данными таблицы, а также приведенными выше значениями у и х, с помощью уравнений (1 - 4) выполнены расчеты lgC[H] для сис- темы Fe+Mn+Me+H при 1230 К, результаты которых приведены на рис. 2. Растворителем в таком сплаве является железо, содержание которого составляет 95 %. Суммарная концентрация Мл. (Смп) и одного из элементов: Ti, V, Cr, Со, Ni, Си и Zn (СМе), составляет: Смп+ СМе = 5 %. Положение оси ординат на графике соответствует базовому составу: 95 %Fe + 5 %Мп. При смещении вправо вдоль оси абсцисс, Мп в базовом составе замещается одним из элементов указанной группы. В результате чего, в конечной точке оси абсцисс весь марганец (100 %) исключается из состава сплава, который становится двухкомпонснтным: 95 % Fe + 5 %Ме. На рис. 2 приведена серия прямых, выходящих из одной точки, отвечающей растворимости водорода в сплаве базового состава: 95 %Fe + 5 %Мп. Как видно, при замещении марганца титаном, величина IgCE в растворе Fe+Mn+Ti растет по линейному закону. Несколько менее интенсивный рост IgCj^ наблюдается при замещении марганца ванадием. В случае замещения марганца элементами: Fe, Cr, Со, Ni, Си и Zn, в тех же условиях lgC| в возрастающей степени уменьшается при переходе от Fe к Си с увеличением их концентрации. Сравнение этих данных с соответствующими результатами для двойных сплавов Fe-Me, приведенными на рис. 1, свидетельствует об их практически полном соответствии. К особенностям влияния исследуемых металлов на растворимость водорода в тройных сплавах следует отнести совпадение законов изменения lgO£ от концентрации элементов Сг и Ni, имеющих существенное отличную электронную конфигурацию электронов внешних 4s и 3d- уровней. Одним из направлений дальнейших исследований является теоретическое прогнозирование растворимости водорода в сталях и сплавах более сложных систем легирования с целью разработки, как материалов-накопителей водорода, так и сталей с повышенным сопротивлением водородному охрупчиванию и флокенообразованию. 1. В тройных сплавах на основе железа Fe-Mn-Me, растворимость водорода при 1230 К в максимальной степени возрастает при замещении марганца титаном; в меньшей степени в том же направлении действует ванадий. 2. В возрастающей степени, в таких же условиях, растворимость водорода снижают элементы: Со, Ni, Cr, Zn и Си. 3. Влияние легирующих элементов на растворимость водорода в исследованных двойных и тройных сплавах на основе железа является аналогичным. 1. Ткаченко К.И. Зависимость растворимости водорода в металлах первого большого порядка от электронной конфигурации внешних подуровней / К.И. Ткаченко // Вюник Приаз. держ. техн. ун-ту: 36. наук. пр. - Mapiynonb, 2006. - Вип. 16. - С. 16- 80. 2. Ткаченко К. И. Анализ условий образования и свойств бинарных твердых растворов на основе элементов первого большого перехода / К.И. Ткаченко // Захист мсталурпйних машин В1д поломок: 36. наук. пр. - Мар!уполь. 2006. - Вип. 9. - С. 226 - 232. 3. Кудрин В.А. Теория и технология производства стали / В.А. Кудрин. - М.: Мир, ООО Издательство ACT, 2003. - 528 с. Читайте также:Водород в железе и других металлах , страница 8
Водород в железе и других металлах , страница 15
Система водород - железо. Растворимость водорода в жидком железе , страница 3
Растворимость водорода в трехкомпонентных сплавах на основе железа Текст научной статьи по специальности «Химические науки»
Похожие темы научных работ по химическим наукам , автор научной работы — Ткаченко К. И.
Текст научной работы на тему «Растворимость водорода в трехкомпонентных сплавах на основе железа»
