Реакция замещения ряд активности металлов
Обновлено: 13.05.2024
Цель урока: дать понятие о сущности реакций замещения.
- дидактические (образовательные): – продолжить формирование умения записывать уравнения химических реакций;
– экспериментально установить какие реакции являются реакциями замещения;
– начать формирование умения предсказывать продукты реакций замещения;
– дать первоначальное понятие об электрохимическом ряде напряжений металлов.
- развивающие: – развивать общеучебные умения и навыки: работа по плану; работа с учебником;
– развивать мыслительные операции учащихся: сравнение, анализ, синтез;
– развивать умение делать самостоятельные выводы;
– развивать внимание учащихся и его свойства: объём внимания, концентрация внимания, распределение внимания; развивать разные виды памяти учащихся: механическую, слуховую и пр.
-Воспитательная: – прививать культуру умственного труда и сотрудничества;
– воспитывать дисциплинированность учащихся;
– воспитывать чувство ответственности;
– способствовать созданию благоприятного психо-эмоционального климата на уроке.
Тип урока: формирования новых знаний.
Методы и методические приемы : – словесные (рассказ, объяснение, беседа);
– иллюстративные (схемы химических реакций);
– частично-поисковый, проблемный (проблемная ситуация).
Оборудование и реактивы : – Zn, Mg, Al, Си, Li, Na, Ca – металлы;
– H Cl, H2SO4, Си SO4, фенолфталеин – растворы. Ряд активности металлов
Форма организации занятий: фронтальный опрос, самостоятельная работа, лабораторный опыт, групповая работа.
Основные понятия : реакции замещения, ряд активности металлов, условия взаимодействия металлов с растворами кислот и солей
Этапы урока и их содержание
Деятельность
Организационный этап
Создает эмоциональный настрой на изучение темы.
-Приветствуют учителя, настраиваются на работу на уроке
Проверка домашнего задания, воспроизведение и коррекция опорных знаний учащихся
Работа в парах (взаимопроверка):
Составьте формулы (на листочках ):
1.Что такое химическая реакция? 2. Что называют уравнением химической реакции? 3. Какие типы реакций вам известны?
Контролирует выполнение задания
Проводит фронтальную беседу
Отвечают на вопросы учителя
«Расставьте коэффициенты в схемах, укажите тип реакций». 1. KClO3 → KCl + O2
2. CaO + SiO2 → CaSiO3
4. Fe(OH)3 → Fe2O3 + H2O
5. Na + H2O → NaOH + H2
В какой реакции вы не смогли определить тип? ( в 5 . )
Сегодня мы будем изучать этот новый для вас тип реакций- реакции замещения.
Сообщает тему урока, дату проведения урока, цель урока
Записывают в тетради дату и тему урока.
Записывают тему урока в тетрадь
Введение новых знаний.
Мне бы хотелось начать изучение нового материала с открытия водорода Генри Кавендишем в 1766 году. Он проделывал такой опыт. В раствор соляной кислоты опускается гранула (нужно сразу же объяснить это новое понятие – “зёрнышко”, “кусочек”) цинка – начинается выделение пузырьков газа, который учитель собирает в перевёрнутую пробирку большего диаметра.
Объясняется, что этот способ называется способом вытеснения воздуха, а пробирка перевёрнута потому, что водород легче воздуха.
Затем учитель показывает способ распознавания водорода в двух модификациях:
1) если он собирал Н2 в перевёрнутую пробирку, то при поднесении к ней горящей спички слышен характерный “лающий” взрыв – значит, собран водород в смеси с воздухом – не чистый газ;
2) если же спичка подносится к самой пробирке, где идёт реакция, которую учитель предварительно прикрыл большим пальцем, то слышится “глухой” хлопок – взрыв, значит, собран чистый водород, без примеси воздуха.

Следовательно, из исходных простого и сложного веществ образовалось новое простое и новое сложное. Такие реакции называются реакциями замещения.
Учитель предлагает ребятам записать аналогичную реакцию для серной кислоты и магния:

И усложняет для серной кислоты и алюминия:

Вначале выводится формула соли Al2 (SO4)3
А затем уравнивается запись – учитель рекомендует при уравнивании реакций с участием солей начинать именно с их формул ( “два алюминия и три остатка”):
и, наконец, водород:
II. Электрохимический ряд напряжений металлов и два его правила.
Учитель ставит проблемный вопрос:
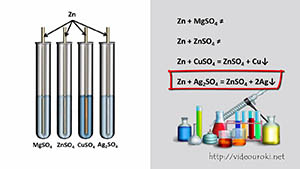
- “А любой ли металл способен вступить в реакцию замещения с кислотой?” – и демонстрирует отсутствие взаимодействия между НСl и Сu. Оказывается, для решения этого вопроса можно воспользоваться ещё одной узаконенной “шпаргалкой” – электрохимическим рядом напряжений металлов (можно на этом этапе давать другое определение – ряд активности – просто и понятно): если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет. Это и есть первое правило ряда напряжений. Zn, Mg, Al давали реакцию замещения с кислотами (они находятся в ряду напряжений до Н), а Си нет (она после Н). Этот ряд имеет и ещё одно правило, оно тоже относится к реакциям замещения металлов, но только с растворами солей: если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли (второе правило ряда напряжений). Вспомним правила обращения с лабораторным оборудованием и реактивами, т. б.
Проводится лабораторный опыт “Замещение меди в растворе сульфата меди (II) железом”.

Физминутка
По аналогии составляется уравнение реакции между алюминием и раствором хлорида меди (II):
2 А1 + 3 Сu С12 = 2 А1 С13 + 3 Сu
Необходимо показать, что здесь положение металла до и после Н уже не имеет значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Серебро на медной монетке получается неэффектное – тёмный налёт, но если его натереть мягкой тряпочкой – монета заблестит, она стала посеребрённой.
В заключение учитель демонстрирует взаимодействие щелочных металлов и Са с водой.
Чашечки Петри снизу подписываются фломастерами ( Na, Ca). В них наливается немного, на донышко, воды, куда добавляется фенолфталеин. Затем в каждую чашечку, опускается по кусочку (со спичечную головку) металла. Записываются соответствующие уравнения реакций:
Учащимся напоминается название подгруппы – “щелочные металлы”: теперь этимология названия подтверждена экспериментом.
Вступительное слово учителя об открытии водорода. Демонстрация опыта. Объяснение учителя.
§ 36. Ряд активности металлов. Реакции замещения
• для металлов характерны металлический блеск, электропроводность, пластичность и т. п.
Понятие о ряде активности металлов
Во многих химических реакциях принимают участие простые вещества, в частности металлы. Металлы могут взаимодействовать почти со всеми классами неорганических соединений, которые изучаются в школьном курсе химии. Однако разные металлы проявляют разную активность в химических взаимодействиях, и от этого зависит, произойдет реакция или нет.
Чем больше активность металла, тем энергичнее он взаимодействует с другими веществами. По активности все металлы можно расположить в ряд, который называется рядом активности металлов (вытеснительным рядом металлов, рядом напряжений металлов, электрохимическим рядом напряжений металлов). Этот ряд впервые составил и изучил выдающийся украинский ученый Η. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Ряд активности металлов Бекетова выглядит так (более полный ряд см. на форзаце 2):
Николай Николаевич Бекетов (1827-1911)
Русский и украинский химик, основатель украинской школы физической химии, академик Петербургской академии наук с 1886 г. Родился в семье морского офицера. Закончил Казанский университет, работал в Петербурге в Медико-химической лаборатории. Преподавал химию цесаревичу — будущему императору Николаю II. С 1855 г. профессор императорского университета в Харькове, где по предложению ученого в 1864 г. было открыто первое в Украине физикохимическое отделение. Именно там впервые в мире он начал преподавать физическую химию как отдельную дисциплину. Бекетов открыл способ восстановления металлов из их оксидов, который и сегодня используют в металлургии, установил зависимость сродства элементов от порядкового номера, первым получил чистые оксиды щелочных элементов (Натрия, Калия), составил ряд активности металлов, который назван его именем, был автором первого в мире учебника по физической химии.
В этом ряду металлы расположены по уменьшению их химической активности в водных растворах. Таким образом, среди приведенных металлов наиболее активным является калий, а наименее активным — золото. С помощью этого ряда легко выяснить, какой металл активнее другого. Также в этом ряду находится водород. Конечно, водород не является металлом, но в данном ряду его активность принята за точку отсчета (своего рода ноль).
Взаимодействие металлов с кислотами
Металлы, расположенные в ряду активности слева от водорода, способны вступать в реакции с кислотами, в которых атомы металлических элементов замещают атомы Гидрогена в кислотах. При этом образуются соль соответствующей кислоты и водород Н2 (рис. 36.1, с. 194):
Рис. 36.1. Взаимодействие металлов с кислотами: а — алюминий; б — цинк; в — никель
Чем левее расположен металл в ряду активности, тем более бурно он взаимодействует с кислотами. Наиболее интенсивно вытесняют водород из кислот те металлы, которые расположены в самом начале ряда. Так, магний взаимодействует очень бурно (жидкость словно закипает), цинк взаимодействует значительно спокойнее, железо реагирует совсем слабо (пузырьки водорода едва образуются), а медь вовсе не взаимодействует с кислотой (рис. 36.2).
Рис. 36.2. Взаимодействие металлов с хлоридной кислотой
Если металл расположен в ряду активности справа от водорода, то он не способен вытеснять водород из растворов кислот, и потому реакция не происходит (табл. 12, с. 197):
Обратите внимание на уравнения реакций металлов с кислотами, приведенные выше: в этих реакциях атомы металлических элементов из простого вещества замещают атомы Гидрогена в кислотах. Такие реакции называют реакциями замещения.
Реакции замещения — это реакции, в которых атом элемента простого вещества вытесняет атом другого элемента из сложного вещества.
Взаимодействие нитратной и концентрированной сульфатной кислот с металлами происходит по другой схеме. В таких реакциях водород почти не выделяется, а выделяются другие продукты реакции, о чем вы узнаете в следующих классах.
Взаимодействие металлов с водой
Металлы, расположенные в ряду активности слева от водорода, способны вытеснять водород не только из растворов кислот, но и из воды. Как и в случае с кислотами, активность взаимодействия металлов с водой зависит от расположения металла в ряду активности (рис. 36.3).
Рис. 36.3. При обычных условиях натрий и кальций активно взаимодействуют с водой с выделением водорода, а цинк и железо не взаимодействуют
Металлы, расположенные в ряду активности слева от магния, взаимодействуют с водой при обычных условиях. В таких реакциях образуются щелочи и водород:
Литий взаимодействует с водой очень бурно (рис. 36.4):
Рис. 36.4. Взаимодействие лития с водой с образованием бесцветного раствора литий гидроксида
Калий реагирует с водой так бурно, что иногда случается взрыв: во время реакции выделяется настолько большое количество теплоты, что выделяемый водород загорается и вызывает воспламенение самого металла.
Кальций и натрий взаимодействуют с водой так же бурно, но без взрыва:
То, что в результате реакции активных металлов с водой образуются щелочи, можно доказать, добавив раствор фенолфталеина, который приобретает характерную малиновую окраску (рис. 36.5, с. 196).
Рис. 36.5. После взаимодействия кальция с водой добавили фенолфталеин: в растворе виден осадок кальций гидроксида, а малиновый цвет свидетельствует о наличии щелочи
Магний взаимодействует с водой по такой же схеме, что и активные металлы, но вместо щелочи образуется нерастворимое основание. Реакция протекает настолько медленно, что сначала при добавлении магния к воде никакой реакции не наблюдается — пузырьки водорода начинают выделяться лишь спустя некоторое время (рис. 36.6). Для инициирования реакции воду следует немного подогреть или проводить реакцию в кипящей воде.
Рис. 36.6. При комнатной температуре магний взаимодействует с водой очень медленно, раствор слегка мутнеет вследствие образования малорастворимого магний гидроксида
Большинство других металлов, расположенных между магнием и водородом в ряду активности, также могут взаимодействовать с водой (вытеснять из нее водород), но это происходит при более «жестких» условиях: для этого через раскаленные металлические опилки пропускают перегретый водяной пар. Конечно, при таких условиях гидроксиды разлагаются (на оксид и воду), поэтому продуктами реакции являются оксид соответствующего металлического элемента и водород:
Никель, олово и свинец пассивируются водой, поэтому ни при каких условиях с водой не реагируют.
Таблица 12. Зависимость химических свойств металлов от положения в ряду активности
Взаимодействие металлов с солями
Если соль растворима в воде, то металлический элемент в ней может быть вытеснен более активным металлом:
Например, если погрузить в раствор купрум(II) сульфата железную пластинку, через определенное время на ней выделится медь в виде красного налета:
Со временем железная пластинка покрывается довольно плотным слоем порошка меди, а раствор светлеет, что свидетельствует об уменьшении в нем концентрации купрум(II) сульфата (рис. 36.7).
Рис. 36.7. Взаимодействие раствора купрум(II) сульфата с железной пластинкой
Железо расположено в ряду активности слева от меди, поэтому атомы Феррума могут вытеснить атомы Купрума из соли. Но если в раствор купрум(II) сульфата погрузить серебряную пластину, то реакция не происходит:
Медь можно вытеснить из соли любым металлом, расположенным слева от меди в ряду активности металлов. При этом медь будет вытеснять из растворов других солей любой металл, который расположен в ряду активности справа от нее (рис. 36.8):
Рис. 36.8. Менее активное, чем медь, серебро оседает на поверхности медной проволоки. Раствор приобретает голубую окраску благодаря образованию на нем соли Купрума
Наиболее активные металлы, расположенные в самом начале ряда, — натрий, калий — не вытесняют другие металлы из растворов солей, поскольку они такие активные, что взаимодействуют не с растворенной солью, а с водой, в которой эта соль растворена.
Взаимодействие металлов с оксидами
Оксиды металлических элементов также способны взаимодействовать с металлами. Более активные металлы вытесняют менее активные из оксидов. Но, в отличие от взаимодействия металлов с солями, чтобы реакция осуществилась, оксиды необходимо расплавить:
Для получения металла из оксида можно применять любой металл, который расположен в ряду активности левее, даже самые активные натрий и калий, ведь в расплавленном оксиде воды нет:
ZnO + 2Na = Na2O + Zn
CaO + 2K = K2O + Ca
Вытеснение металлов из солей или оксидов более активными металлами иногда применяют в промышленности для получения металлов.
• Многие кислоты и другие вещества алхимики называли «спиртами» (от латин. spiritus — «дух», «запах»). Так, был spiritus sale — соляный спирт, или хлоридная кислота, spiritus nitrate — нитратная кислота и т. д. В современном химическом языке от этих названий остались только spiritus ammonia — нашатырный спирт, который является раствором аммиака NH3, и spiritus vini — винный, или этиловый, спирт.
• Горящие активные металлы (магний, натрий и др.) невозможно погасить водой. Причина заключается в том, что при контакте с водой горящий магний реагирует с ней, вследствие чего выделяется водород, который только усиливает горение.
• «Царской водкой» химики называют кислоту, которая является смесью концентрированных нитратной и хлоридной кислот. Такое название эта смесь получила потому, что с ней взаимодействует даже золото.
Реакции замещения

Данный видеофрагмент объясняет учащимся сущность реакций замещения, знакомит их с рядом активности металлов, прогнозированием протекания реакций между металлами и кислотами, металлами и солями, в уроке есть несколько демонстраций, которые помогут учащимся в описании лабораторного опыта по этой теме.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Реакции замещения"
Проведем опыт английского химика Г. Кавендиша. Для этого нальем в пробирку раствор соляной кислоты и поместим туда несколько гранул цинка. Мы видим выделение пузырьков газа. Соберем этот газ методом вытеснения воздуха, т.к. выделяющийся газ, водород, легче воздуха. Когда соберется достаточное количество газа, поднесем пробирку с газом водородом к пламени спиртовки, после чего раздастся взрыв, сопровождающийся «лающим» звуком. Этот взрыв произошел из-за смешения водорода с воздухом.

Смесь 2 объёмов водорода и 1 объема кислорода называют «гремучим газом». Если собрать чистый водород и поднести пробирку к горелке, то раздастся легкий хлопок, из-за сгорания чистого водорода. Откуда в реакции водород и какие ещё продукты образуются?
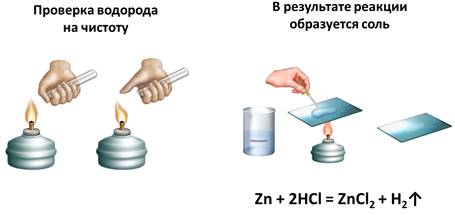
В результате этой реакции – между цинком и соляной кислотой – образуется соль (хлорид цинка). Это можно доказать, если немного этого раствора поместить на предметное стекло и выпарить. В результате вода испарится, а на стеле будут кристаллы соли. Теперь составим уравнение этой реакции: в реакцию вступает цинк и соляная кислота, в результате чего образуется соль – хлорид цинка и выделяется водород.
Zn + 2HCl = ZnCl2 + H2↑
Проведем дугой эксперимент. Нальем в четыре пробирки раствора соляной кислоты. В первую пробирку поместим кальций, во вторую – магний, в третью – цинк, в четвертую – медь. Понаблюдаем за процессом, будет ли выделение водорода во всех случаях, ведь в реакцию вступает металл и соляная кислота? Самое интенсивное выделение водорода наблюдается в первой пробирке, где был металл кальций, во второй пробирке – с металлом магнием – менее интенсивное, с цинком еще менее интенсивное, а с медью реакция не протекает, т.к. выделение водорода и вовсе не наблюдается.

Поэтому, для прогнозирования протекания реакции между металлом и кислотой, нужно использовать ряд активности металлов, или ряд напряжений металлов. Как видите, в этом ряду есть и водород, который металлом не является. Металлы, которые стоят в ряду напряжений металлов до водорода, способны вытеснять его из растворов кислот, те металлы, которые стоят в этом ряду после водорода, этой способностью не обладают.
Самые активные металлы находятся вначале ряда, менее активные – в конце. Т.к. кальций более активный, то выделение водорода в растворе кислоты шло интенсивнее, чем у магния или цинка. Медь не вытесняет водород из раствора кислот, потому как этот металл стоит в конце ряда. В этом вы сами убедились из предыдущего опыта.
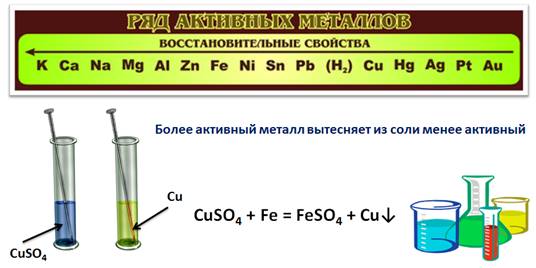
Ряд активности металлов используют также для прогнозирования реакций между металлом и раствором соли. Для этого нужно знать, что более активный металл вытесняет из раствора соли менее активный.
Проведем эксперимент: поместим в химический стакан с раствором сульфата меди (II) железный гвоздь. Через некоторое время на гвозде появляется красный налет, а раствор соли изменяет свою окраску. Красный налет – это выделившаяся медь, раствор изменил окраску, т.к. в результате реакции образовался раствор сульфата железа (II).
CuSO4 + Fe = FeSO4 + Cu↓
Если цинк поместить в растворы сульфатов магния, цинка, меди и серебра, то из всех этих растворов он вытеснит только медь в виде красного налёта и серебро в виде серебристо-белого налета. Магний более активный металл, чем цинк, т.к. в ряду активности стоит левее цинка, поэтому реакция не прошла, как и реакция цинка с раствором сульфата цинка.

Если поместить медь в раствор нитрата серебра, то через некоторое время на меди появляется серебристо-белый налет из-за образовавшегося серебра. Как видим, реакция протекает, т.к. медь стоит в ряду напряжений металлов левее серебра, т.е. является более активным металлом, чем серебро.

Все рассмотренные реакции являются реакциями замещения. Теперь можно сделать вывод, что реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
§ 32. Реакции замещения
Познакомимся с третьим типом реакций — реакциями замещения.
Повторим опыт замечательного английского химика — лорда Г. Кавендиша.
Нальём в пробирку 2—3 мл соляной кислоты, а затем поместим в неё 2—3 гранулы (от греч. гранула — зёрнышко) цинка. Заметим выделение газа. Накроем на 3—4 с пробирку-реактор, в которой протекает реакция, другой пробиркой большего диаметра и соберём в неё выделяющийся газ (методом вытеснения воздуха).
Это возможно потому, что выделяющийся в результате этой реакции газ — водород — гораздо легче воздуха. Приподняв пробирку с водородом над пробиркой-реактором, быстро поднесём её отверстие к пламени горелки. Раздастся взрыв, сопровождающийся характерным «лающим» звуком. Это взрывается смесь водорода с воздухом, которую образно называют «гремучим газом». Точнее, так называют смесь 2 объёмов водорода и 1 объёма кислорода.
Если же закрыть отверстие пробирки-реактора пальцем и через 5—10 с после того, как почувствуется давление собранного в верхней части пробирки газа на палец, убрать его с одновременным поднесением к отверстию горящей спички, то раздастся лёгкий хлопок — результат сгорания чистого водорода. Если несколько капель жидкости, полученной в результате реакции между цинком и соляной кислотой, поместить на часовое стекло и выпарить, то можно заметить образование кристалликов соли — хлорида цинка.
Составим уравнение реакции цинка с соляной кислотой:

Аналогичную реакцию можно провести и с другим металлом — алюминием:

С раствором серной кислоты цинк и алюминий образуют уже другие соли — сульфаты, например:

Все ли металлы взаимодействуют с кислотами с образованием соли и водорода?
Обратимся к эксперименту. Нальём в четыре одинаковые пробирки равные объёмы соляной кислоты и поместим в них разные металлы: в 1-ю — кусочек кальция, во 2-ю — магния, в 3-ю — цинка, а в 4-ю — меди (рис. 104). Нетрудно заметить, что интенсивность выделения водорода будет уменьшаться от кальция к цинку, а в пробирке с медью газ вообще не выделяется — там не происходит реакция.

Рис. 104.
Взаимодействие различных металлов с соляной кислотой
Для прогнозирования возможности протекания реакций между металлами и кислотами обратимся к так называемому ряду активпости (напряжений) металлов'.
Li, К, Ва, Са, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H2, Cu, Hg, Ag, Au.
Почему же в ряд металлов попал неметалл — водород? Оказывается, каждый из металлов, расположенных в ряду активности металлов до водорода, способен вытеснять его из растворов кислот. А вот медь с соляной кислотой не взаимодействует и поэтому находится в ряду активности металлов после водорода. В пробирке с этим металлом и соляной кислотой реакции не наблюдалось. Аналогично не будут вытеснять водород из растворов кислот ртуть, серебро и золото.
Ряд активности металлов можно также использовать для прогнозирования возможности протекания реакций вытеснения одних металлов из растворов их солей другими.

Рис. 105.
Реакция замещения меди железом в растворе сульфата меди (II)
Обратимся к эксперименту: поместим в химический стакан с раствором сульфата меди (II) большой железный гвоздь. Уже через 2—3 мин можно заметить, что та часть гвоздя, которая находится в растворе, покрылась красным налётом выделившейся меди (рис. 105). Произошла реакция, уравнение которой:
Цинк взаимодействует с растворами солей меди и серебра, но не магния или цинка (рис. 106).

Рис. 106.
Взаимодействие цинка с растворами различных солей
Для того чтобы реакция между металлом и раствором соли была практически осуществима, необходимо выполнение следующего условия: металл должен располагаться в ряду активности металлов левее металла, входящего в соль, т. е. быть активнее металла соли. Поэтому медь не вступает в реакцию с раствором соли свинца или железа, но зато вытесняет серебро из раствора нитрата серебра (рис. 107):

Рис. 107.
Кристаллы серебра, выделившиеся на медной проволоке в результате реакции замещения меди в растворе нитрата серебра
Все рассмотренные выше реакции относят к реакциям замещения. Нетрудно заметить, что эти реакции протекают между двумя исходными веществами, одно из которых простое, а другое — сложное, а в результате получаются два новых вещества — новое простое и новое сложное.
| Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе. |
Лабораторный опыт № 16
Замещение меди в растворе сульфата меди (II) железом
- Налейте в две пробирки по 2 мл раствора сульфата меди (II). Опишите цвет раствора. Осторожно погрузите в одну из пробирок железный гвоздь (скрепку), привязанный на нитке. Опишите условие проведения реакции.
- Реакции замещения.
- Ряд активности металлов.
- Условия взаимодействия металлов с растворами кислот и солей.
- Какие реакции называют реакциями замещения? Сравните их с реакциями соединения и разложения.
- Запишите уравнения следующих реакций замещения:
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
