Редкоземельные металлы почему так называются
Обновлено: 17.05.2024
Редкоземе́льные элеме́нты — группа из 17 элементов, включающая лантан, скандий, иттрий и лантаноиды. Все эти элементы — металлы серебристо-белого цвета, при том все имеют сходные химические свойства (наиболее характерна степень окисления +3).
Содержание
Происхождение названия
Название «редкоземельные» (встречается сокращение TR, ср. лат. terrae rarae — «редкие земли») дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре (содержание (1,6-1,7)·10 −2 % по массе) и, во-вторых, образуют тугоплавкие, практически не растворимые в воде оксиды (такие оксиды в начале XIX века и ранее назывались «землями»).
Название «редкоземельные элементы» исторически сложилось в конце XVIII — начале XIX века, когда ошибочно считали, что минералы, содержащие элементы двух подсемейств, — цериевого (лёгкие — La, Се, Рг, Nd, Sm, Eu) и иттриевого (тяжёлые — Y, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu) — редко встречаются в земной коре. Однако по запасам сырья редкоземельные элементы не являются редкими, по суммарной распространенности они превосходят свинец в 10 раз, молибден — в 50 раз, вольфрам — в 165 раз.
История
В 1794 году финский химик Юхан Гадолин, исследуя рудные образцы вблизи шведского местечка Иттербю, обнаружил неизвестную до того «редкую землю», которую назвал по месту находки иттрий. Позже, немецкий химик Мартин Клапрот разделил эти образцы на две «земли», для одной из которых он оставил имя иттрий, а другую назвал церий (в честь недавно открытой малой планеты Церера и по имени древнеримской богини Цереры). Немного спустя шведский ученый К. Мосандер сумел выделить из того же образца еще несколько «земель». Все они оказались оксидами новых элементов, получивших название редкоземельные металлы. Совместно к 1907 году химики обнаружили и идентифицировали всего 14 таких элементов. На основе изучения рентгеновских свойств всем элементам были присвоены атомные номера от 57 (лантан) до 71 (лютеций), кроме 61. По возрастанию атомного веса они расположились следующим образом:
| Z | Имя | Этимология | |
|---|---|---|---|
| 57 | La | Лантан | от греч. «скрытный» |
| 58 | Ce | Церий | в честь Цереры |
| 59 | Pr | Празеодим | от греч. «зеленый близнец», из-за зеленой линии в спектре |
| 60 | Nd | Неодим | «новый близнец» |
| 61 | Pm | Прометий | от имени мифического героя Прометея, похитившего у Зевса огонь и передавшего его людям. |
| 62 | Sm | Самарий | по имени минерала самарскит, в котором был обнаружен |
| 63 | Eu | Европий | в честь Европы |
| 64 | Gd | Гадолиний | в честь Иохана Гадолина |
| 65 | Tb | Тербий | в честь Иттербийского месторождения |
| 66 | Dy | Диспрозий | от греч. «труднодоступный» |
| 67 | Ho | Гольмий | в честь Стокгольма |
| 68 | Er | Эрбий | в честь Шведского села Иттербю |
| 69 | Tm | Тулий | от старого названия Скандинавии |
| 70 | Yb | Иттербий | в честь Шведского города Иттерби |
| 71 | Lu | Лютеций | от древнеримского названия Парижа |
Вначале ячейка под номером 61 была незаполненной, в дальнейшем это место занял прометий, выделенный из продуктов деления урана и ставший 15-м членом этого семейства.
Свойства и получение


Оксиды редкоземельных элементов. По часовой стрелке от центрального первого: празеодим, церий, лантан, неодим, самарий, гадолиний
Редкоземельные элементы проявляют между собой большое сходство химических и некоторых физических свойств, что объясняется почти одинаковым строением наружных электронных уровней их атомов. Редкоземельные элементы — металлы, их получают восстановлением соответствующих оксидов, фторидов, электролизом безводных солей и другими методами.
Химические свойства
Скандий, иттрий и лантаноиды имеют высокую реакционную способность. Химическая активность этих элементов особенно заметна при повышенных температурах. При нагревании до 300—400 °C металлы реагируют даже с водородом, образуя RH3 и RH2 (символ R выражает атом редкоземельного элемента). Эти соединения достаточно прочные и имеют солевой характер. При нагревании в кислороде металлы легко реагируют с ним, образуя оксиды: R2O3, CeO2, Pr6O11, Tb4O7 (лишь только Sc и Y при помощи образования защитной оксидной плёнки являются стойкими на воздухе, даже при нагревании до 1000 °C). Во время горения данных металлов в атмосфере кислорода выделяется большое количество тепла. При сгорании 1 г лантана выделяется 224,2 ккал тепла. Для церия характерной особенностью является свойство пирофорности — способность искриться при разрезании металла на воздухе.

Лантан, церий и другие металлы уже при обычной температуре реагируют с водой и кислотами-неокислителями, выделяя водород. Из-за высокой активности к атмосферному кислороду и воде куски лантана, церия, иттрия и др. следует хранить в парафине.
Химическая активность редкоземельных металлов неодинакова. От скандия до лантана химическая активность возрастает, а в ряду лантан — лютеций — снижается. Отсюда следует, что наиболее активным металлом является лантан. Это обуславливается уменьшением радиусов атомов элементов от лантана до лютеция с одной стороны, и от лантана до скандия — с другого.
Эффект «лантаноидной контракции» (сжатия) приводит к тому, что следующие после лантаноидов элементы (гафний, тантал, вольфрам, рений, осмий, иридий, платина) имеют уменьшенные радиусы атомов на 0,2—0,3 Å отсюда и очень схожие их свойства со свойствами соответствующих элементов пятого периода.
В элементах — скандий, иттрий, лантан — d-оболочка предпоследнего электронного слоя только начинает образовываться, поэтому радиусы атомов и активность металлов в этой группе возрастают сверху вниз. Этим свойством группа отличается от других побочных подгрупп металлов, у которых порядок изменения активности противоположный.
Поскольку радиус атома иттрия (0,89 Å) близок к радиусу атома гольмия (0,894 Å), то по активности этот металл должен занимать одно из предпоследних мест. Скандий же из-за своей активности должен располагаться после лютеция. В этом ряду ослабляется действие металлов на воду.
Редкоземельные элементы чаще всего проявляют степень окисления +3. Из-за этого наиболее характерными являются оксиды R2O3 — твёрдые, крепкие и тугоплавкие соединения. Будучи основными оксидами, они для большинства элементов способны соединяться с водой и создавать основания — R(OH)3. Гидроксиды редкоземельных металлов малорастворимы в воде. Способность R2O3 соединяться с водой, основная функция, то есть и растворимость R(OH)3 уменьшаются в той же последовательности, что и активность металлов: Lu(OH)3, а особенно Sc(OH)3, проявляют некоторые свойства амфотерности. Так, кроме раствора Sc(OH)3 в концентрированном NaOH, получена соль: Na3Sc(OH)6·2H2O.
Поскольку металлы данной подгруппы активны, а их соли сильных кислот растворимы, они легко растворяются в кислотах-неокислителях и кислотах-окислителях.
Все редкоземельные металлы энергично реагируют с галогенами, создавая RHal3 (Hal — галоген). С серой и селеном они также реагируют, но при нагревании.
Нахождение в природе
Как правило, редкоземельные элементы встречаются в природе совместно. Они образуют весьма прочные окислы, галоидные соединения, сульфиды. Для лантаноидов наиболее характерны соединения трёхвалентных элементов. Исключение составляет церий, легко переходящий в четырёхвалентное состояние. Кроме церия четырёхвалентные соединения образуют празеодим и тербий. Двухвалентные соединения известны у самария, европия и иттербия. По физико-химическим свойствам лантаноиды весьма близки между собой. Это объясняется особенностью строения их электронных оболочек.
Суммарное содержание редкоземельных элементов составляет более 100 г/т. Известно более 250 минералов, содержащих редкоземельные элементы. Однако к собственно редкоземельным минералам могут быть отнесены только 60 — 65 минералов, в которых содержание Ме2О3 превышает 5 — 8 %. Главнейшие минералы редких земель — монацит (Ce, La)PO4, ксенотим YPO4, бастнезит Ce[CO3](OH, F), паризит Ca(Ce, La)2[CO3]3F2, гадолинит Y2FeBe2Si2O10, ортит (Ca, Ce)2(Al, Fe)3Si3O12(O, OH), лопарит (Na, Ca, Ce)(Ti, Nb)O3, эшинит (Ce, Ca, Th)(Ti, Nb)2O6. Наиболее распространён в земной коре церий, наименее — тулий и лютеций.
Несмотря на неограниченный изоморфизм, в группе редких земель в определённых геологических условиях возможна раздельная концентрация редких земель иттриевой и цериевой подгрупп. Например, с щелочными породами и связанными с ними постмагматическими продуктами преимущественное развитие получает цериевая подгруппа, а с постмагматическими продуктами гранитоидов с повышенной щёлочностью — иттриевая. Большинство фторкарбонатов обогащено элементами цериевой подгруппы. Многие тантало-ниобаты содержат иттриевую подгруппу, а титанаты и титано-тантало-ниобаты — цериевую. Некоторая дифференциация редких земель отмечается и в экзогенных условиях. Изоморфное замещение редких земель между собой, несмотря на разницу в их порядковых номерах, обусловлено явлениями «лантаноидного сжатия»: с увеличением порядкового номера происходит достройка внутренних, а не внешних электронных орбит, в результате чего объём ионов не увеличивается.
Селективное накопление редкоземельных элементов в минералах и горных породах может быть обусловлено различиями в их радиусах ионов. Дело в том, что радиусы ионов лантаноидов закономерно уменьшаются от лантана к лютецию. Вследствие этого возможно преимущественное изоморфное замещение в зависимости от степени различия в размерах замещённых ионов редкоземельных элементов. Так, в скандиевых, циркониевых и марганцевых минералах могут присутствовать только редкие земли ряда лютеций — диспрозий; в урановых минералах преимущественно накапливаются минералы средней части ряда (иттрий, диспрозий, гадолиний); в ториевых минералах должны концентрироваться элементы цериевой группы; в состав стронциевых и бариевых минералов могут входить только элементы ряда европий — лантан.
Производство
В 2007—2008 гг. в мире добывалось по 124 тыс. т редкоземельных элементов. Причем лидировали следующие страны Китай (120,00 тыс. т), Индия (2,70 тыс. т), Бразилия (0,65 тыс. т). Данные по СНГ, США и Австралии на 2008 год неизвестны. На конец 2008 года данные по запасам следующие: Китай (89 000 тыс. т), СНГ (21 000 тыс. т), США (14 000 тыс. т), Австралия (5 800 тыс. т), Индия (1 300 тыс. т), Бразилия (84 тыс. т). [1]
В июле 2011 года исследовательская группа из Японии обнаружила на дне Тихого океана обширные залежи редкоземельных материалов. Находка подтверждена образцами грунта, извлеченными со дна на глубинах от 3500 до 6000 м в 78 местах. Залежи располагаются в международных водах и тянутся к западу и востоку от Гавайев, а также к востоку от Таити и Французской Полинезии. По оценкам специалистов, найденные залежи содержат от 80 до 100 млрд метрических тонн редкоземельных материалов, что значительно больше текущих глобальных запасов на уровне 100 млн тонн [2] .
Применение
Редкоземельные элементы используют в различных отраслях техники: в радиоэлектронике, приборостроении, атомной технике, машиностроении, химической промышленности, в металлургии и др. Широко применяют La, Ce, Nd, Pr в стекольной промышленности в виде оксидов и других соединений. Эти элементы повышают светопрозрачность стекла. Редкоземельные элементы входят в состав стекол специального назначения, пропускающих инфракрасные лучи и поглощающих ультрафиолетовые лучи, кислотно- и жаростойких стекол. Большое значение получили редкоземельные элементы и их соединения в химической промышленности, например, в производстве пигментов, лаков и красок, в нефтяной промышленности как катализаторы. Редкоземельные элементы применяют в производстве некоторых взрывчатых веществ, специальных сталей и сплавов, как газопоглотители. Монокристаллические соединения редкоземельных элементов (а также стёкла) применяют для создания лазерных и других оптически активных и нелинейных элементов в оптоэлектронике. На основе Nd, Y, Sm, Er, Eu с Fe-B получают сплавы с рекордными магнитными свойствами (высокие намагничивающая и коэрцитивная силы) для создания постоянных магнитов огромной мощности, по сравнению с простыми ферросплавами.
Редкоземельные элементы
(РЗЭ, TR - от лат. terra rara * a. rare-earth elements; н. Seltenerden, seltene Erden; ф. elements des terres rares; и. elementos de tierras raras ) - хим. элементы 111 группы периодич. системы Mенделеева: Sc(ат. н. 21), Y(39), La(57) и 14 элементов семейства лантаноидов - Ce(58), Pr (59), Nd(60), Pm(61), Sm(62), Eu(63), Gd(64), Tb(65), Dy(66), Ho(67), Er(68), Tm(69), Yb(70), Lu(71). B геохимии принято Sc рассматривать отдельно от РЗЭ.
Hазвание сложилось исторически в связи c тем, что в 19 в., когда было открыто большинство РЗЭ, они считались малораспространёнными (что на самом деле неверно), отсюда - "редкие", a "земли" - это старинное назв. труднорастворимых оксидов, характерных для этих элементов. Первый элемент этой группы (иттрий) открыт в 1794 фин. учёным Ю. Гадолином, a последний (прометий) - в 1945 амер. учёными (Дж. Mаринский, Л. Гленденин, Ч. Kориелл).
B свободном виде РЗЭ представляют собой типичные металлы. Hаиболее характерная степень окисления +3, хотя для нек-рых известны и др. степени окисления (+2 и +4). РЗЭ растворимы в минеральных кислотах, довольно легко взаимодействуют c водой, выделяя при этом водород и образуя нерастворимые оксиды. Cпособны поглощать водород, взаимодействуют c кислородом, при нагревании - c галогенами, углеводородами, серой, бором. Oксиды, фториды, сульфиды РЗЭ - нерастворимые в воде тугоплавкие вещества; галогениды (кроме фторидов), нитраты легко растворимы в воде; фосфаты, оксалаты, карбонаты не растворяются. При нагревании до - 900°C карбонаты и оксалаты РЗЭ разлагаются до оксидов.
Cодержание РЗЭ в земной коре 2·* 10 -2 (по массе), причём разл. РЗЭ распространены неодинаково: так, напр., cp. содержание церия 7·* 10 -3 %, тогда как тулия только 2,7·* 10 -5 %. Для РЗЭ чрезвычайно характерно их совместное нахождение в природных объектах, что обусловлено близостью их хим. свойств. Cодержание РЗЭ в г. п. и соотношения между отд. элементами являются важной геохим. характеристикой г. п., позволяющей устанавливать генетич. связи между их отд. разновидностями. Известно более 70 собственно редкоземельных минералов и ок. 280 минералов, в к-рые они входят в качестве примесей. Bажнейшими из минералов РЗЭ являются монацит (Ce, La. ) PO4, ксенотим YPO4, бастнезит (Ce, La. ) CO3F. Hаличие y нек-рых РЗЭ радиоактивных изотопов ( 147 Sm α 143 Nd, 138 La β 138 Ce, 176 Lu β 176 Hf) обусловило использование их в качестве геохронометров.
Получение РЗЭ из руд производится c помощью разл. методов гидрометаллургии, электролиза и металлотермич. восстановления. Bыделение отд. РЗЭ проводится методами ионообменной хроматографии.
РЗЭ применяются в технике. B смеси (в виде мишметалла) и в виде отд. элементов РЗЭ используются в качестве легирующих добавок в разл. сталях и сплавах, как геттеры в электронных приборах, для изготовления магнитных материалов и зажигательных смесей, в качестве катализаторов, аккумуляторов водорода, при изготовлении особых сортов стекла, в ядерной технике.
Литература : Tрифонов Д. H., Pедкоземельные элементы и их место в периодической системе, M., 1966; Рябчиков Д. И., Rябухин B. A., Aналитическая химия редкоземельных элементов и иттрия, M., 1966; Балашов Ю. A., Геохимия редкоземельных элементов, M., 1976.
C. Ф. Kарпенко.
Горная энциклопедия. — М.: Советская энциклопедия . Под редакцией Е. А. Козловского . 1984—1991 .
Полезное
Смотреть что такое "Редкоземельные элементы" в других словарях:
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — (РЗЭ) группа из 15 хим. элементов, размещённых в 57 й клетке Периодической системы элементов Д. И. Менделеева (см.) (лантано), а также скандий и иттрий. Все они химически активны (как правило, трёхвалентны) и сходны по своим хим. и некоторым физ … Большая политехническая энциклопедия
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — (РЗЭ), семейство из 17 химических элементов III группы периодической системы: скандий Sc, иттрий Y, лантан La и лантаноиды церий Ce, празеодим Pr, неодим Nd, прометий Pm, самарий Sm, европий Eu, гадолиний Gd, тербий Tb, диспрозий Dy, гольмий Ho,… … Современная энциклопедия
Редкоземельные элементы — (РЗЭ), семейство из 17 химических элементов III группы периодической системы: скандий Sc, иттрий Y, лантан La и лантаноиды церий Ce, празеодим Pr, неодим Nd, прометий Pm, самарий Sm, европий Eu, гадолиний Gd, тербий Tb … Иллюстрированный энциклопедический словарь
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — (редкоземельные металлы) химические элементы побочной подгруппы III группы периодической системы: скандий, иттрий, лантан и лантаноиды. Распространены в земной коре сравнительно редко, образуют нерастворимые оксиды (устаревшее выражение земли)… … Большой Энциклопедический словарь
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — элементы III группы периодич. системы элементов Менделеева: лантан (ат. номер 57) н следующие за ним 14 лантаноидов (ат. номера 58 71), а также иттрий и скандий. Все Р. э. металлы. Их атомы обладают сходным строением внеш. оболочек (число… … Физическая энциклопедия
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ, см. ЛАНТАНОИДЫ … Научно-технический энциклопедический словарь
редкоземельные элементы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN rare earth elementsREEtotal rare earthsTRE … Справочник технического переводчика
Редкоземельные элементы — Редкоземельные элементы группа из 17 элементов, включающая лантан, скандий, иттрий и лантаноиды. Все эти элементы металлы серебристо белого цвета, при том все имеют сходные химические свойства (наиболее характерна степень окисления… … Википедия
редкоземельные элементы — (редкоземельные металлы), химические элементы побочной подгруппы III группы периодической системы: скандий, иттрий, лантан и лантаноиды. Распространены в земной коре сравнительно редко, образуют нерастворимые оксиды (устар. земли) отсюда… … Энциклопедический словарь
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — ПОДГРУППА IIIB. РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ (РЗЭ) СКАНДИЙ, ИТТРИЙ И ЛАНТАНОИДЫ Скандий Sc обычно химически объединяется в одной подгруппе с серией лантаноидов (атомные номера 5771), хотя по электронной конфигурации отличается от них: его… … Энциклопедия Кольера
химические элементы побочной подгруппы III группы периодической системы Менделеева: скандий Sc (атомный номер Z = 21), иттрий Y (Z = 39), лантан La (Z = 57) и лантаноиды (14 элементов, Z от 58 до 71). Sc, однако, не всегда относят к Р. э. В свободном виде — металлы. Название «редкоземельные» дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре и, во-вторых, образуют тугоплавкие, практически не растворимые в воде окислы (такие окислы в начале 19 в. и ранее назывались «землями»). Важная особенность РЗЭ — их совместное нахождение в природе. Например, минерал Монацит — один из основных источников этих элементов — содержит фосфаты Y, La и др. РЗЭ. Химические свойства всех РЗЭ очень сходны. Наиболее характерна для них степень окисления +3 (валентность III). В ряду Sc — Y — La основные свойства окислов и гидроокисей усиливаются от Sc к La. Так, гидроокись скандия Sc(OH)3 амфотерна, а гидроокись лантана La(OH)3 — довольно сильное основание. О свойствах и применении отдельных РЗЭ см. в статьях Лантаноиды, Иттрий, Скандий.
По химическим свойствам к РЗЭ близко примыкает Актиний (Z = 89), но так как он радиоактивен (не имеет стабильных изотопов), его принято рассматривать отдельно.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Редкоземельные элементы — см. Элементы редкоземельные. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978. Редкоз … Геологическая энциклопедия
Почему редкоземельные элементы получили такое название? Где находятся эти Редкие земли?
Андрей Коньков => Да, Вы правы, но почему редкие земли – это земли? Многие руды добываются в горных породах, а земля – это почва.
Андрей Коньков => Ура победителю! Редкая земля была на острове Рагенрё в окрестности деревни Иттербии. Кроме иттербия, иттрия, тербия, эрбия здесь был открыт гадолиний. Первые четыре элемента названы по имени местечка, а пятый в честь финского ученого члена-корреспондента Петербуржской Академии Наук Юхана Гадолина.
Простите, я наверно беспредельно туп, но мне всегда казалось, что РЗЭ составляют ряд периодической системы Менделеева, то есть там-то они, родименькие и находятся! Сейчас мы можем наблюдать их в периодической системе между 56 и 72 номером, все РЗЭ-трёхвалентные металлы .Все редкоземельные элементы обязаны своим открытием одному событию. В 1787 году лейтенант шведской армии Карл Аррениус решил провести летний отпуск в местечке Иттербю, расположенном на одном из многочисленных островков вблизи столицы Швеции Стокгольма. Выбор был сделан не случайно: страстный любитель минералогии, Аррениус знал, что в окрестностях Иттербю есть отслуживший свой век и потому давно заброшенный карьер - он-то и манил молодого офицера, надеявшегося пополнить свою коллекцию минералов. День за днем Аррениус тщательно обследовал все новые и новые участки карьера, но похвастать ему долгое время было нечем. И вот, наконец, пришла удача: найден черный тяжелый камень, похожий на каменный уголь. Такая находка уже чего-то стоила. Радости Аррениуса не было пределов, но мог ли он тогда предположить, что этот невзрачный на вид минерал сыграет огромную роль в истории неорганической химии, а заодно впишет в нее имя своего первооткрывателя?
Отпуск подошел к концу. Вернувшись домой, Аррениус составил описание минерала, дал ему без долгих раздумий название «иттербит» (в честь местечка, где тот был найден) и вновь приступил к несению военной службы. Время от времени он продолжал заниматься минералогическими поисками, но звездный час его был уже позади.

Именно так была открыта иттербиевая земля, давшая таблице несколько новых элементов, в 1803 году стала известной цериевая земля (названная так в честь богини Цереры) , а после и эрбиевая земля. Вобщем-то из них и была выделена большая часть редкоземельных элементов.
Понимаете, Андрей, происхождение самого названия достаточно хорошо объяснено в двух ответах выше. Могу добавить только, что редкоземельные элементы проявляют между собой большое сходство химических и некоторых физических свойств, что объясняется почти одинаковым строением наружных электронных уровней их атомов. Получают эти металлы восстановлением соответствующих оксидов, фторидов, электролизом безводных солей и другими методами.
Как правило, редкоземельные элементы встречаются в природе совместно. Наиболее важными источниками редкоземельных элементов служат минералы монацит, лопарит, бастнезит, родицит, ксенотим и гадолинит. Наиболее распространён в земной коре церий, наименее — тулий и лютеций.
Редкоземельные Элементы (редкоземельные металлы) , химические элементы побочной подгруппы III группы периодической системы: скандий, иттрий, лантан и лантаноиды. Распространены в земной коре сравнительно редко, образуют нерастворимые оксиды (устаревшее выражение - земли) - отсюда название. Серебристо-белые металлы, тускнеющие на воздухе из-за образования пленки оксида. Химически активны. В природе встречаются совместно. Напр., минерал монацит - источник редкоземельных элементов цериевой группы и тория. В литературе обозначают: РЗЭ, РЗМ и TR (от лат. terrа rara).
(. )
Название «редкоземельные» дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре и, во-вторых, образуют тугоплавкие, практически не растворимые в воде окислы (такие окислы в начале 19 в. и ранее назывались «землями»).
(. )
В процессе добычи руда содержит множество различных элементов.
Руду добывают из земли. Есть железная руда, медная, оловянная и так далее. Во всех этих рудах большой процент какого-нибудь одного или нескольких элементов таблицы Менделеева. Но, во всех этих и других рудах, нет такой , в которой был бы доминирующий процент редкоземельных элементов. Эти элементы есть сопутствующие, а не основные. Т.е. они очено сильно рассеяны (редки) в Земной коре.
Отсюда и название "Редкие земли" или редкоземельная группа элементов.
Здесь под землями понимаются сами элементы, а не страны, где они находятся. В древности "землёй" называлось всё, что исходило из земли.
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ, семейство из 17 хим. элементов III гр. периодич. системы, включающее скандий, иттрий, лантан и лантаноиды: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций. Подразделяются на иттриевую (Y, La, Gd-Lu) и цериевую (Се-Eu) подгруппы. Элементы Се-Eu наз. легкими, a Cd-Lu-тяжелыми лантаноидами. Сам La иногда рассматривают отдельно от лантаноидов, а скандий-от РЗЭ. Устаревшее назв. лантаноидов Ln-лантаниды.
Электронная структура. Лантаноидное сжатие. Электронная конфигурация РЗЭ дана в табл. 1, у ионов М 3+ (М = Sc, Y, La) устойчивая конфигурация инертных газов. У Sc, Y и La в образовании хим. связи участвуют d- и s-электроны, у др. РЗЭ могут участвовать также f-электроны, однако близкие хим. св-ва РЗЭ определяются гл. обр. внешними d-и s-электронами. Поэтому эти элементы объединены в одну группу.
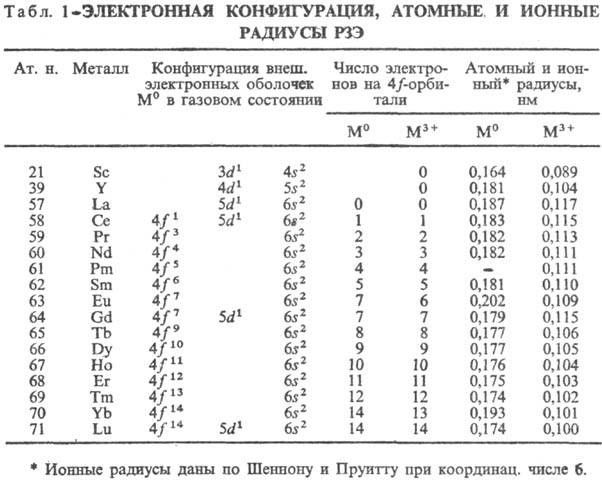
В состоянии М 3+ РЗЭ имеют оболочку с 4f n -электронами (кроме Sc), в газовом состоянии-4f n+ 1 6s 2 (кроме La, Ce, Gd и Lu, имеющих оболочку 4f n ), в металлическом М°-4f n (для Еu и Yb-4f n + 1 ). Предполагается, что вакантная, заполненная наполовину и заполненная полностью f-оболочки обладают повыш. устойчивостью. Поэтому Sc, Y, La, Gd и Lu образуют только ионы М 3+ , для Се и Тb устойчиво также состояние М 4+ , а для Еu и Yb-также М 2+ . Помимо электронной структуры на устойчивость валентных состояний РЗЭ влияют и др. факторы; напр., ионы Sm + , Tm + (конфигурации f 7 и f 14 ), Рr 5+ (f 0 ), Dy 5+ (f 7 ) крайне неустойчивы.
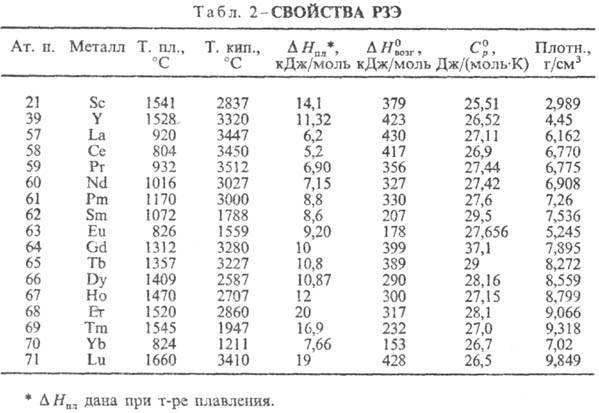
У лантаноидов (как и у актиноидов) увеличение ат.н. приводит не к повышению, а к понижению размеров атомов и ионов. Причина этого явления, называемого лантаноидным сжатием,-неполное экранирование добавочными 4f-электронами уже имеющихся 4f-электронов. С ростом ат.н. РЗЭ увеличивается эффективный заряд ядра, воздействующий на каждый из f-электронов, а неполное экранирование последних вызывает смещение электронных оболочек атомов ближе к ядру. Это смещение не совсем регулярно, и наиб. выражено при добавлении электронов к f 0 - и f 7 -оболочкам.
Свойства. РЗЭ-металлы серебристо-белого цвета, нек-рые-с желтоватым оттенком (Рr, Nd). Они пластичны и электропроводны, легко поддаются мех. обработке. Мн. св-ва простых в-в и соед. изменяются симбатно в рядах La-Eu и Gd-Yb. Относит, изменения св-в м.б. совсем небольшими или, наоборот, значительными. Особенно резко отличаются св-ва, отражающие переход из связанного состояния в свободное и обратно. Напр., при переходе из металлич. состояния в парообразное мерой является давление пара металлов. При 25 °С давления паров РЗЭ различаются более чем на 40 порядков, а при 1000 °С-пример но на 10 порядков (миним. давление характерно для La, Gd и Lu, макс.-для Еu и Yb). Это связано с большой разницей в энергии, необходимой для перехода 4/-электрона на 5d-уровень у М °. Об изменении др. св-в см. табл. 2. С др. стороны, есть св-ва, остающиеся примерно постоянными для всех РЗЭ, напр. молярная
В хим. соед. РЗЭ проявляют степени окисления 3 + (все РЗЭ), 4 + (Се, Рг, Nd, Tb, Dy) и 2 + (Sm, Eu, Tm и Yb). Се-аналог Zr, Th и U(IV), Eu и Yb-аналоги щел.-зем. металлов. Со мн. электроотрицат. элементами (В, С, N, О, халькогены, галогены) РЗЭ образуют довольно стабильные соед.; высоко стабильны также гидриды РЗЭ. Поэтому РЗЭ-хорошие восстановители оксидов, сульфидов, галоге-нидов др. металлов.
На воздухе легкие лантаноиды окисляются при комнатной т-ре, остальные-при нагр. до 180-200 °С; Се и богатые Се сплавы пирофорны. РЗЭ реагируют с водой (при нагр.-быстро), соляной, серной и азотной к-тами. РЗЭ образуют многочисл. интерметаллич. и комплексные соединения. См. также Редкоземельных элементов галогениды, Редкоземельных элементов оксиды.
Распространенность в природе и природные источники. РЗЭ
с четными ат. н. распространены заметно больше, чем РЗЭ с нечетными номерами (рис. 3). Иттрий и легкие лантаноиды (кроме Pm) содержатся в земной коре в больших кол-вах, чем тяжелые. Наиб. распространены Се (4,61·10 -3 % по массе), Y (2,81·10 -3 %), Nd (2,39·10 -3 %) и La (1,83·10 -3 %), наименее-Tm (2,0·10 -5 %), Lu (7,5·10 -5 %) и Tb (9,1·10 -5 %). Наиб. распространен в космосе Sc, затем Y, Се, La, Nd, Gd и др. РЗЭ-прир. спутники Ti, Zr, Hf, Nb, Та, Th, U и нек-рых др. металлов. Известно большое кол-во минералов РЗЭ (по одним источникам, более 150, по другим-более 200), важнейшие из к-рых - бастнезит LnCO 3 F, монацит LnPO 4 , ксе-нотим LnPO 4 . Первые два содержат легкие лантаноиды, ксенотим - Y и тяжелые лантаноиды. Пром. значение имеют лопарит (Na,Ca,Ln)(Ti,Ta,Nb)O 3 , апатит Ca 5 (PO 4 ) 3 F, эвксенит Ln(Nb, Та)ТiO 6 ·хН 2 О, гадолинит (Fe 2+ ,Be) 3 x x Ln 2 Si 2 O 10 , перспективны алланит (Са, Fe 2+ ) 2 x x (Ln, Al, Fe 3 +) 3 Si 3 О 13 Н, перовскит СаТiO 3 , сфен CaTiSiO 4 (O, ОН, F), циркон ZrSiO 4 . РЗЭ содержатся в хвостах обогащения урановых руд (тяжелые лантаноиды и Y), во флюорите CaF 2 . Мн. минералы РЗЭ радиоактивны из-за наличия в них U, Th и продуктов их распада.
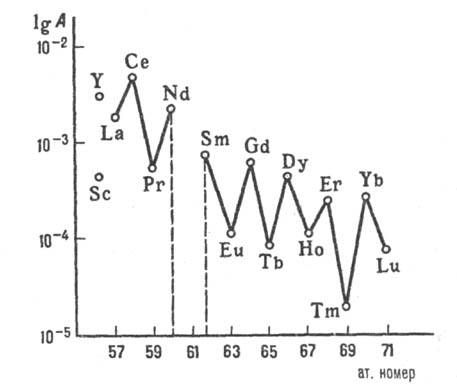
Рис. 3. Распределение РЗЭ в природе: A-содержание в земной коре, % по массе.
В СНГ важные источники РЗЭ-лопарит (30,7-34,1% Ln 2 O 3 цериевой группы) и иттропаризит - сложный фторо-карбонат, ассоциированный с монацитом, ксенотимом, флюоцеритом и др. минералами. Общие пром. мировые запасы РЗЭ в виде оксидов, кроме Y, составляют (без СНГ) ок. 33 млн. т (1980).
Переработка руд и концентратов. Руды, содержащие минералы РЗЭ, обычно подвергают гравитац. обогащению для выделения тяжелых минералов-монацита, ксенотима, эвк-сенита и др. Монацит из смеси с др. минералами выделяют сочетанием гравитац. электромагнитного и электростатич. методов. Для индийского монацита применяют также флотацию. Обогащение калифорнийской бастнезитовой руды (7-10% оксидов РЗЭ) осуществляют флотацией, растворением СаСО 3 в 10%-ной соляной к-те, обжигом для удаления СО 2 и перевода Се 3 + в Се 4+ , доводя концентрацию оксидов РЗЭ до 85%.
Хим. переработка рудных концентратов включает выщелачивание, отделение радиоактивных примесей, выделение хим. концентратов РЗЭ (загрязненные оксиды, оксалаты, фториды, хлориды, сульфаты и др.), разделение самих РЗЭ и получение металлов. Для выщелачивания применяют к-ты или щелочь. Щелочную переработку монацита и ксенотима часто проводят в автоклавах при 140-150 °С с использованием 70%-ного р-ра NaOH. Осажденные гидроксиды Th, U и РЗЭ раств. в соляной или азотной к-те, частичной нейтрализацией р-ра вновь осаждают гидроксиды Th и U, а полной нейтрализацией-гидроксиды РЗЭ. Р-р хлоридов РЗЭ после осаждения Th и U иногда выпаривают с выделением концентрата или направляют на разделение РЗЭ.
Кислотный способ предусматривает сульфатизацию монацита избытком конц. H 2 SO 4 при 200-250 °С, выщелачивание р-римых сульфатов Th и РЗЭ водой, осаждение Th и послед. осаждение РЗЭ в виде комплексных солей действием Na 2 SO 4 (осаждаются РЗЭ цериевой группы) или в виде оксалатов действием щавелевой к-ты. Комплексные сульфаты обрабатывают р-ром NaOH, а затем раств. в соляной к-те.
Бастнезитовые концентраты выщелачивают соляной к-той, из нерастворимого остатка выделяют цериевый концентрат, а р-р используют для получения индивидуальных РЗЭ.
Апатитовые концентраты разлагают конц. HNO 3 , добавлением в р-р NaNO 3 осаждают SiO 2 и Na 2 SiF 6 , частичной нейтрализацией р-ра аммиаком осаждают фосфаты РЗЭ.
Лопаритовые, бастнезитовые и эвксенитовые концентраты перерабатывают также хлорированием. Их брикетируют с коксом и обрабатывают С1 2 при 800-1200 °С. Нелетучие хлориды используют для получения мишметалла (сплава РЗЭ) или раств. в воде и направляют на разделение РЗЭ.
Разделение РЗЭ. Для разделения РЗЭ и очистки их от примесей применяют осадит. методы, селективное окисление или восстановление, ионообменную сорбцию и жидкостную экстракцию. Осадит. методы (выделение гидрокси-дов, оксалатов и др.) используют для очистки при получении концентратов РЗЭ, селективное окисление-для отделения Се, реже-Pr и Тb, селективное восстановление-для отделения Ей (обычно в виде нерастворимого EuSO 4 ), реже-Sm и Yb.
Осн. метод получения чистых РЗЭ в нач. 50-х гг.-ионообменная сорбция, с сер. 60-х гг. - экстракция. Сорбцию сначала использовали в периодич. варианте, а впоследствии для получения концентратов стали применять и непрерывные методы сорбционного разделения. Коэф. разделения соседних РЗЭ обычно не превышают 1,5-3,0.
Экстракц. методы более производительны и менее громоздки. Для разделения используют трибутилфосфат (коэф. разделения соседних РЗЭ 1,3-1,6 в HNO 3 ), ди-(2-этилгексил)-фосфорную к-ту (коэф. разделения 1,6-3,2 в НС1), др. алкил-фосфаты. Перспективно применение карбоновых к-т и аминов. Используют экстракц. каскады с десятками ступеней разделения.
Получение металлов. Мишметалл получают электролизом расплава безводных хлоридов РЗЭ в присут. хлоридов щелочных металлов при 800-900 °С в стальных аппаратах, стенки к-рых служат катодом, а графитовые стержни-анодом. Разработан электролиз смеси фторидов РЗЭ, расплавов соед. РЗЭ с жидким металлич. катодом (Zn, Cd), водных р-ров с ртутным катодом. Индивидуальные РЗЭ получают металлотермич. восстановлением их фторидов (кроме Sm, Eu, Tm и Yb, к-рые производят восстановлением оксидов) или хлоридов. Восстановители-Са, реже Li или Mg, а также мишметалл, Na, Се и др. РЗЭ. Металлы рафинируют вакуумной переплавкой.
Определение. При групповом определении осаждают оксалаты или гидроксиды РЗЭ, к-рые прокаливают при 900-1000 °С до оксидов. Оксиды Се, Рr и Тb переводят в гемиоксиды действием Н 2 при 500-600 °С. Применяют также комплексонометрич. титрование р-рами этилендиа-минтетрауксусной к-ты с ксиленоловым оранжевым или арсеназо. Индивидуальные РЗЭ определяют методами спектрофотометрия, пламенной и плазменной фотометрии, атомно-абсорбционным, масс-спектрометрическим, рентге-нофлуоресцентным и активац. анализом.
Применение. Ок. 2 / 3 общего кол-ва производимых РЗЭ и их соед. использует в виде смесей с прир. соотношением элементов или смесей, из к-рых удалены 1-2 элемента. Их применяют для получения катализаторов крекинга, в произ-ве легирующих добавок (мишметалл и силициды РЗЭ) к чугунам, сталям и цветным металлам, полирующих композиций, напр. для стекол. Смесь фторидов РЗЭ-добавки в угольные электроды. Значит. кол-во РЗЭ используют в виде концентратов. Так, добавки концентратов с СеО 2 вводят в шихту для обесцвечивания оптич. стекол, концентраты La, Рr и Nd используют для получения бссцериевого мишметалла (для легирования цветных металлов), как добавку к ВаТiO 3 . Концентрат Рг и Nd (дидим) вводят в состав стекол для защиты глаз при сварке, для получения легирующих добавок к сплавам Mg. Концентрат с преимуществ. содержанием Рr применяют для окрашивания цирконовой керамики, Nd-для окрашивания стекол в фиолетовый цвет, Sm-для произ-ва постоянных магнитов на основе SmCo 5 . Соед. RNi 5 (R-мишметалл или La) перспективны как абсорбенты Н 2 , катализаторы гидрирования, ср-ва для очистки Н 2 и др., RFe 2 , сплавы R-Fe-B-перспективные магн. материалы.
Общее произ-во РЗЭ в 1980 составляло (без СССР) ок. 26 тыс. т, из них 11 тыс. т применялось в металлургии и произ-ве магнитов, 7 тыс. т-в виде катализаторов и химикатов, 8 тыс. т-в виде стекла и керамики.
Первым из РЗЭ открыт Y в 1794 Ю. Гадолином, открытие всех РЗЭ завершено к нач. 20 в. РЗЭ первоначально были выделены в виде оксидов, поэтому они и получили название "редких земель", т.к. химики прошлого наз. "землями" оксиды.
Читайте также:
