Щелочноземельные металлы щелочные металлы халькогены галогены
Обновлено: 20.09.2024
1. Расставьте коэффициенты в следующих
уравнениях реакций. Определите типы
реакций:
1. СаСО3 → СаО + CO2
2.
Na2SO4 + ВаСl2 →
NaСl + ВаSO4
3.
SO3 + H2O → H2SO4
4.
Cu(OH)2 + HNO3 → Cu(NO3)2 + H2O
5.
Fe(OH)3 → Fe2O3 + H2O
6.
Аl2(SO4)3 + NaOH → Na2SO4 + Аl(OH)3↓
3. Повторение
2.
Напишите
уравнения
реакций
по
названиям исходных веществ и продуктов
реакций. Определите типы реакций.
А) Сульфат магния + гидроксид натрия →
гидроксид магния + сульфат
натрия.
Б) Хлорид калия + нитрат серебра →
нитрат калия + хлорид серебра.
В) Железо + соляная кислота →
хлорид железа (II) + водород.
Г) Оксид меди + оксид азота (V) → нитрат
меди (II)
Д) Железо + сера → сульфид железа (II).
4. Первые попытки классификации химических элементов
До Первые
1200 г. нашей
эры человек
был знаком с
попытки
классификации
семью металлами:
химических
элементов
5. Но наука никогда не стоит на месте:
7. Химические свойства металлов и неметаллов
• Взаимодействие с водой:
А) типичные металлы образуют основные
оксиды, которым соответствуют основания:
CaO+H2O=Ca(OH)2
Б) типичные неметаллы образуют кислотные
оксиды, которым соответствуют кислоты:
SO3+H2O=H2SO4
8. Классификация на металлы и неметаллы является неполной, так как существуют амфотерные соединения, проявляющие и кислотные и
9. В середине XIX века химические элементы стали объединять в группы, получившие названия естественных семейств. Семейства – это
10. Естественные семейства химических элементов
Семейство
азота
Семейство
углерода
Щелочные
металлы
Щелочноземельные
металлы
Благородные
газы
Галогены
Халькогены
(семейство
кислорода)
11. Щелочные металлы
1. Элементы данного семейства: Li, Na, K, Rb, Cs, Fr
2. Особенности данного семейства:
А)При взаимодействии с водой образуют щёлочи.
2Na+2H2O=2NaOH+H2
2K+2H2O=2KOH+H2
Б)Имеют общую формулу гидроксидов ROH
В)Мягкие, быстро окисляются кислородом, поэтому
хранятся под слоем керосина,
Г)В соединениях одновалентны.
Д)Из всех металлов самые активные.
12. Щелочноземельные металлы
1. Элементы данного семейства:
Ca, Sr, Ba
2. Особенности данного семейства:
А) Металлы и оксиды этих Ме при взаимодействии с
водой образуют щёлочи.
Вa+2H2O=Вa(OH)2+H2
BaO+H2O=Ba(OH)2
Б)Все они в соединениях двухвалентные.
В)Образуют оксиды с общей формулой RO, которым
соответствуют гидроксиды с общей формулой R(OH)2.
13. Галогены
1. Элементы данного семейства: F, Cl, Br, I, At
2. Особенности данного семейства:
А)Образуют простые вещества, молекулы которых
состоят из 2х атомов: F2, Cl2, Br2, I2.
Б)Высшая валентность в соединениях с кислородом
YII (R2O7),кроме фтора
В)С водородом образуют летучие соединения, в
которых проявляют валентность I (RH), например:
НF.
Г)С металлами образуют соли: NaF
Д)Ядовиты!
Е) Из всех неметаллов самые активные.
14. Хальгогены
1. Элементы данного семейства: O, S, Se, Te
2. Особенности данного семейства:
А)Образуют кислотные оксиды с общей формулой
RO3, где проявляют валентность YI.
Б)Этим оксидам соответствуют кислоты состава
H2RO4.
В) Химические элементы S, Se, Te называют
халькогенами-«рождающие медные руды»
Г) С водородом образуют соединения состава H2R.
К 70-м годам XIX века было известно более 60 химических элементов.
Несмотря на очевидное наличие сходных элементов, найти единую систему,
которая включала бы известные в то время элементы не удавалось.
Различные варианты классификации химических элементов предполагали
многие ученые:
Джон Ньюлендс
1863г. закон
октав
Дёберейнер (1816)
Александр Шанкуртуа
1862г. - спираль
Лотар Мейер – таблица 1864г
Щелочноземельные металлы щелочные металлы халькогены галогены

Общая характеристика некоторых элементов
в связи с их положением в Периодической системе
Элемент ЕГЭ: 1.2.2. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа)… 1.2.4. Общая характеристика неметаллов IVA-VIIA групп…
1.2.2. Общая характеристика металлов IA-IIIA групп …
Все элементы IА–IIIА-групп Периодической системы относят к металлам (кроме бора). На внешнем энергетическом уровне эти элементы имеют не более трех электронов, что соответствует номеру группы, в которой они расположены.
Металлы IA-группы называют щелочными, так как при взаимодействии с водой они образуют щелочи. Металлы IIА-группы, за исключением бериллия и магния, называют щелочноземельными.
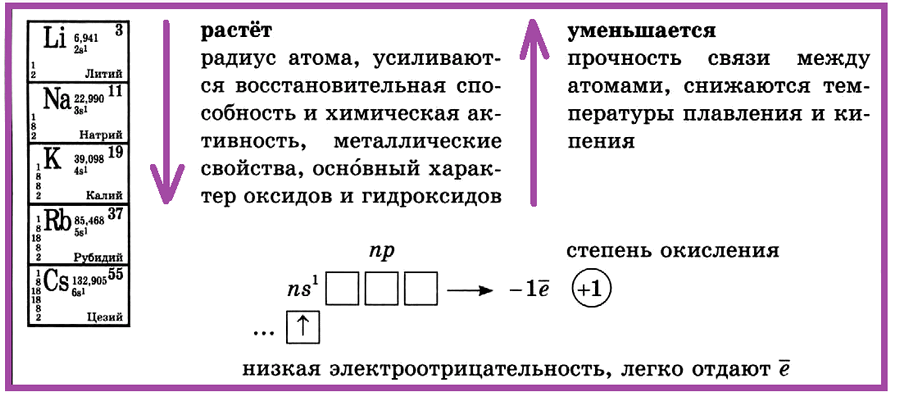
I группа, главная подгруппа —
щелочные металлы (литий, натрий, калий, рубидий, цезий).
I группа, главная подгруппа — щелочные металлы: литий, натрий, калий, рубидий, цезий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, основный характер оксидов и гидроксидов.
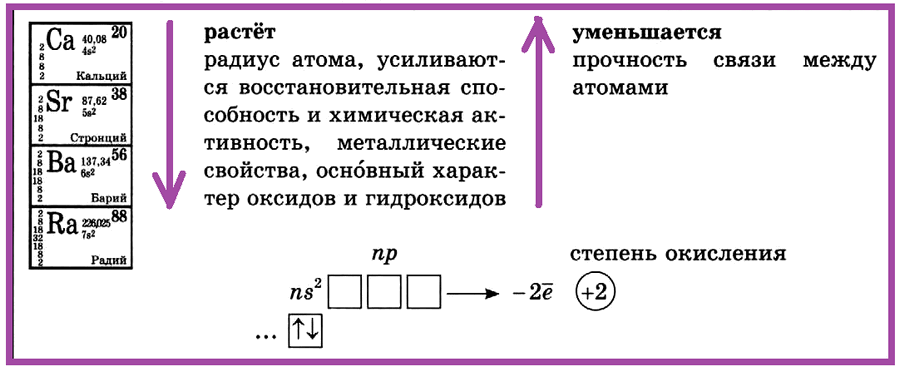
II группа, главная подгруппа —
щёлочноземельные металлы (кальций, стронций, барий, радий)
II группа, главная подгруппа — щёлочноземельные металлы: кальций, стронций, барий, радий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются восстановительная способность и химическая активность, металлические свойства, оснОвный характер оксидов и гидроксидов.
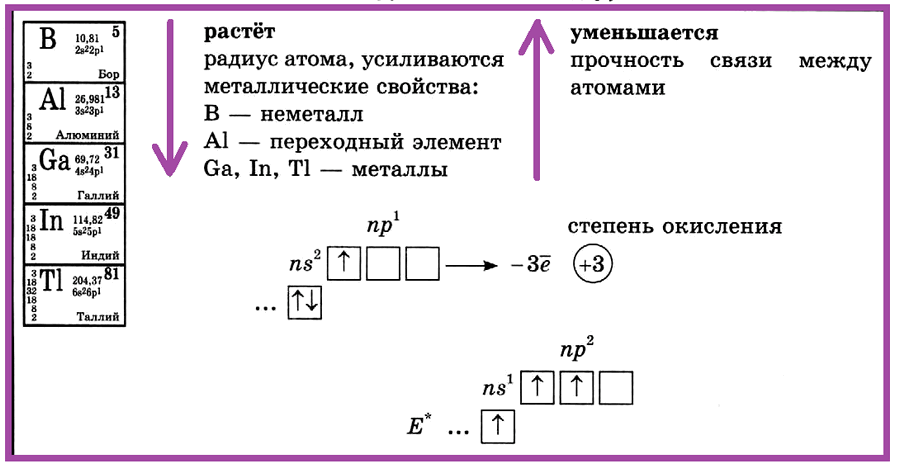
Элементы III группы главной подгруппы
(бор, алюминий, галлий, индий, таллий)
Элементы III группы главной подгруппы: бор, алюминий, галлий, индий, таллий. С увеличением порядкового номера в ПСХЭ растет радиус атома, усиливаются металлические свойства. В — неметалл, Аl — переходный элемент, Ga, In, Тl — металлы.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) …
Понятие переходный элемент относится к d-элементам, занимающим переходное положение между s- и p-элементами. Они расположены в побочных подгруппах (группах IБ-VIIIБ). Все d-элементы являются металлами, валентные электроны которых расположены на ns- и (n–1)d-подуровнях, т.е. они имеют электронную конфигурацию: (n–1)d 1–10 ns 1–2 .
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
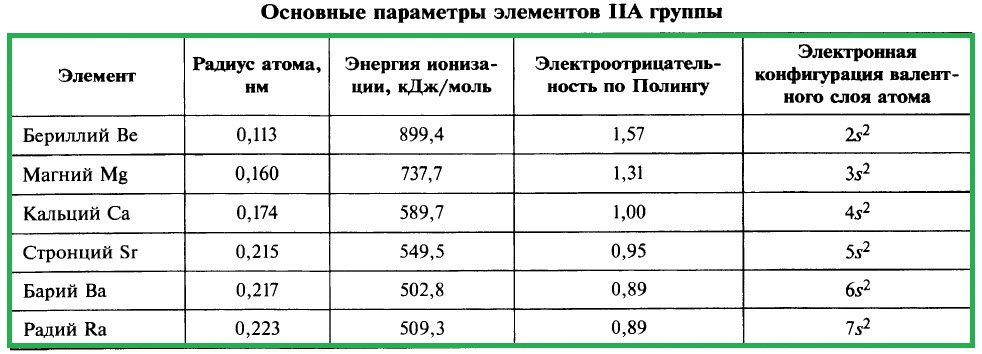
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:
как называються группы в системе Менделеева?
1) Щелочны́е мета́ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
2) Щёлочноземельные металлы — элементы главной подгруппы II группы Периодической системы химических элементов Д. И. Менделеева: кальций Ca, стронций Sr, барий Ba, радий Ra (иногда к щёлочноземельным металлам ошибочно относят также бериллий Be и магний Mg).
3) подгруппа бора - хим. элементы IIIa гр. периодич. системы
4) подгруппа углерода - хим. элементы IVa гр. периодич. системы
5) подгруппа германия (германий олово, свинец) - выделяют отдельно
6) подгруппа азота -хим. элементы VIa гр. периодич. системы
7) подгруппа мышьяка (мышьяк, сурьма, висмут) - выделяют отдельно
8) ХАЛЬКОГЕНЫ, хим. элементы VIa гр. периодич. системы: кислород О, сера S, селен Se, теллур Те, полоний Po.
9) галогены - хим. элементы VIIa гр. периодич. системы
10) инертные газы хим. элементы VIIIa гр. периодич. системы
11) подгруппа меди - хим. элементы Ib гр. периодич. системы
12) подгруппа цинка - хим. элементы IIb гр. периодич. системы
13) подгруппа скандия - хим. элементы IIIb гр. периодич. системы
14) подгруппа титана - хим. элементы IVb гр. периодич. системы (титан, цирконий, гафний)
15) подгруппа ванадия - хим. элементы Vb гр. периодич. системы (ванадий, ниобий и тантал)
16) подгуппа хрома - хим. элементы VIb гр. периодич. системы
17) Подгруппа марганца - металлы побочной подгруппы седьмой группы VIIb периодической системы Д. И. Менделеева (марганец Mn, техниций Tc, рений Re ).
18) семейство железа - хим. элементы IV периода VIIb гр. периодич. системы
19) Платиновые металлы, платиноиды, химические элементы второй и третьей триад VIIIb группы периодической системы Менделеева. К ним принадлежат:
рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (легкие Платиновые металлы, плотность ~12 г/см3);
осмий (Osmium) Os, иридий (Iridium) Ir, платина (Platinum) Pt (тяжелые Платиновые металлы, плотность ~22 г/см3).
19) актиноиды
20) лантаноиды
Щелочно-земельные (2 группа) , щелочные (1 группа) , галогены (7 группа) , насчёт остальных я не знаю, но вроде группа кислорода (6 группа) , группа азота (5 группа). =)
Щелочные металлы - 1 группа (1 старая) , щелочно-земельные - 2 группа (2 старая) , халькогены - 16 группа (6 старая) , галогены - 17 группа (7 старая) , благородные газы - 18 группа (8 старая) . Больше именных названий нет.
Щелочные металлы, Щёлочноземельные металлы, Лантаноиды, Актиноиды, Переходные металлы, Лёгкие металлы, Полуметаллы, Неметаллы, Галогены,
Инертные газы! Ведь таблица для химика - это шпаргалка!
1 столбик - щелочные
2 - щелочноземельные
3 - амфотерные
4, 5, 6 - неметаллы,
из них 6 - халькогены
7 - галогены
8 - инертные металлы
. но всё это относится к главной подгруппе.. .
актиноиды и лантаноиды - это по периодам. ГРУПП, а не подгрупп, 8! Не больше не меньше ( в учебнике химии ещё за 8 класс всё это написано) . И все они называются по ГЛАВНОЙ подгруппе.
Естественные семейства химических элементов
Определение
• Естественные семейства – элементы, особенно близкие
по свойствам их простых веществ.
• Естественные семейства делятся на:
IА группа – щелочные металлы (кроме водорода)
IIА группа – щелочноземельные металлы (кроме
бериллия, магния)
VIА группа – халькогены
VIIA группа – галогены
VIIIA группа – благородные газы
Физические свойства:
1. Мягкие (легко режутся ножом).
2. Легкие.
3. Пластичные.
4. Легкоплавкие.
5. Хорошо проводят электрический ток.
6. Обладают металлическим блеском.
Химические свойства:
1. Реагируют с водой
2K +2Н2О = 2КОН + Н2
Ме2О реагируют с водой
основной оксид
К2О + Н2О = 2КОН
2. Реагируют с кислородом
(образуются пероксиды,
исключение литий)
2Li + O2 = Li2O
2Na + O2 = Na2 O2
3. Реагируют с хлором
2Na + CL2 = 2NaCl
4. Реагируют с серой
2К + S = K2S
Химические свойства:
1. Реагируют с водой
Ca +2Н2О = Ca(ОН)2 + Н2
2. Реагируют с кислородом
2Ca + O2 = 2 CaO
3.Реагируют с хлором
Ca + Cl2 = CaCl2
4. Реагируют с серой
МеО – основной оксид
Ca+ S = CaS
реагирует с водой
СаО + Н2О = Са(ОН)2
Физические свойства:
F2 – желтоватый газ
Cl2 – желто-зеленый газ
Br2 - коричнево-бурая жидкость
I2 – темно-серые с характерным блеском,
пары фиолетового цвета
Химические свойства:
1. Реагируют с металлами
2Al + 3Br2 = 2AlBr3
2. Реагируют с водородом.
H2 + F2 = 2HF фтороводород
hv
H2 + Cl2 = 2HCl хлороводород
t
H2 + Br2 = 2HBr бромоводород
t
H2 + I2 = 2HI йодоводород
Водные растворы галогеноводородов – кислоты
Первые попытки
классификации
химических элементов
Металлы
(основные
оксиды
и основания)
Неметаллы
(кислотные
оксиды
и кислоты)
Барон Йёнс
Якоб Берце́лиус
(1779-1848)
Первые попытки
классификации
химических элементов
Металлы
(основные
оксиды
и основания)
Неметаллы
(кислотные
оксиды
и кислоты)
Переходные
элементы
Барон Йёнс
Якоб Берце́лиус
(1779-1848)
Амфотерность
– это свойство веществ проявлять кислотные
или основные свойства в зависимости от
природы второго реагента, принимающего
участие в реакции
Аналогично ведет себя
и оксид алюминия:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Амфотерные свойства проявляют:
Be
Zn
BeO
ZnO
Be(OH)2
Zn(OH)2
Cr
Pb
Sn
Fe
Cr2O3
PbO
SnO
Fe2O3
Cr(OH)3
Pb(OH)2
Sn(OH)2
Fe(OH)3
Все амфотерные гидроксиды
нерастворимы в воде:
ZnCl2 + 2KOH = Zn(OH)2↓ + 2KCl
BeSO4 + 2NaOH = Be(OH)2 + Na2SO4
Читайте также: