Щелочные и щелочноземельные металлы презентация
Обновлено: 05.10.2024
Перечислите известные вам щелочные
металлы.
Сколько электронов на внешнем
энергетическом уровне у атомов всех
щелочных металлов?
Восстановителями или окислителями
являются щелочные металлы.
Что имеют в виду говоря о металлических
свойствах элемента?
3. Из истории открытия элементов
19 ноября 1907 года в Лондоне на
заседании Королевского
химического общества сэр Хемфри
Деви объявил об открытии им новых
элементов –натрия и калия.
На протяжении 17 лет эти элементы
не находили применения, их
называли «элементами только для
химиков».
5. 3 января 1959 года
В небе появилась комета.
Необычная комета –
искусственная: из
летящей к Луне советской
космической ракеты было
выпущено облако паров
натрия. Пурпурное
свечение этих паров
позволило уточнить
траекторию первого
летательного аппарата,
прошедшего по маршруту
Земля-Луна.
Это было первое
космическое
применение натрия.
6. Физические свойства
Какое строение
характерно для
кристаллов
щелочных
металлов?
Как изменяются
температуры
кипения и
плавления?
Какой самый легкий
из щелочных
металлов?
7. Применение щелочных металлов
Производство
сверхлегких
сплавов
Очистка
инертных
газов
Гальванические
элементы для
космических
аппаратов
Теплоноситель
в ядерных
тото
реакторах
Li
K
Часы
Na
Rb
Cs
Электровакуумная
техника
В мощных
осветительных
лампах
Производство
органических
веществ
Фотоэлементы
8. Соединения щелочных металлов
В ветхом завете
упоминается некое
вещество «нетер». Это
вещество употребляли
как моющее средство.
Скорее всего оно
образовалось в соленых
египетских озерах с
известковыми берегами.
Об этом веществе, но
под названием «нитрон»
писали позже греческие
авторы –Аристотель,
Диоскорид.
Как вы думаете, о каком
веществе идет речь?
Вспомните названия
1.
2.
3.
4.
5.
6.
соединений
щелочных металлов
и составьте их
формулы:
Каустическая сода.
Кальцинированная
сода.
Пищевая сода.
Поваренная соль.
Калиевая селитра.
Поташ
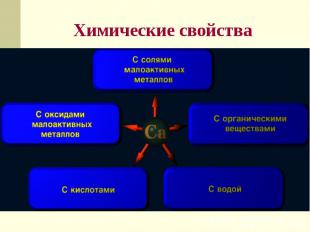
9. Химические свойства
Используя схему напишите уравнения
соответствующих реакций.
NaH
HCl
NaCl
NaNO3
Na
NaOH
Na2CO3
Na2O (Na2O2)
Cu(OH)2
NaHCO3
10. Щелочноземельные металлы-элементы IIA группы
Щелочноземельные металлыCa
элементы IIA группы
Щелочноземельными являются не все
элементы IIА группы, а только начиная с
кальция и вниз по группе.
Оксиды этих элементов («земли» - по Sr
старинной терминологии)
взаимодействуют с водой, образуя
щелочи.
Напишите уравнения реакции любого
из оксидов металлов с водой.
Ra
Ba
11. Окраска пламени соединениями щелочных и щелочноземельных металлов
Металл IА
группы
Окраска
пламени
Li
Карминовокрасная
Na
K
Желтая
Фиолетовая
Rb
Синеватокрасная
Cs
Синяя
Металл IIА
группы
Окраска
пламени
Ca
Оранжевокрасная
Sr
Карминовокрасная
Ba
Желтоватозеленая
12. Кальций –типичный представитель щелочноземельных металлов
Дайте названия
соединениям
кальция:
CaO
Ca(OH)2
CaCO3
CaHCO3
Вспомните
тривиальные
названия этих
веществ
Как изменяются
свойства элементов IIA
группы с увеличением
размера атомов и
образуемых ими ионов
при движении по
группе сверху вниз?
Какие свойства
проявляют оксиды и
гидроксиды этих
элементов.
13. Жесткость воды
Виды жесткости
воды
Присутствующие
ионы
Способы
устранения
жесткости воды
Временная
(карбонатная)
Ca(2+), Mg(2+)
HCO3(-)
1. Кипячение
2. Добавление
соды или Са(ОН)2
Постоянная
Ca(2+), Mg(2+)
SO4(2-)
1.Добавление соды.
2. Использование
катионообменников
Ca(2+), Mg(2+),
HCO3(-), Cl(-)
SO4(2-)
Сочетание всех
вышеуказанных
способов.
Общая
14. Химические свойства
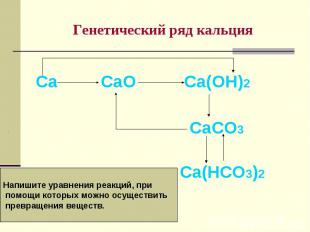
15. Генетический ряд кальция
Са
СаО
Са(ОН)2
СаСО3
Напишите уравнения реакций, при
помощи которых можно осуществить
превращения веществ.
Са(НСО3)2
16. Кальций в природе
Кальциевые горные
породы – известняк,
мрамор, мел.
Вспомните формулу
этих горных пород.
В чем их отличие?
17. Мел, известняк, мрамор не растворяются в чистой воде, но растворимы в кислых растворах, даже таких слабых, как природная вода.
При просачивании
воды с поверхности
земли через залежи
известняка происходят
процессы:
1.
Если порода залегает
под тонким слоем
почвы – образуются
провалы;
2.
Если породы
залегают на
большой
глубине –
возникают
подземные
карстовые
пещеры.
Как называются
отложения, свисающие
в виде гигантских
сосулек со свода
пещеры? А растущие
навстречу им со дна
пещеры колонны?
Какие химические
реакции при этом
происходят?
Известняк и мрамор используют в
архитектуре и скульптуре
При воздействии
кислотных дождей
строения разрушаются.
Какие реакции при этом
происходят?
Каково значение щелочных и
щелочно-земельных металлов в
жизни человека?
Как изменяются свойства оксидов и
гидроксидов в группах при
увеличении заряда ядра?
Какой из элементов калий
или цезий является более
сильным восстановителем?
Свойства Щелочноземельных металлов
презентация к уроку (химия, 9 класс) по теме
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Подписи к слайдам:
Положение в периодической таблице . В периодической системе находятся в главной подгруппе II группы. Являются сильными восстановителями, отдают 2 ē , во всех соединениях проявляют степень окисления +2. Общая конфигурация внешнего энергетического уровня nS ² Mg +12 2 ē , 8 ē , 2 ē Ca +20 2 ē , 8 ē , 8 ē , 2 ē Sr +38 2 ē , 8 ē , 18 ē , 8 ē , 2 ē Ba +56 2 ē , 8 ē , 18 ē , 18 ē , 8 ē , 2 ē
Положение в периодической таблице Be Mg Ca Sr Ba Ra Восстановительные свойства усиливаются
Строение атома +4 ) ) +12 ) ) ) +20 ) ) ) ) +38 ) ) ) ) ) +56 ) ) ) ) ) ) Ве Mg Ca Sr Ba 2 2 2 2 2
Физические свойства щелочноземельных металлов Щелочноземельные металлы – серебристо-белые, твёрдые вещества. По сравнению со щелочными металлами обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью. Бериллий ( Ве ) очень твердый материал и способен оставлять царапины на стекле; твердость других элементов подгруппы уменьшается, и барий по твердости близок к свинцу
Физические свойства щелочноземельных металлов. Величины Be Mg Ca Sr Ba Ra Ρ г/см 1,85 1,737 1,54 2,63 3,6 6 T пл. ° по С 1287 648 842 768 727 969
Физические свойства цвет пламени þ t плавления 1,74г/ см 3 651 С 0 1,54г/ см 3 851 С 0 2,63г/ см 3 770 С 0 3,76г/ см 3 710 С 0 Mg Ca Sr Ba
Нахождение в природе Бериллий: 3BeO • Al2O3 • 6SiO2 – берилл Магний : MgCO3 – магнезит Кальций: CaCO3 • MgCO3 – доломит KCl • MgSO4 • 3H2O – каинит KCl • MgCl2 • 6H2O – карналлит CaCO3 – кальцит (известняк, мрамор, мел.) Ca3(PO4)2 – апатит, фосфорит CaSO4 • 2H2O – гипс CaSO4 – ангидрит CaF2 – плавиковый шпат (флюорит) Стронций: SrSO4 – целестин SrCO3 – стронцианит Барий: BaSO4 – барит BaCO3 – витерит
Химические свойства С простыми веществами(неметаллами) 2Me 0 +O 2 → 2Me +2 O -2 - оксид Me 0 +H 2 → Me +2 H 2 - гидрид Me 0 +Cl 0 2 → Me +2 Cl 2 - хлорид Me 0 +S 0 → Me +2 S -2 - сульфид 2. Со сложными веществами Me 0 +2HCl → Me +2 Cl 2 + H 2 Me 0 +2HOH → Me +2 (OH) 2 + Н 2
Соединения щелочноземельных металлов Оксиды щелочноземельных металлов –МеО, имеют основный характер, легко реагируют с оксидами неметаллов с образованием соответствующих солей.
BaSO 4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
CaCO 3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы – мел, мрамор, известняк.
CaSO 4 ∙ 2H 2 O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
MgCO 3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы в шлак.
Са(ОН) 2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.
Презентация "Щелочные металлы"
презентация к уроку по химии (9 класс) по теме
Центр дистанционного образования детей-инвалидов при ОГАОУ «Белгородский инженерный юношеский лицей-интернат» ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнила: Быкова О.С., учитель химии
Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать понятие о физических и химических свойствах щелочных металлов.
Строение и свойства атомов
Щелочные металлы — это элементы главной подгруппы I группы : литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs , франций Fr.
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Щелочные металлы - простые вещества
Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Взаимодействие с неметаллами
Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na + O2 = Na2O2, калий, рубидий и цезий – надпероксид: K + O2 = KO2.
Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na + H2 = 2NaH, с серой – сульфиды: 2K + S = K2S, с фосфором – фосфиды: 3K + P = K3P, с кремнием – силициды: 4Cs + Si = Cs4Si, с углеродом карбиды образуют литий и натрий: 2Li + 2C = Li2C2
С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития: 6Li + N2 = 2Li3N. С галогенами все щелочные металлы образуют галогениды: 2Na + Cl2 = 2NaCl.
Взаимодействие с водой
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой. При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно. Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся. Взаимодействие с кислотами
Соединения щелочных металлов В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях , природных водах.
Гидроксид натрия NаОН в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали. Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами. Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твердые кристаллические вещества ионного строения. . Nа2СO3 — карбонат натрия , образует кристаллогидрат Nа2СO3* 10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3 , она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла. Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.
NаСl — хлорид натрия , или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту.
Презентация на тему: ЩЕЛОЧНЫЕ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
№ слайда 1
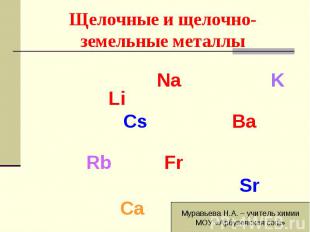
Na K Li Cs Ba Rb Fr Sr Ca

№ слайда 2
Перечислите известные вам щелочные металлы. Перечислите известные вам щелочные металлы. Сколько электронов на внешнем энергетическом уровне у атомов всех щелочных металлов? Восстановителями или окислителями являются щелочные металлы. Что имеют в виду говоря о металлических свойствах элемента?

№ слайда 3
19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр Хемфри Деви объявил об открытии им новых элементов –натрия и калия. 19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр Хемфри Деви объявил об открытии им новых элементов –натрия и калия. На протяжении 17 лет эти элементы не находили применения, их называли «элементами только для химиков».

№ слайда 4

№ слайда 5
В небе появилась комета. Необычная комета – искусственная: из летящей к Луне советской космической ракеты было выпущено облако паров натрия. Пурпурное свечение этих паров позволило уточнить траекторию первого летательного аппарата, прошедшего по маршруту Земля-Луна. В небе появилась комета. Необычная комета – искусственная: из летящей к Луне советской космической ракеты было выпущено облако паров натрия. Пурпурное свечение этих паров позволило уточнить траекторию первого летательного аппарата, прошедшего по маршруту Земля-Луна.

№ слайда 6
Какое строение характерно для кристаллов щелочных металлов? Какое строение характерно для кристаллов щелочных металлов? Как изменяются температуры кипения и плавления? Какой самый легкий из щелочных металлов?
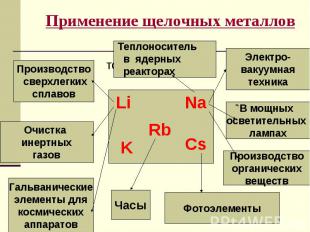
№ слайда 7

№ слайда 8
В ветхом завете упоминается некое вещество «нетер». Это вещество употребляли как моющее средство. Скорее всего оно образовалось в соленых египетских озерах с известковыми берегами. Об этом веществе, но под названием «нитрон» писали позже греческие авторы –Аристотель, Диоскорид. В ветхом завете упоминается некое вещество «нетер». Это вещество употребляли как моющее средство. Скорее всего оно образовалось в соленых египетских озерах с известковыми берегами. Об этом веществе, но под названием «нитрон» писали позже греческие авторы –Аристотель, Диоскорид. Как вы думаете, о каком веществе идет речь?
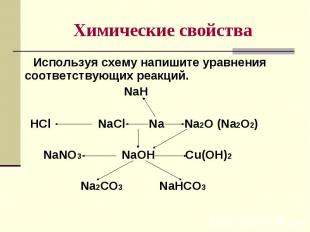
№ слайда 9
Используя схему напишите уравнения соответствующих реакций. Используя схему напишите уравнения соответствующих реакций. NaH HCl NaCl Na Na2O (Na2O2) NaNO3 NaOH Cu(OH)2 Na2CO3 NaHCO3

№ слайда 10
Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция и вниз по группе. Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция и вниз по группе. Оксиды этих элементов («земли» - по старинной терминологии) взаимодействуют с водой, образуя щелочи. Напишите уравнения реакции любого из оксидов металлов с водой.
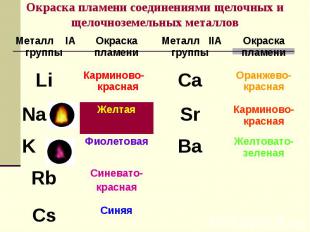
№ слайда 11

№ слайда 12
Дайте названия соединениям кальция: Дайте названия соединениям кальция: CaO Ca(OH)2 CaCO3 CaHCO3 Вспомните тривиальные названия этих веществ

№ слайда 13
№ слайда 14
№ слайда 15
Са СаО Са(ОН)2 СаСО3 Са(НСО3)2

№ слайда 16
Кальциевые горные породы – известняк, мрамор, мел. Кальциевые горные породы – известняк, мрамор, мел.

№ слайда 17
При просачивании воды с поверхности земли через залежи При просачивании воды с поверхности земли через залежи известняка происходят процессы: Если порода залегает под тонким слоем почвы – образуются провалы;

№ слайда 18
Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры? А растущие навстречу им со дна пещеры колонны?

№ слайда 19
При воздействии кислотных дождей строения разрушаются.

№ слайда 20
Каково значение щелочных и щелочно-земельных металлов в жизни человека? Каково значение щелочных и щелочно-земельных металлов в жизни человека? Как изменяются свойства оксидов и гидроксидов в группах при увеличении заряда ядра? Какой из элементов калий или цезий является более сильным восстановителем?

№ слайда 21
Презентация на тему: Щелочноземельные металлы

Щелочноземельные металлы Учитель МОУ СОШ № 130Разнополова О.П.

Цели: Обобщить и систематизировать знания о щелочноземельных металлахУметь характеризовать элементы по положению в периодической таблицеЗнать физические и химические свойства применение соединений щелочноземельных металлов

Положение в периодической таблице. Строение атома В периодической системе находятся в главной подгруппе II группы.Являются сильными восстановителями, отдают 2 ē, во всех соединениях проявляют степень окисления +2.Mg +12 2ē, 8ē, 2ēCa +20 2ē, 8ē, 8 ē, 2ēSr +38 2ē, 8ē, 18 ē, 8ē, 2ēBa +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē

Физические свойства цвет пламени þ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0

Химические свойства 2Me0 +O2 → 2Me+2O-2Me0 +H2 → Me+2H2Me0 +Cl02 → Me+2Cl2Me0 +S0 → Me+2S-2 Me0 +2HCl → Me+2Cl2 + H2 Me0 +2HOH → Me+2(OH)2 +Н2

Соединения щелочноземельныхметаллов Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.
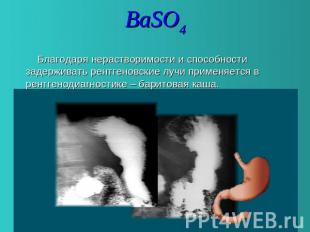
BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.

CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы – мел, мрамор, известняк.

CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.

MgCO3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы в шлак.

Са(ОН)2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.

Проверка знаний Сравните атомы элементов, поставив знаки или = вместо *:а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;б) число электронных слоев: Mg * Ca, Na * Mg, Ca * К;в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;г) радиус атома: Mg * Ca, Na * Mg, Ca * K;д) восстановительные свойства: Mg * Ca, Na * Mg, Ca * K.

Проверь себя (самостоятельная работа ) Дополните схемы взаимодействия щелочноземельных металлов с неметаллами общими формулами и названиями продуктов реакции. Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:а) М+ S ____________ б) М+ N2____________________________в) М+ Н 2 _____________ г) М+ С12 ___________________ Пример: ___________________ Пример: _________________________ Допишите уравнения реакций: а)Са + H2O→ ………………………. б) Mg + НСl→………………………. в) Ва + О2→………………………..Осуществить превращения по схеме:Ме → МеО → Ме(ОН)2 → МеSО4

Домашнее задание: § 12. упр. № 5, 8Написать уравнения реакций с помощью которых можно осуществить два любых превращения из составленных учащимися на уроке.

Используемая литература Рудзитис Г.Е., Фельдман Ф.Г. Химия 9.- Москва.: Просвещение, 2001Габриелян О.С. Химия 9.-Москва.:Дрофа, 2008Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.-Москва.:Дрофа 2002Коллекция Виртуальной лаборатории. Учебное электронное издание
Читайте также:
