Щелочные и щелочноземельные металлы
Обновлено: 28.04.2024

Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу периодической таблицы входят щелочные металлы:
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
Химические свойства щелочных металлов представлены в таблице.
Реакция
Особенности
Уравнение
Быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2)
Реагирует только литий при комнатной температуре
Реакция проходит бурно
При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды
Спокойно реагирует только литий. Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются
С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот
– 2Na + 2HCl → 2NaCl + H2;
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
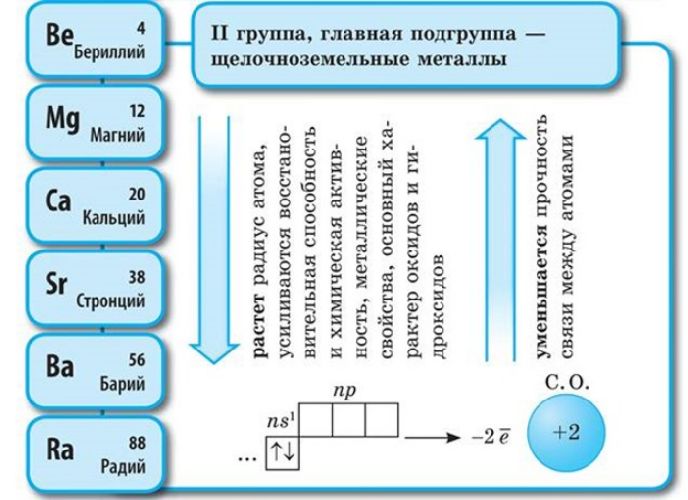
Рис. 2. Щелочноземельные металлы.
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см 3 ).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются
При высокой температуре образуют гидриды
С галогенами и неметаллами
Реагируют при нагревании
При комнатной температуре
Реагируют все металлы с образованием солей
Реагирует только бериллий
Замещают менее активные металлы в оксидах. Исключение – бериллий
2Mg + ZrO2 → Zr + 2MgO
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
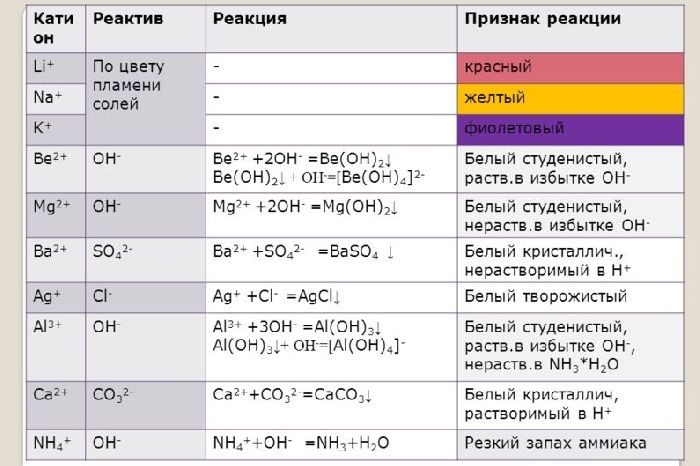
Рис. 3. Качественная реакция.
Что мы узнали?
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
Щелочные и щелочноземельные металлы

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:

Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
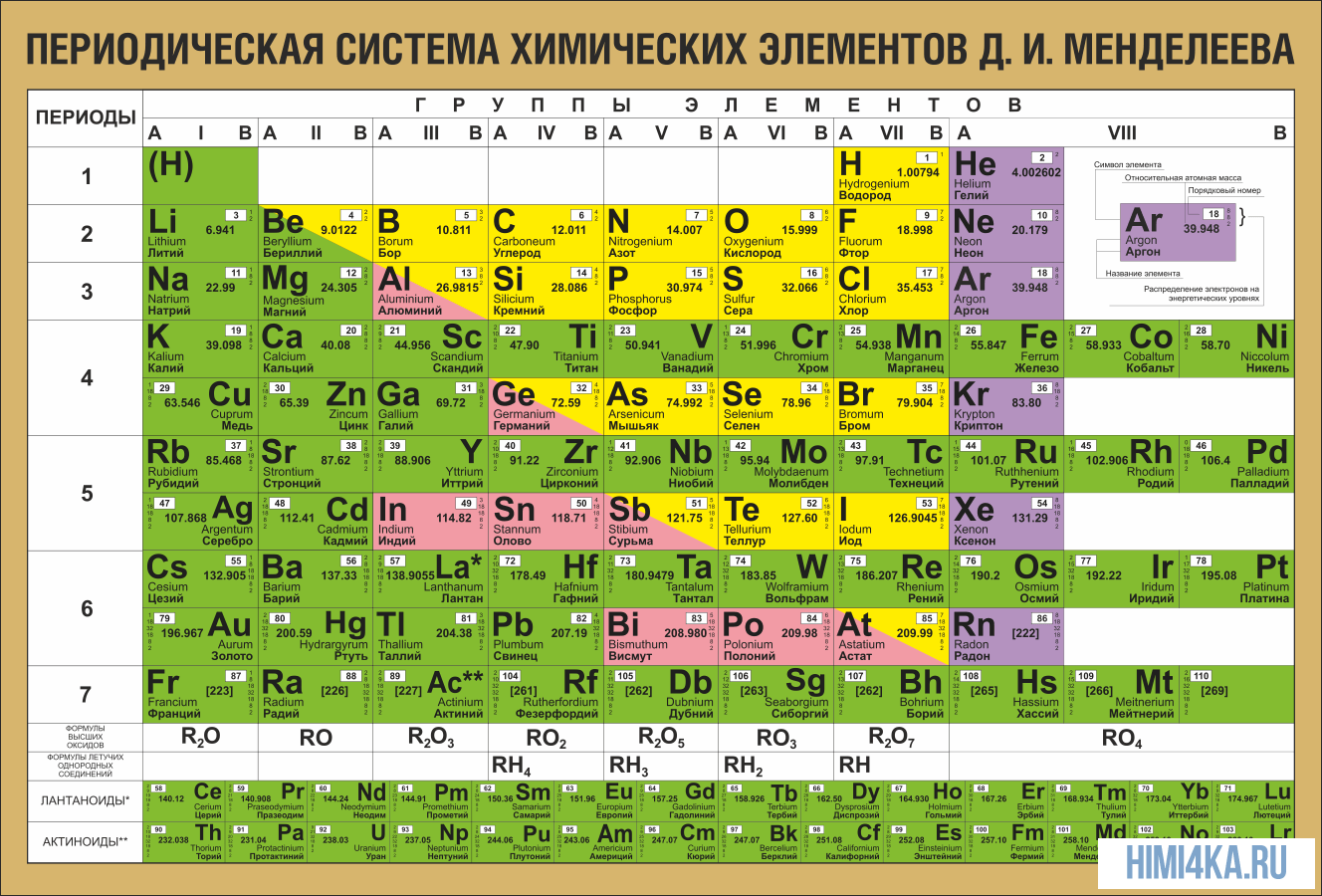
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
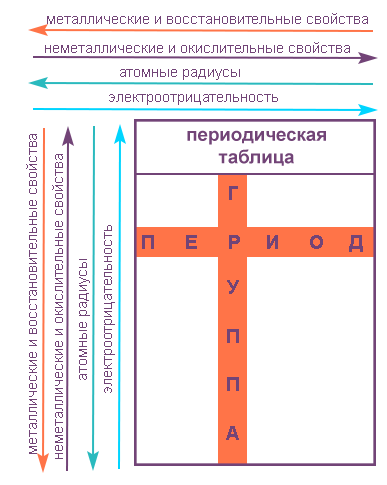
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Урок 9. Щелочные и щёлочноземельные металлы

Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
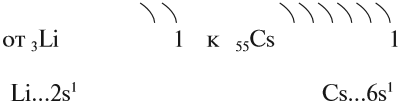
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
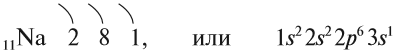
Имея один валентный электрон (…3s 1 ), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:

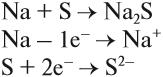
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
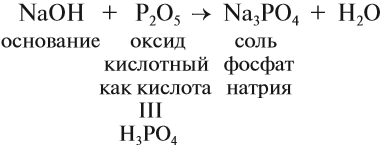
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.

Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na + и OH – притягиваются слабее, чем Са 2+ и ОН – .
Поэтому первые два элемента этой подгруппы не образуют щелочей:
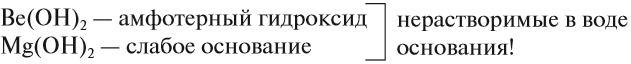
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
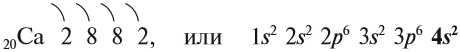
Имея два валентных электрона: …4s 2 , кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
Рассмотрим как происходит взаимодействие кальция с азотом:
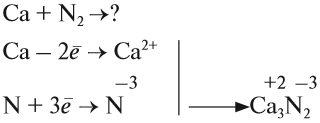
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
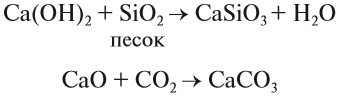
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
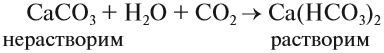
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
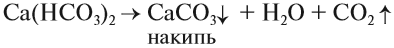
Накипь, конечно, можно растворить при помощи соляной кислоты:
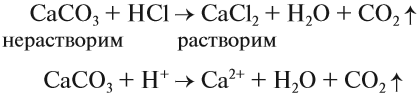
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
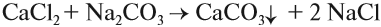
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.

Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Химические свойства простых веществ-металлов: щелочных и щелочноземельных металлов, алюминия, железа

Элементами группы IA являются литий, натрий, калий, рубидий, цезий и франций. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 6.
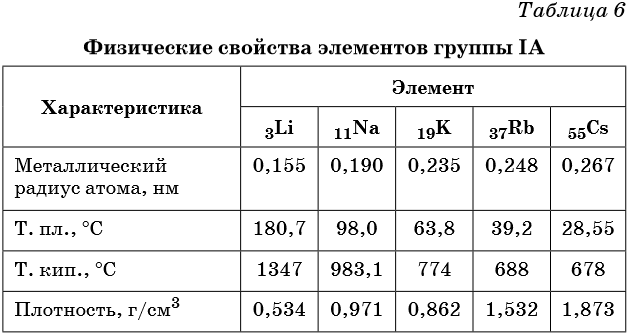
Для щелочных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
Калий получают также с помощью натрийтермического метода:
Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1. Хранят щелочные металлы в герметичной таре под слоем обезвоженного керосина, а литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs):
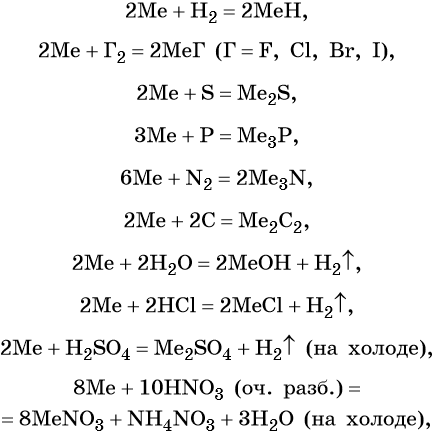
Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
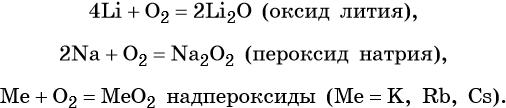
Оксиды щелочных металлов Э2O являются типичными основными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.

Элементами IIА-группы являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щёлочноземельными металлами. Некоторые свойства элементов IIА-группы приведены в таблице 7.

Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку (диагональное сходство).
Для щёлочноземельных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
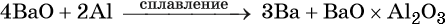
Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щёлочноземельных металлов реакции с простыми и сложными веществами (Me = Ca, Sr, Ba):
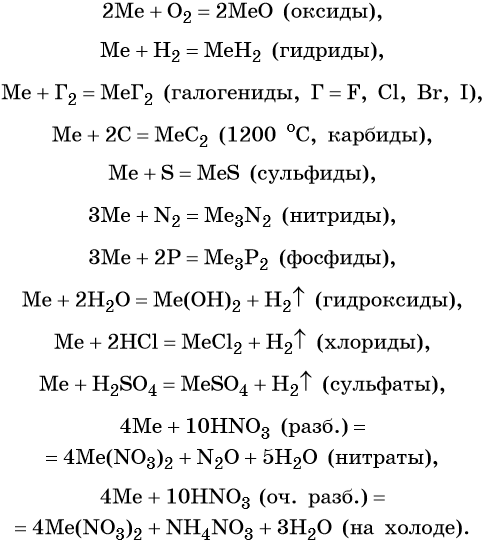
Оксиды щёлочноземельных металлов представляют собой типичные основные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щёлочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
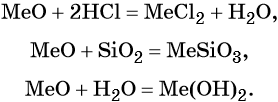
Гидроксиды щёлочноземельных металлов проявляют основные свойства: реагируют с кислотами с образованием основных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
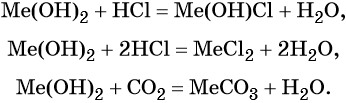
Сила оснований увеличивается с увеличением порядкового номера элемента.
Алюминий — химический элемент, расположенный в 3-м периоде IIIA группе. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 1 .
Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель.

Оксид алюминия — типичный амфотерный оксид, гидроксид алюминия — типичный амфотерный гидроксид.
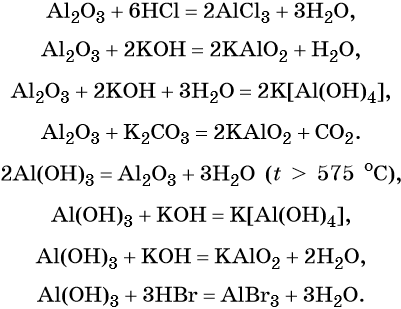
Железо находится в 4-м периоде VIIIБ группе. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6.
Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах.
Упрощённо этот процесс можно описать уравнением:
Характерные для железа химические реакции:
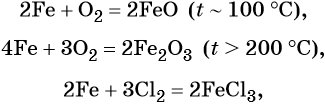
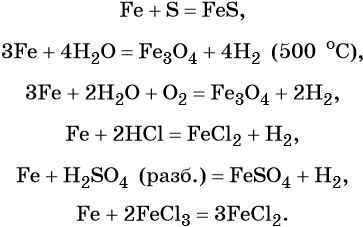
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции.
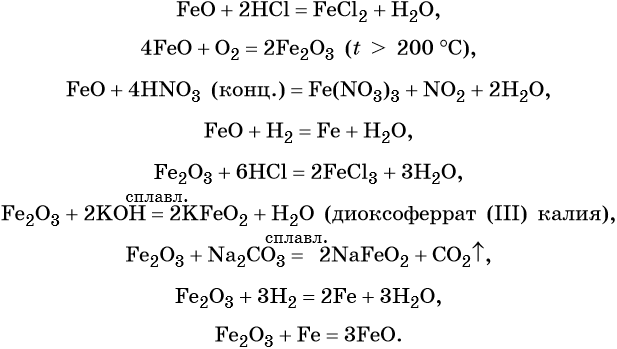
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут так же, как и у входящих индивидуально в его состав оксидов:
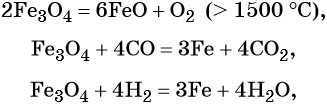
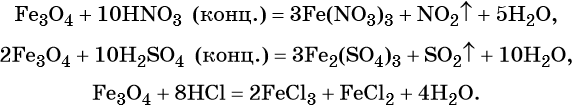
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
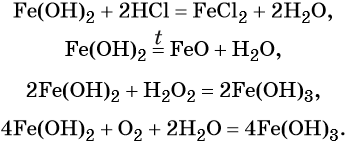
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
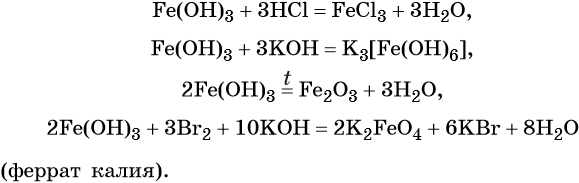
Тренировочные задания
1. Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ
1) кислородом и алюминием
2) серой и хромом
3) оксидом углерода (II) и оксидом меди (I)
4) азотом и фосфором
2. Верны ли следующие утверждения о литии?
А. Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Натрий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) ртутью и алюминием
2) фосфором и оксидом кальция
3) оксидом серы (IV) и оксидом кальция
4) азотной кислотой и водой
4. Верны ли следующие утверждения о натрии?
А. Натрий не реагирует с фосфором даже при нагревании.
Б. Натрий используют в технике при получении калия.
5. Калий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и магнием
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом магния
4) азотной кислотой и оксидом серы (VI)
6. Верны ли следующие утверждения о калии?
А. Калий не реагирует с водой.
Б. Гидрид калия нельзя получить прямой реакцией калия с водородом.
7. Магний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) в одой и железом
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом кремния
4) азотной кислотой и оксидом серы (VI)
8. Верны ли следующие утверждения о магнии?
А. Магний на воздухе покрывается оксидной пленкой.
Б. Магний реагирует с соляной кислотой.
9. Кальций при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и углеродом
2) фосфором и литием
3) оксидом фосфора (V) и оксидом азота (IV)
4) оксидом бария и оксидом серы (VI)
10. Верны ли следующие утверждения о кальции?
А. Кальций реагирует с азотом при нагревании.
Б. Кальций не реагирует с оксидом фосфора (V).
11. Барий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и соляной кислотой
2) фосфором и натрием
3) оксидом фосфора (V) и оксидом лития
4) оксидом углерода (IV) и оксидом серы (VI)
12. Верны ли следующие утверждения о барии?
А. Барий не вступает в реакцию с бромом.
Б. Барий вступает в реакцию с водой.
13. Алюминий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) железом и оксидом серы (VI)
14. Верны ли следующие утверждения об алюминии?
А. Алюминий вступает в реакцию с Fe2O3.
Б. Алюминий реагирует с соляной кислотой.
15. Железо при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) кислородом и оксидом серы (VI)
16. Верны ли следующие утверждения о железе?
А. Железо вступает в реакцию с Fe2O3.
Б. Железо реагирует с соляной кислотой.
17. Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + HNO3 (разб.) →
Б) Li + S →
В) Li + H2O →
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + O2 →
Б) Li + Cl2 →
В) Li + HNO3 (разб.) →
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + O2 →
Б) Na + H2SO4 →
В) Na + HCl →
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + HNO3 (разб.) →
Б) Na + O2 →
В) Na + H2O →
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + O2 →
Б) K + HCl →
В) K + S →
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + HNO3 (разб.) →
Б) Mg + N2 →
В) Mg + HCl →
24. Установите соответствие между реагирующими веществами и продуктами реакций.
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + HNO3 (разб.) →
Б) Ca + P →
В) Ca + HCl →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + N2 →
Б) Ca + C →
В) Ca + HCl →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + HNO3 (разб.) →
Б) Ba + H2 →
В) Ba + H2O →
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + N2 →
Б) Ba + O2 →
В) Ba + C →
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + HCl →
Б) Al + C →
В) Al + Fe2O3 →
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + NaOH + H2O →
Б) Al + P →
В) Al + HI →
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + HCl →
Б) Fe + H2SO4 (разб.) →
В) Fe + S →
32. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + H2O (пар) →
Б) Fe + HNO3 (разб.) →
В) Fe + CuSO4 →
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
37. Дана схема превращений:
38. Дана схема превращений:
39. Дана схема превращений:
40. Дана схема превращений:
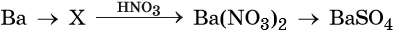
41. Дана схема превращений:
42. Дана схема превращений:
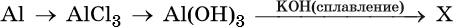
43. Дана схема превращений:
44. Дана схема превращений:
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Читайте также:
