Щелочные металлы очень активны и поэтому
Обновлено: 13.05.2024
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия элементов (щелочные металлы) ep 1
Давненько не было статеек и вот я готов начать серию работ по химии элементов. Материал я постараюсь, как в хороших учебниках делить на "базовый" и "расширенный", как показала практика такое распределение помогает как новичкам, так и увлеченным химикам. Буду благодарен за критику, поскольку ошибок я, как начинающий писатель, пока делаю достаточно.
Начнем пожалуй с щелочных металлов: Li, Na, K, Rb, Cs, Fr. Все расположены в первой группе периодической системы, и их объединяют как общие химические так и физические свойства. Но чем обусловлено такое сходство?
В цикле "Очень легкая химия" мы разбирались в строении атомов и говорили о том, что именно электронная оболочка определяет свойства того или иного элемента, теперь настало время применить наши знания на практике.
Если вспомнить положения периодического закона, мы увидим, что у всех щелочных металлов на последнем энергетическом уровне находится по одному электрону. Из этого мы делаем логичный вывод, что они склонны отдавать его, чтобы приобрести законченный электронный уровень.
Законченный электронный уровень обладает меньшей энергией чем незаконченный, следовательно состояние, при котором энергетическая оболочка атома характеризуется наименьшей энергией, будет наиболее стабильным. В теории это объясняется эффектами вырожденности электрона (неоднозначное определение его на орбитали) На практике же подтверждается большой разницей между энергиями первой и второй ступени ионизации (что говорит о менее прочной связи с ядром внешнего электрона, по сравнению с электроном с заполненной оболочки)
Именно поэтому щелочные металлы очень активны, способны легко отдавать электрон, проявляя свойства восстановителей, а также обладают самыми низкими электрохимическими потенциалами

Высокая активность щелочных металлов не позволяет им находится в природе в самородном виде, поэтому металлы первой группы образуют множество минералов, с некоторыми из которых, например с поваренной солью, мы сталкиваемся каждый день.
Известно огромное количество минералов, образуемых щелочными металлами, вот некоторые из них:
LiAl(SiO3)2- сподумен
KCl * MCl2* 6H2O- карналит
KCl- сильвин
NaCl- галит
(Cs, Na)[AlSi2O6] - поллуцит
Выделение металлов из их соединений, ввиду их высокой химической активности, является сложной задачей, в основном используют либо электрохимический метод, либо восстановление алюминием, кальцием или цирконием.
Резонные вопросы вызывает последний метод, ведь мы знаем, что металл, стоящий в электрохимическом ряду напряжений после например натрия, не может восстановить его из соли, однако на помощь нам приходят уже физические свойства щелочных металлов, а именно низкая температура плавления и кипения, в условиях атмосферного давления, небольшие количества натрия, получающиеся в реакции хлорида натрия и алюминия, опять взаимодействуют с хлоридом алюминия и реакция в общем не идет. Но если поместить реакционную смесь в вакуум и нагреть, образующийся в ходе реакции натрий начнет испаряться, не реагируя с твердым даже при высокой температуре хлоридом алюминия. Также внимание заслуживает метод Грейсхейма, взаимодействие ацетиленида (карбида) кальция с фторидом калия (реакция).Рубидий и цезий получают разложением азидов (солей HN3) вакууме.
Химические свойства
Все щелочные металлы реагируют с кислородом, водородом, неметаллами, кислотами, водой и многими другими классами соединений, в том числе и органическими молекулами.
Соединения с кислородом.
Щелочные металлы образуют 4 типа соединений с кислородом: оксиды, пероксиды, надпероксиды, озониды. На примере натрия соответственно:
Na2O, Na2O2, NaO2, NaO3.
Такое многообразие обусловлено высокой активностью щелочных металлов, а также незначительной разницей между энергиями связи кислородных атомов друг с другом и атомами металлов.
Все кислородные соединения реагируют с водой. Оксиды при взаимодействии дают щелочи, а остальные соединения: щелочь и пероксид водорода на холоде, щелочь воду и кислород при нагревании, или в присутствии катализатора (MnO2 Pt каталаза).
Интересно, что прямым взаимодействием кислорода нельзя получить оксид щелочного металла, исключением является оксид лития, в этом литий проявляет диагональное сходство с магнием. В случае с остальными металлами образуется адская смесь оксидов, пероксидов и надпероксидов.
Чистые оксиды получают взаимодействием например калия с нитратом калия, или пероксида с металлом, азида с металлом, гидроксида с металлом, эти способы не эффективны для цезия и рубидия, ввиду их высочайшей активности. Остальные кислородные соединения получают прямым окислением или, как в случае озонидов, взаимодействием с озоном.
Интересными соединениями щелочных металлов являются интерметаллиды, соединения двух металлов. Особенностью сплавов (интерметаллидов) щелочных металлов является их невероятно низкая температура плавления, например у сплава натрия, калия и цезия она равна -78 °C. А например сплав ртути и натрия (амальгама натрия) используется в органическом синтезе как восстановитель, благодаря своей способности реагировать с водой без опасности взрыва, как это бывает в случае с натрием.
При взаимодействии щелочных металлов получаются солеобразные гидриды, соединения в которых водород принимает степень окисления -1. Гидриды выглядят как белые порошки, взаимодействуют с кислотами и водой, обладают сильными восстановительными свойствами, что активно используется в органической химии. Смешанный гидрид алюминия лития, или аланат лития используют для восстановления кетонов, альдегидов и нитросоединений.
Соединения щелочных металлов с неметаллами получают прямым взаимодействием. Сульфиды и фосфиды образуют все щелочные металлы, а карбиды (ацетилениды) при прямом взаимодействии образует только литий, он же реагирует с азотом при комнатной температуре, образуя нитрид.
В следующей части речь пойдет о наиболее важных соединениях щелочных металлов- солях, являющихся основными компонентами удобрений, без которых наша жизнь была бы не возможна.
Правда ли, что употребление соли вредно?

Один из самых популярных мифов о питании гласит, что соль — это белая смерть, она вредна для здоровья. Мы решили проверить, правда ли это.
(Специально для любителей расширения сознания — речь идет про поваренную соль, которая хлорид натрия)
(Самое важное для ЛЛ: утверждение, что соль вредна, абсолютно некорректно. При этом к проблемам со здоровьем может привести как ее дефицит, так и избыток в суточном рационе)
Информацию о том, насколько соль опасна для нашего организма, можно найти на сайтах медицинских учреждений, например больниц. Об этом пишут СМИ, даже специалисты ООН бьют тревогу. Рассуждения о том, стоит ли полностью отказываться от соли, можно найти на порталах о диетологии и здоровом образе жизни. Стереотип о том, что соль — это яд, настолько распространён, что его можно встретить даже в кино.
1. Дефицит соли
Соль на 97% состоит из хлорида натрия и служит одним из основных источников этих элементов для нашего организма. Натрий — электролит, который играет важную роль в поддержании водно-солевого баланса (логично), а также обеспечивает передачу нервных импульсов.
Сама по себе нехватка натрия в крови — уже достаточно серьёзное заболевание, гипонатриемия. Оно может привести к тяжёлым неврологическим и психическим нарушениям, судорогам, коме и даже смерти. Ещё одна опасность низкого содержания натрия в организме — обезвоживание, которое тоже может привести к тяжёлым последствиям для здоровья. И обезвоживание, и гипонатриемия особенно опасны для людей старшего возраста. Натрий выводится из нашего организма естественным образом с мочой и потом. Именно поэтому спортсмены после тяжёлых тренировок могут ощутить нехватку натрия, один из её симптомов — мышечные спазмы.
В 2016 году специалисты Кокрановской библиотеки изучили результаты различных исследований о взаимосвязи потребления соли, давления и холестерина и выяснили, что диета с пониженным содержанием соли способствует некоторому повышению холестерина и триглицеридов в крови. А это, в свою очередь, может привести к заболеваниям сердца. Кроме того, пищевую соль часто обогащают железом, йодом и фолиевой кислотой, поэтому её употребление может восполнить и нехватку этих веществ в организме.
Американская кардиологическая ассоциация рекомендует потреблять в день 1,5 г натрия — это примерно 3/4 чайных ложки соли. Однако, согласно проведенным ими исследованиям, средний американец съедает примерно полторы, превышая норму в два раза. То же самое обнаружили и диетологи Австралии.
2. Негативные последствия избытка соли
Многочисленные исследования врачей показали, что переедание соли способствует развитию гипертонии, что, в свою очередь, может привести к инфарктам и инсультам. В 2020 году учёные заявили, что увеличение ежедневного употребления натрия всего на 1 г приводит к повышению риска смерти от сердечно-сосудистых заболеваний на 6%. Кровяное давление влияет и на здоровье почек, поэтому сильно солёная пища может отрицательно сказаться и на них.
Впрочем, на этот счёт учёные пока не смогли прийти к единому мнению. Некоторые из них считают, что доказательств влияния потребления соли на кровяное давление недостаточно. В любом случае паниковать и полностью отказываться от соли не стоит: доказано, что употребление в пределах одной-двух чайных ложек точно не способствует повышению давления.
Кроме того, обзор 2014 года показал, что сокращение количества соли в рационе на 2 г способствует снижению систолического артериального давления всего на 3,82 мм ртутного столба. При средних значениях в 125–144 мм ртутного столба такое снижение представляется не особенно значимым.
Между делом учёные выяснили, что одни люди более чувствительны к соли, чем другие. Вероятно, именно им стоит более пристально следить за соблюдением нормы потребления натрия. Но зато и сокращение соли в рационе для них будет более эффективным, чем для тех, кто не так чувствителен. В группу риска, по мнению учёных, входят пожилые люди, гипертоники, афроамериканцы, люди с хроническими заболеваниями почек, те, у кого был низкий вес при рождении.
3. Соль и рак желудка
Некоторые исследования связывают диеты с повышенным содержанием соли с риском развития рака желудка. Так, одно из исследований, проведённых в Японии, с участием более чем 40 000 человек показало, что этот риск выше аж на 30% у тех, кто предпочитает сильно солёную пищу.
При этом учёные пока не пришли к единому мнению, как конкретно соль может вызвать рак. По одной из версий, она способствует размножению бактерий, провоцирующих язвенную болезнь, которая может перерасти в рак. По другой — диета с высоким содержанием соли может вызвать клеточные мутации, которые в конечном счёте и приводят к раку.
4. Остеопороз
Ещё одна опасность избыточного потребления соли — остеопороз. Организм выводит излишки натрия через мочу, а вместе с ней выводится и кальций. Соответственно, чем больше соли необходимо вывести организму, тем больше он вымоет и кальция, что может стать причиной костных нарушений.
5. Контроль количества потребляемой соли
Ограничивать соль в рационе действительно есть смысл, поскольку следить за ее количеством не так просто, особенно если вы употребляете готовые продукты, например соусы. Соль содержится практически во всех продуктах питания, но оценить её количество не всегда можно на глаз.
Роспотребнадзор приводит таблицу содержания соли в различных продуктах. По их данным, в 100 г среднесолёной сельди содержится 336% дневной нормы натрия, в 100 г пармезана — 106%, а в таком же количестве оливок — 97%. Таким образом, чтобы не превысить норму, вам не только нужно выбрать в день что-то одно, но и совсем не употреблять соль в других продуктах, что практически невозможно.
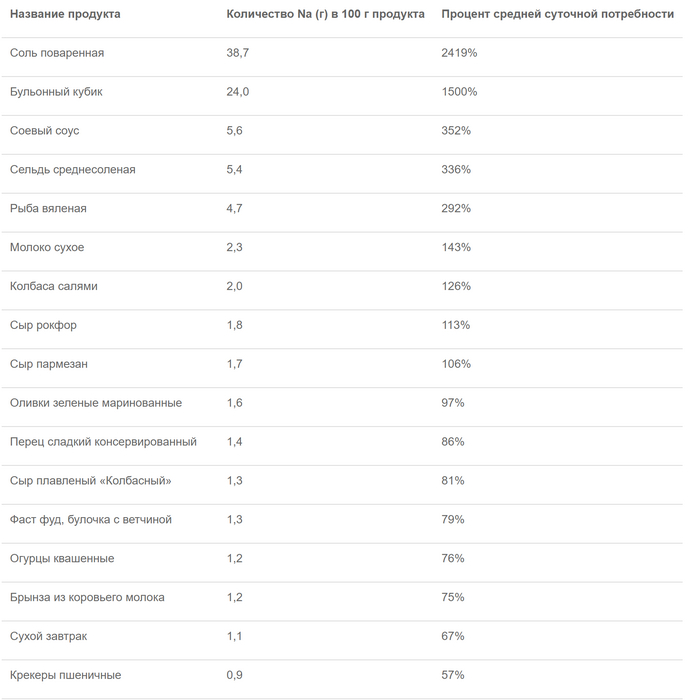
Таким образом, избыточное потребление соли может быть опасно для здоровья, хотя учёные до сих пор не смогли прийти к единому мнению на этот счёт. Тем не менее полностью отказываться от неё нельзя, поскольку она — источник натрия, который необходим организму для нормальной жизнедеятельности, а его нехватка может привести к печальным последствиям для здоровья.
Поэтому, как и со многими другими продуктами, с солью всё хорошо в меру, однако утверждать, что её употребление в любых количествах приближает смерть, — несправедливо.

Наш вердикт: полуправда (проверяемый факт или утверждение представляет собой смесь правды и лжи примерно в равных пропорциях)
Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла).
Аудиоверсии проверок в виде подкастов c «Коммерсантъ FM» доступны в Simplecast, «Яндекс.Подкасты», Apple Podcasts, «ЛитРес», Soundstream и Google.Подкасты.
Металлы IA группы
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
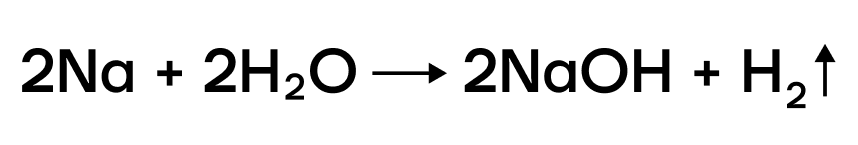
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
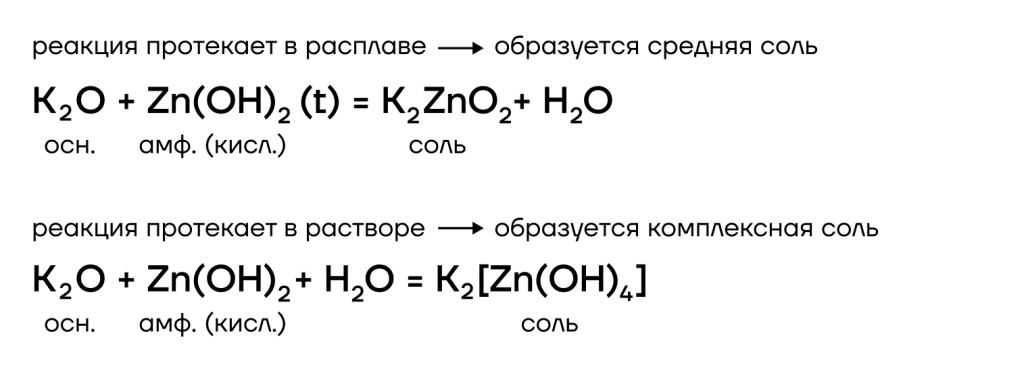
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
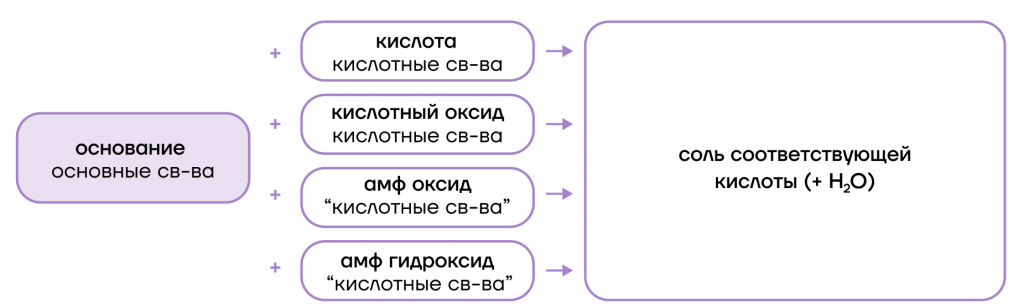
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
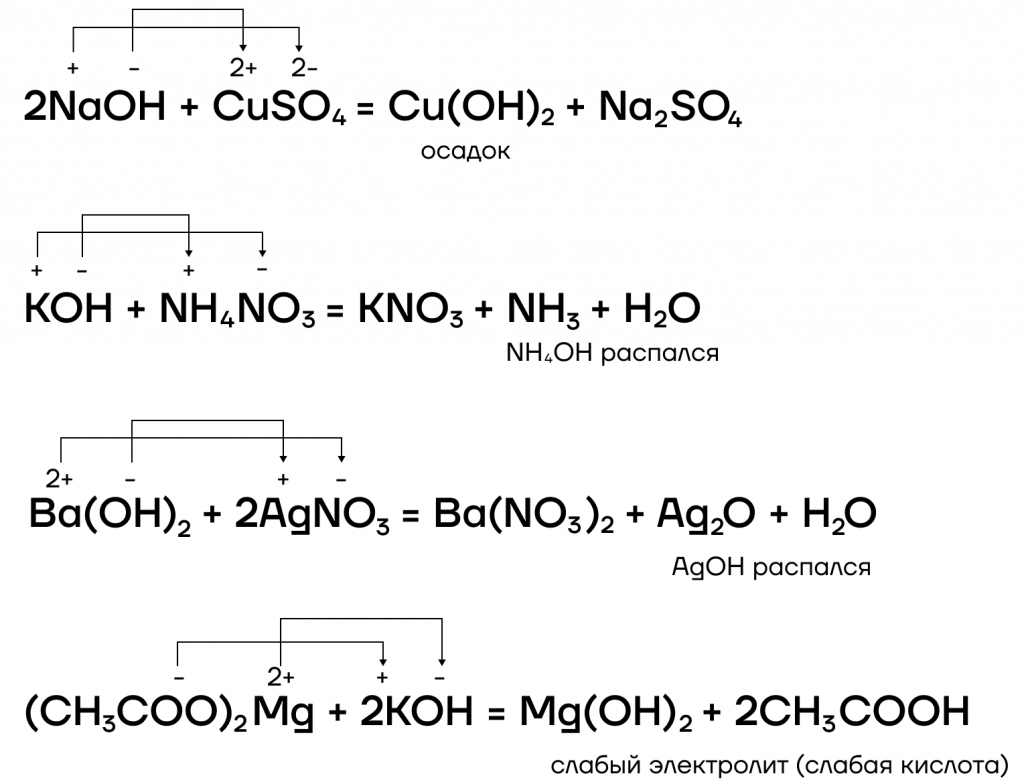
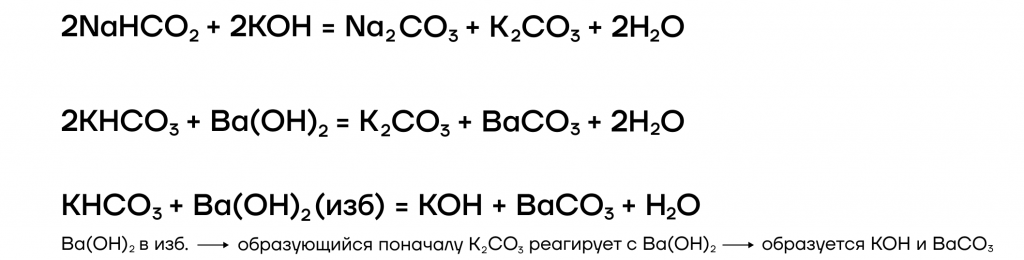
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
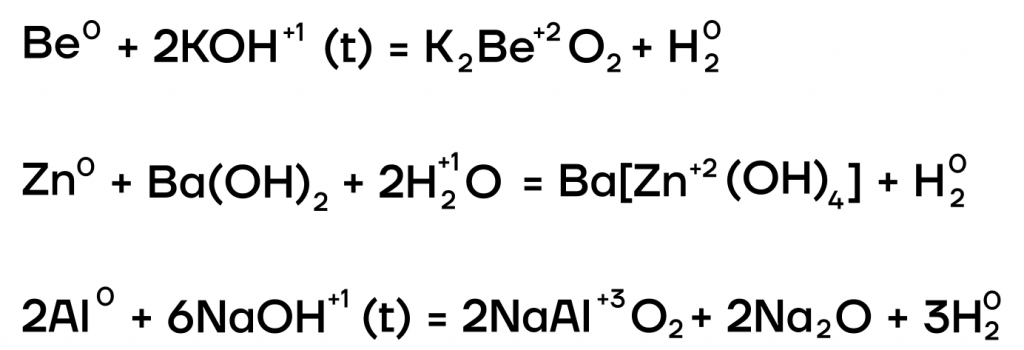
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Читайте также:
