Селен металл или неметалл
Обновлено: 24.04.2024
СЕЛЕ́Н -а; м. [от греч. Selēnē - Луна] Химический элемент (Sе), серо-чёрное ядовитое вещество, полупроводник, обладающий фотоэлектрическими свойствами (применяется в технике и стекольной промышленности).
(лат. Selenium), химический элемент VI группы периодической системы. Название от греческого selēnē — Луна. Образует несколько модификаций. Наиболее устойчив серый селен — кристаллы, плотность 4,807 г/см 3 , tпл 221°C. В природе рассеян, сопутствует сере, добывают из отходов (шламов) при электролитической очистке меди. Полупроводник, обладающий фотоэлектрическими свойствами. Селеновые фотоэлементы применяют в различных устройствах, например фотоэлектрических экспонометрах. Все соединения селена ядовиты.СЕЛЕ́Н (лат. selenium, от греческого Selene — Луна), Se, читается «селен», химический элемент с атомным номером 34, атомная масса 78,96. Природный селен состоит из шести стабильных изотопов: 74 Se (0,87% по массе), 76 Se (9,02%), 77 Se (7,58%), 78 Se (23,52%), 80 Se (49,82%) и 82 Se (9,19%). Радиус атома 0,160 нм. Радиус ионов (координационное число 6) Se 2– — 0,184 нм, Se 4+ — 0,069 нм и Se 6+ — 0,056 нм. Энергии последовательной ионизации 9,752, 21,2, 32,0, 42,9 и 68,3 эВ. Расположен в VIA группе в 4 периоде периодической системы элементов. Хaлькоген (см. ХАЛЬКОГЕНЫ) . Конфигурация внешнего электронного слоя 4s 2 4p 4 . Степени окисления: –2, +2, +4, +6 (валентности II, IV, VI). Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,40.
История открытия
Селен был открыт в 1817 шведским химиком Й. Я. Берцелиусом (см. БЕРЦЕЛИУС Йенс Якоб) в шламах свинцовых камер одного из сернокислотных заводов. По свойствам оказался похож на открытый в 1782 М. Г. Клапротом (см. КЛАПРОТ Мартин Генрих) теллур (см. ТЕЛЛУР) .
Нахождение в природе
Селен редкий, рассеянный элемент. Содержание в земной коре 1,4·10 –5 % по массе. Селениды почти всегда изоморфны соответствующим сульфидам, они обычно находятся в природе как примесь в соответствующих сульфидах (в железном колчедане (см. КОЛЧЕДАНЫ) FeS2, халькопирите (см. ХАЛЬКОПИРИТ) CuFeS2, цинковой обманке (см. СФАЛЕРИТ) ZnS).
Селеновые минералы очень редки, среди них: берцелианит Cu2Se, тиеманит HgSe, науманит Ag2Se, халькоменит CuSeO 3·2H 2O. Сaмородный селен в природе встречается редко.
Получение
Основные источники селена — пыль, образующаяся при обжиге селенсодержащих сульфидов и шламы свинцовых камер.
После обработки шламов концентрированной серной кислотой, содержащей нитрат натрия, селен переходит в раствор, образуя селенистую кислоту H2SeO3 и, частично, селеновую кислоту H2SeO4. Селеновая кислота при нагревании с соляной кислотой восстанавливается до селенистой кислоты. Затем через полученный раствор селенистой кислоты пропускают сернистый газ SO2
H2SeO3 + 2SO2 + H2O = Se + 2H2SO4
выпадает красный осадок элементарного селена.
Для очистки селен далее сжигают в кислороде, насыщенном парами дымящей азотной кислоты HNO3. При этом сублимируется чистый диоксид селена SeO2. Из раствора SeO2 в воде после добавления соляной кислоты селен опять осаждают, пропуская через раствор сернистый газ.
Полученный селен переплавляют, расплав фильтруют через стеклоткань или активированный уголь и подвергают вакуумной дистилляции или ректификации в инертной атмосфере.
Физические и химические свойства
Селен — серый, с металлическим блеском хрупкий неметалл.
При атмосферном давлении существует несколько десятков модификаций селена. Наиболее стабилен серый селен, g-Se, с гексагональной решеткой (a = 0.436388 нм, c = 0.495935 нм). Температура плавления 221°C, кипения 685°C, плотность 4,807 кг/дм 3 . Плотность жидкого селена при 221°C — 4,06 кг/дм 3 . Серый селен получают из других форм длительным нагреванием и медленным охлаждением расплава или паров селена. Его структура состоит из параллельных спиральных цепей.
Из растворов селена в CS2 выделены три модификации красного кристаллического селена с моноклинной решеткой. a-Se оранжево-красного цвета, a = 0,9054 нм, b = 0,9083 нм, c = 1,1601 нм, угол b = 90,81°, температура плавления 170°C, плотность 4,46 кг/дм 3 .
b-Se темно-красного цвета, a = 1,285 нм, b = 0,807 нм, c = 0,931 нм, угол b = 93,13°, температура плавления 180°C, плотность 4,50 кг/дм 3 .
g-Se красного цвета, a = 1,5018 нм, b = 1,4713 нм, c = 0,8789 нм, угол b = 93,61°, плотность 4.33 кг/дм 3 . Красный селен содержит кольцевые молекулы Se8.
При восстановлении селенистой кислоты или быстром охлаждении паров селена образуется аморфный красный селен. От еще одной модификации аморфного стекловидного селена аморфный красный селен отличается только размером составляющих его микрочастиц. Плотность красного селена 4,28 кг/дм 3 .
При 27 МПа получена кубическая модификация селена. Серый g-Se — полупроводник с дырочной проводимостью, ширина запрещенной зоны 1,8 эВ. В темноте проводит электрический ток очень плохо. При освещении электропроводимость возрастает в тысячи раз.
Селен химически активен. При нагревании на воздухе сгорает с образованием бесцветного кристаллического SeO2:
Se +O2 = SeO2.
Со фтором (см. ФТОР) , хлором (см. ХЛОР) и бромом (см. БРОМ) селен реагирует при комнатной температуре. С иодом (см. ИОД) селен сплавляется, но иодиды не образует. Выше 200°C селен реагирует с водородом (см. ВОДОРОД) с образованием селеноводорода H2Se. При нагревании реагирует с металлами, образуя селениды.
С водой также aзаимодействует при нагревании:
3Se + 3H2O = 2H2Se + H2SeO3.
С неокисляющими и разбавленными кислотами селен не взаимодействует. С концентрированной серной (см. СЕРНАЯ КИСЛОТА) кислотой селен взаимодействует на холоде (цвет растворов, nодержащих полимерные катионы Se8 + , зеленый). со временем катионы Se8 + пaреходят в Se4 2+ и раствор желтеет.
Селен реагирует при нагревании с азотной кислотой, с образованием селенистой кислоты H2SeO3:
3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO.
При кипячении в щелочных растворах селен диспропорционирует:
3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O.
Если селен кипятят в щелочном растворе, через который пропускают воздух или кислород, то образуются красно-коричневые растворы, содержащие полиселениды:
K2Se + 3Se = K2Se4
Селен взамодействует с сульфидами и полисульфидами с образованием тиоселенидов. При нагревании селена с растворами Na2SO3 и KCN протекают реакции:
Na2SO3 + Se = Na2SSeO3;
KCN + Se = KSeCN.
Сильные окислители ( озон (см. ОЗОН) О3, фтор (см. ФТОР) F2) окисляют селен до Se +6 :
Se + O3 = SeO3,
Se + 3F2 = SeF6.
Применение
Аморфный Se входит в состав светочувствительных слоев в ксерографии (см. КСЕРОГРАФИЯ) и лазерных принтерах. Серый Se применяется в изготовлении диодов, фоторезисторов и др. Селен — пигмент для стекол, присадка к стали, добавка к сере при вулканизации, для получения катализаторов, гербицидов, инсектицидов, лекарственных средств.
Физиологическое действие
Микроэлемент (массовая доля в организме 10 –5 –10 –7 %).
В организм человека селен поступает с пищей (55–110 мг в год). Концентрируется в печени и почках. При больших дозах в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты. Атомы селена замещают атомы серы:
R–S–S_–R + 2Se = R–Se–Se_–R + 2S
В малых количествах селен должен содержаться в пище цыплят, телят, ягнят и кроликов. Селен входит в состав активных центров ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, в активном центре которой содержится остаток аминокислоты — селеноцистеина:
Селен способен предохранять организм от отравления ртутью (см. РТУТЬ) и кадмием (см. КАДМИЙ) , так как связывает их. Существует взаимосвязь между высоким содержанием селена в рационе и низкой смертностью от рака.
Пары селена ядовиты. ПДК аморфного селена в воздухе 2 мг/м 3 , SeO2, Na2SeO3 — 0,1 мг/м 3 . ПДК селена в воде 0,01 мг/м 3 .
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "селен" в других словарях:
СЕЛЕН — (ново лат.) Металлоид, сродный сере и теллурию. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СЕЛЕН металлоид, сходный с серой и теллуром, очень распространен; добывается из железного колчедана и обманки, в котор … Словарь иностранных слов русского языка
Селен — Селен, довольно схожий с серой, существует в нескольких разновидностях: а) аморфный селен в виде красноватых хлопьев (селеновый цвет); б) стекловидный селен, плохой проводник тепла и электричества. Он имеет блестящий излом коричневого или… … Официальная терминология
СЕЛЕН — СЕЛЕН, селений муж. простое химическое начало, коего свойства ближе к сере, нежели к металлам. Селеновая кислота. Селенистая медь, содержащая селен. Селенит, гипсовый шпат, ископаемое. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Селен — (Salen) горнолыжный курорт на юго западе Швеции (см. Швеция). Расположен недалеко от границы с Норвегией (см. Норвегия). Представляет собой протянувшуюся на 30 км горную гряду. Расстояние от Стокгольма 400 км, от Осло 150 км. Лыжный сезон… … Географическая энциклопедия
СЕЛЕН — (Selenium), Se, химический элемент VI группы периодической системы, атомный номер 34, атомная масса 78,96; относится к халькогенам; неметалл серого или красного цвета, tпл 221шС; полупроводник. Селен используют в фотоэлементах, ксерографии и др.… … Современная энциклопедия
СЕЛЕН — (лат. Selenium) Se, химический элемент VI группы периодической системы Менделеева, атомный номер 34, атомная масса 78,96. Название от греческого selene Луна. Образует несколько модификаций. Наиболее устойчив серый селен кристаллы, плотность 4,807 … Большой Энциклопедический словарь
СЕЛЕН — (символ Se), серый металлоидный химический элемент VI группы периодической таблицы, открытый Йенсом БЕРЦЕЛИУСОМ в 1817 г. Получают, главным образом, как побочный продукт электролитической очистки меди. В химическом отношении селен похож на серу.… … Научно-технический энциклопедический словарь
Селен — м л, Se. Триг. К лы игольчатые, нередко трубчатые. Сп. сов. по гекс. призме. Агр. войлокоподобные Гибкий. Серый. Бл. метал. Тв. 2. Уд. в. 4,8. Легкоплавок. Часто в экзогенных м ниях U; в зонах подземных пожаров, на горящих отвалах угленосных г. п … Геологическая энциклопедия
СЕЛЕН — СЕЛЕН, Selenum (от греч. selene луна), твердый металлоид с хим. обозначением Se; ат. в. 79,2; в периодич. системе занимает по порядку 34 место, 4 е в VІ группе. Встречается в природе часто в небольших количествах и почти всегда сопутствует сере,… … Большая медицинская энциклопедия
селеніт — 1 іменник чоловічого роду гіпс селеніт 2 іменник чоловічого роду, істота уявний мешканець Місяця; дослідник Місяця … Орфографічний словник української мови
СЕЛЕН — хим. элемент, символ Se (лат. Selenium), ат. и. 34, ат. м. 78,96. Существует в виде нескольких модификаций, из которых наибольшее значение представляет устойчивый при нормальной температуре кристаллический серый С.; его плотность 4807 кг/м3, tпл … Большая политехническая энциклопедия
Селен

Смотрите так же:
СТРУКТУРА
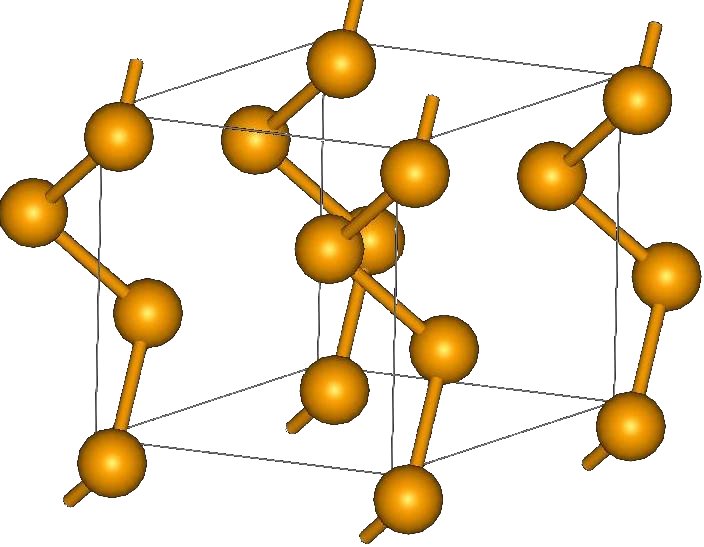
Кристаллическая структура селена
Существует две модификации селена:
1. Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
2. Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен – это одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты H2SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением. Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
СВОЙСТВА

Черный, стеклообразный аморфный и красный аморфный селен
Температура плавления вещества – 217 (α-Se) и 170–180 градусов Цельсия (β-Se), а закипает он при температуре 685 0 .
Степени окисления, что селен проявляет в реакциях: (-2), (+2), (+4), (+6), он устойчив к воздуху, кислороду, воде, соляной кислоте и разбавленной серной кислоте.
Поддается растворению в азотной кислоте высокой концентрации, “царской водке”, более длительно растворяется в щелочной среде с окислением. Является диамагнетиком.
ЗАПАСЫ И ДОБЫЧА

Поскольку селен примешен к сере, элемент извлекают из сульфата железа. Для этого даже делать особо ничего не надо. 34-ый металл накапливается в пылеочистительных камерах сернокислотных заводов. Забирают селен и из установок электролиза меди. После него остается анодный шлам. Из него-то и выделяют 34-ый элемент. Достаточно обработать шлам растворами гидроксида натрия и диоксида серы. Полученный селен нужно очистить. Для этого используют метод дистилляции. После, металл подсушивают.
ПРОИСХОЖДЕНИЕ

Отличные глянцевые кристаллы из горящих угольных отвалов. Ширина изображения – 1,8 мм. Германия, Северный Рейн-Вестфалия, Аахен, Альсдорф, шахта Анна
Содержание селена в земной коре — около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4·10 -4 мг/л.
ПРИМЕНЕНИЕ

Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. В современной технологии полупроводников применяются селениды многих элементов, например, селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз). Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл). Полупроводниковые свойства селена в чистом виде широко использовались в середине 20-го века для изготовления выпрямителей, особенно в военной технике по следующим причинам: в отличие от германия, кремния, селен малочувствителен к радиации, и, кроме того, селеновый выпрямительный диод обладает уникальным свойством самовосстанавливаться при пробое: место пробоя испаряется и не приводит к короткому замыканию, допустимый ток диода несколько снижается, но изделие остается функциональным. К недостаткам селеновых выпрямителей относятся их значительные габариты.
Селен применяется как мощное противораковое средство, а также для профилактики широкого спектра заболеваний. Согласно исследованиям прием 200 мкг селена в сутки снижает риск заболеваемости раком прямой и толстой кишки — на 58 %, опухолями простаты на 63 %, раком легких — на 46 %, снижает общую смертность от онкологических заболеваний на 39 %.
Малые концентрации селена подавляют гистамин и за счет этого оказывают антидистрофический эффект и противоаллергическое действие. Также селен стимулирует пролиферацию тканей, улучшает функцию половых желез, сердца, щитовидной железы, иммунной системы.
В комплексе с йодом селен используется для лечения иододефицитных заболеваний и патологий щитовидной железы.
Соли селена способствуют восстановлению пониженного артериального давления при шоке и коллапсе
Se, химический элемент VI группы периодической системы Менделеева; атомный номер 34, атомная масса 78, 96; преимущественно неметалл (См. Неметаллы). Природный С. представляет собой смесь шести устойчивых изотопов (%) — 74 Se (0,87), 76 Se (9,02), 77 Se (7,58), 78 Se (23,52), 80 Se (49,82), 82 Se (9,19). Из 16 радиоактивных изотопов наибольшее значение имеет 75 Se с периодом полураспада 121 сут. Элемент открыт в 1817 И. Берцелиусом (название дано от греч. selene — Луна).
Распространение в природе. С. — очень редкий и рассеянный элемент, его содержание в земной коре (кларк) 5․10 -6 % по массе. История С. в земной коре тесно связана с историей серы (См. Сера). С. обладает способностью к концентрации и, несмотря на низкий кларк, образует 38 самостоятельных минералов — селенидов природных (См. Селениды природные), селенитов, селенатов и др. Характерны изоморфные примеси С. в сульфидах и самородной сере.
В биосфере С. энергично мигрирует. Источником для накопления С. в живых организмах служат изверженные горные породы, вулканические дымы, вулканические термальные воды. Поэтому в районах современного и древнего вулканизма почвы и осадочные породы нередко обогащены С. (в среднем в глинах и сланцах — 6․10 -5 %).
Физические и химические свойства. Конфигурация внешней электронной оболочки атома Se 4s 2 4p 4 ; у двух р-электронов спины спарены, а у остальных двух — не спарены, поэтому атомы С. способны образовывать молекулы Se2 или цепочки атомов Sen. Цепи атомов С. могут замыкаться в кольцевые молекулы Se8. Разнообразие молекулярного строения обусловливает существование С. в различных аллотропических модификациях: аморфной (порошкообразный, коллоидный, стекловидный) и кристаллический (моноклинный α-и β-формы и гексагональный γ-формы). Аморфный (красный) порошкообразный и коллоидный С. (плотность 4,25 г/см 3 при 25 °С) получают при восстановлении из раствора селенистой кислоты H2SeO3, быстрым охлаждением паров С. и др. способами. Стекловидный (чёрный) С. (плотность 4,28 г/см 3 при 25 °С) получают при нагревании любой модификации С. выше 220 °С с последующим быстрым охлаждением. Стекловидный С. обладает стеклянным блеском, хрупок. Термодинамически наиболее устойчив гексагональный (серый) С. Он получается из других форм С. нагреванием до плавления с медленным охлаждением до 180—210 °С и выдержкой при этой температуре. Решётка его построена из расположенных параллельно спиральных цепочек атомов. Атомы внутри цепей связаны ковалентно. Постоянные решётки а = 4,36 Å, с = 4,95 Å, атомный радиус 1,6 Å, ионные радиусы Se 2- 1,98 Å и Se 4+ 0,69 Å, плотность 4,807 г/см 3 при 20 °С, tпл 217 °С, tkип 685 °С. Пары С. желтоватого цвета. В парах в равновесии находятся четыре полимерные формы Se8 ⇔ Se6 ⇔ Se4 ⇔ Se2. Выше 900 °С доминирует Se2. Удельная теплоёмкость гексагонального С. 0,19—0,32 кдж/(кг․К), [0,0463—0,0767 кал/(г․°С)] при —198 — +25 °С и 0,34 кдж/(кг․К) [0,81 кал/(г․°С)] при 217 °С; коэффициент теплопроводности 2,344 вт/(м․К) [0,0056 кал/(см․сек․°С)], температурный коэффициент линейного расширения при 20 °С: гексагонального монокристаллического С. вдоль с-оси 17,88․10 -6 , перпендикулярно с-оси 74,09․10 -6 , поликристаллического 49,27․10 -6 ; изотермическая сжимаемость β0=11,3․ 10 -3 кбар -1 , коэффициент электрического сопротивления в темноте при 20 °С 10 2 —10 12 ом см. Все модификации С. обладают фотоэлектрическими свойствами. Гексагональный С. вплоть до температуры плавления — примесный полупроводник с дырочной проводимостью. С. — диамагнетик (пары его парамагнитны). На воздухе С. устойчив; кислород, вода, соляная и разбавленная серная кислоты на него не действуют, хорошо растворим в концентрированной азотной кислоте и царской водке, в щелочах растворяется с окислением. С. в соединениях имеет степени окисления —2, +2, +4, +6. Энергия ионизации Se 0 →Se 1+ →Se 2+ →S 3+ соответственно 0,75; 21,5; 32 эв.
С кислородом С. образует ряд окислов: SeO, Se2O5, SeO2, SeO3. Два последних являются ангидридами селенистой H2SeO3 и селеновой H2SeO4 к-т (соли — селениты и селенаты). Наиболее устойчив SeO2. С галогенами С. даёт соединения SeF6, SeF4, SeCl4, SeBr4, Se2Cl2 и др. Сера и теллур образуют непрерывный ряд твёрдых растворов с С. С азотом С. даёт Se4N4, с углеродом — CSe2. Известны соединения с фосфором P2Se3, P4Se3, P2Se5. Водород взаимодействует с С. при t ≥ 200 °С, образуя H2Se; раствор H2Se в воде называется селеноводородной кислотой. При взаимодействии с металлами С. образует Селениды. Получены многочисленные комплексные соединения С. Все соединения С. ядовиты.
Получение и применение. С. получают из отходов сернокислотного, целлюлозно-бумажного производства и анодных шламов электролитического рафинирования меди. В шламах С. присутствует вместе с серой, теллуром, тяжёлыми и благородными металлами. Для извлечения С. шламы фильтруют и подвергают либо окислительному обжигу (около 700 °С), либо нагреванию с концентрированной серной кислотой. Образующийся летучий SeO2 улавливают в скрубберах и электрофильтрах. Из растворов технический С. осаждают сернистым газом. Применяют также спекание шлама с содой с последующим выщелачиванием селената натрия водой и выделением из раствора С. Для получения С. высокой чистоты, используемого в качестве полупроводникового материала, черновой С. рафинируют методами перегонки в вакууме, перекристаллизации и др.
Благодаря дешевизне и надёжности С. используется в преобразовательной технике в выпрямительных полупроводниковых диодах, а также для фотоэлектрических приборов (гексагональный), электрофотографических копировальных устройств (аморфный С.), синтеза различных селенидов, в качестве люминофоров в телевидении, оптических и сигнальных приборах, терморезисторах и т. п. С. широко применяется для обесцвечивания зелёного стекла и получения рубиновых стекол; в металлургии — для придания литой стали мелкозернистой структуры, улучшения механических свойств нержавеющих сталей; в химической промышленности — в качестве катализатора; используется С. также в фармацевтической промышленности и других отраслях.
С. в организме. Большинство живых существ содержит в тканях от 0,01 до 1 мг/кг С. Концентрируют его некоторые микроорганизмы, грибы, морские организмы и растения. Известны бобовые (например, астрагал, нептуния, акация), крестоцветные, мареновые, сложноцветные, накапливающие С. до 1000 мг/кг (на сухую массу); для некоторых растений С. — необходимый элемент. В растениях-концентраторах обнаружены различные селеноорганические соединения, главным образом селеновые аналоги серусодержащих аминокислот — селенцистатионин, селенгомоцистеин, метилселенметионин. Важную роль в биогенной миграции С. играют микроорганизмы, восстанавливающие селениты до металлического С. и окисляющие селениды. Существуют Биогеохимические провинции С.
Потребность человека и животных в С. не превышает 50—100 мкг/кг рациона. Он обладает антиоксидантными свойствами, повышает восприятие света сетчаткой глаза, влияет на многие ферментативные реакции. При содержании С. в рационе более 2 мг/кг у животных возникают острые и хронические формы отравлений. Высокие концентрации С. ингибируют окислительно-восстановительные ферменты, нарушают синтез метионина и рост опорно-покровных тканей, вызывают анемию. С недостатком С. в кормах связывают появление т. н. беломышечной болезни животных, некротической дегенерации печени, экссудативного диатеза; для предупреждения этих заболеваний используют селенит натрия.
Лит.: Синдеева Н. Д., Минералогия, типы месторождений и основные черты геохимии селена и теллура, М., 1959; Кудрявцев А. А., Химия и технология селена и теллура, 2 изд., М., 1968; Чижиков Д. М., Счастливый В. ГГ., Селен и селениды, М., 1964; Абдуллаjeв Ћ. Б., Селендэ вэ селен дузлэндиоичилэ риндз физики просеслэрин тэдгиги, Бакы, 1959; Селен и зрение, Баку, 1972; Абдуллаев Г. Б., Абдинов Д. Ш., Физика селена, Баку, 1975; Букетов Е. А., Малышев В. П., Извлечение селена и теллура из медеэлектролитных шламов, А.-А., 1969; Recent advances in selenium physics, Oxf. — [a. o.], [1965]; The physics of selenium and tellurium, Oxf. — [a. o.], [1969]; Ермаков В. В., Ковальский В. В., Биологическое значение селена, М., 1974; Rosenfeld I., Beath O. A., Selenium, N. Y. — L., 1964.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Селен (Se) - общая характеристика и свойства химического элемента
Химия помогает узнать больше об окружающем мире. Работа с таблицей Менделеева начинается с изучения химических элементов. Селен всё ещё представляется для людей одним из самых загадочных и многоликих минеральных веществ. Его обнаружили не только в природе, но и в теле человека.
- История элемента
- Нахождение в природе и получение
- Строение атома и структура
- Физические особенности
- Химические свойства
- Меры безопасности
- Сферы применения
- Значение для человека
- Полезные продукты

История элемента

Элемент был открыт Й. Я. Берцелиусом в 1817 году. Шведский химик и минералог проводил опыты с серной кислотой вместе с Я. Г. Ганом. Учёные обнаружили в веществе красновато-коричневый осадок с редечным запахом, который тогда служил определением присутствия теллура. Берцелиус решил исследовать осадок, надеясь обнаружить новый металл. После изучения этого явления он смог выявить неизвестное вещество, которое по свойствам напоминало теллур. Поскольку второй элемент был назван в честь Земли, химик назвал новый элемент Selenium (селен), что переводится с латинского «Луна».
В 1873 году Уиллоуби Смит доказал, что электрическое сопротивление элемента зависит от освещённости. Через несколько лет были разработаны первые продукты в виде ячеек на основе селена, которые использовали в фотофоне, созданном А. Г. Беллом. С помощью химического элемента можно было изменять электропроводимость световых лучей, которые отражались от зеркала под влиянием звука. Полезное свойство селена позволило использовать его в разных измерителях освещённости.
В первой половине XX века начали производить выпрямители на основе этого элемента, которые заменили медно-закисные изделия. Полупроводниковые диоды широко использовали до 1970-х годов.
Когда начали происходить массовые отравления работников на селеновых заводах и животных, поедавших траву около этих предприятий, люди поняли, что химический элемент токсичен. В середине прошлого века учёные раскрыли биологическое значение вещества для живых организмов.
Нахождение в природе и получение

Неметалл в объёме 500 мг/т содержится в земной коре. Основные черты вещества можно определить по близкому отношению ионных радиусов селена и серы. С «лунным» элементом образуются 37 минералов, включая ашавалит, гуанахуатит, клаусталит, платинит, тиманнит и хастит. Селен в виде самородков встречается довольно редко. Его минералы можно найти чаще, но добывают материал в основном из сульфидов. В этих соединениях объём неметалла варьируется в пределах чисел 7−100 г/т. В морской воде концентрация вещества составляет 0,4 мкг/л.
Основным источником неметалла выступают шламы свинцовых камер и пыль, которая образуется при обжиге сульфидов с соответствующим веществом. Сырьё обрабатывают концентрированной серной кислотой с нитратом натрия. В результате реакции образуется селенистая кислота с формулой H2SeO3 и в небольшом объёме селеновая кислота (H2SeO4). Затем селенистую кислоту обрабатывают сернистым газом и получают элементарный селен и серную кислоту.
Чтобы очистить полученный осадок, его сжигают в кислороде, который насыщают парами азотной кислоты. В результате получается чистый диоксид селена. В раствор SeO2 добавляют соляную кислоту, а затем пропускают через него сернистый газ, осаждая нужный элемент. Полученное вещество переплавляют, фильтруют через стеклоткань или активированный уголь. Последняя стадия очистки элемента подразумевает дистилляцию в вакууме.
Строение атома и структура
Селен состоит в 4-м периоде VI группы химических элементов. Неметалл имеет порядковый номер 34, его обозначение в таблице — Se. Атомная масса составляет 78,96 а. е. м., электронная формула селена — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 . Атом химического элемента имеет ядро с положительным зарядом +34. В него входят 34 протона, 45 нейронов и 34 электрона, которые движутся по 3-м орбитам.
Элемент отличается интересной конфигурацией. На внешнем энергетическом уровне располагаются 6 валентных отрицательно заряженных частиц. Поскольку в атоме селена есть два неспаренных электрона, это говорит о его ковалентности.
Вещество может быть представлено в двух модификациях:
- кристаллическая (моноклинный и гексагональный селен);
- аморфная.
Во втором случае неметалл имеет порошкообразную, коллоидную или стекловидную форму. Аморфная модификация неустойчива. Красный порошкообразный или коллоидный селен образуется при восстановлении из раствора селенистой кислоты. Чтобы получить стекловидную форму чёрного цвета, вещество любой модификации нагревают до температуры 220 °C, а потом сразу же охлаждают.
Гексагональный селен тёмно-серого оттенка устойчив в термодинамических условиях. Любую форму вещества нагревают до температуры плавления и затем охлаждают до 180−200°C, выдерживая этот показатель определённый период.
Физические особенности
Селен относится к группе халькогенов. Неметалл представляет собой хрупкое и непрозрачное вещество чёрного цвета. В неустойчивой форме он имеет оттенок киноварь. Обладает металлическим блеском.
Основные характеристики селена в гексагональной модификации:
- твёрдость по шкале Мооса — 2;
- плотность — 4,8 г/см 3 ;
- температура плавления — 217 °C;
- температура кипения — 685−688°C;
- цвет черты — красный.

Гибкий материал относится к диамагнетикам. Он характеризуется высоким оптическим рельефом и анизотропией. Цвет минерала в воздухе — белый. В иммерсии (микроскопическое наблюдение) оттенок становится темнее и может быть серовато-коричневым. Только на просвет химический элемент приобретает красную окраску.
Химические свойства

Так как неметалл характеризуется двумя неспаренными электронами, степень окисления селена равна +2. Но у вещества есть вакантные орбитали на четвёртом уровне 4d-подуровня. Это говорит о том, что элемент может находиться в возбуждённом состоянии, при котором степень окисления меняется на +4.
По химическим свойствам неметалл близок к теллуру и сере, занимая промежуточное место между ними. Однако в соединениях со степенью окисления -2 он служит сильным восстановителем, а с показателем +6 — окислителем. Простое вещество селен отличается меньшей активностью, чем сера. Элемент способен гореть в воздухе самостоятельно. Окисление неметалла происходит только при нагревании. Вещество горит синим пламенем. Бурные реакции с селеном наблюдаются при взаимодействии с щелочными металлами.
Химический элемент может образовывать с кислородом несколько оксидов. SeO2 и SeO3 выступают ангидридами селеновой и селенистой кислот, с которыми получают селенат и селенит. Также неметалл может образовывать SeO и SeO5. Диоксид селена (SeO2) представляет собой кристаллическое вещество. Он хорошо растворяется в воде и считается довольно устойчивым соединением.
Меры безопасности

«Лунный» элемент относится к третьему классу опасности, поэтому с токсичным веществом и его соединениями следует работать осторожно. По характеру воздействия на человеческий организм селен напоминает мышьяк. Он может поражать печень, почки и ЦНС. В металлической форме вещество менее токсично. Наиболее опасными соединениями считаются диоксид селена, селеноводород и селениты натрия или лития.
Если вещество в форме металлического порошка попало в организм через рот, тогда у человека возникнут сильные боли в животе и диарея. Пострадавшему не потребуется помощь, если объём токсичного материала не превышал 1 г. Через какое-то время симптомы пройдут самостоятельно.
На кожном покрове могут возникнуть ожоги или аллергическая реакция в виде дерматита при контакте с солями неметалла. Диоксид селена вызывает резкую боль и онемение. Соединения химического элемента могут сильно раздражить слизистые оболочки. Также они вызывают покраснения, а при попадании в органы зрения — режущую боль, слезотечение и конъюнктивит.
Сферы применения
Селен, а также его соединения и сплавы широко используются в качестве полупроводника для выпрямителей переменного тока. В современной технологии применяют селениды висмута, олова, свинца, сурьмы.
Неметалл используется и в других областях:

- Это вещество необходимо при создании фототехники.
- В виде источника излучения для дефектоскопии применяют радиоактивный изотоп селен-75.
- Селен может использоваться как наполнитель в резиновой промышленности.
- В металлургии элемент необходим для придания полученным сплавам мелкозернистой структуры.
- В стекольной промышленности вещество используется для обесцвечивания или окрашивания прозрачного материала в красные или розовые оттенки. Обычно для этого выбирают металлическую форму элемента или селенистокислый натрий. Селеном окрашены рубиновые звёзды Московского Кремля.
- Материал применяется и в производстве керамических изделий, которым он придаёт красноватые оттенки. Также этим веществом окрашивают эмали.
Хотя селен относится к токсичным веществам, он может использоваться и в сфере медицины благодаря своим антиоксидантным свойствам. Неметалл выступает мощным противораковым средством. Препараты с селеном применяют в профилактике развития различных болезней. В малых концентрациях вещество подавляет гистамин. Селен обладает противоаллергическим и антидистрофическим эффектом. Соли неметалла избавляют от гипотонии при шоке и коллапсе.
Значение для человека

Селен — жизненно необходимый для живых организмов микроэлемент. Он содержится в активных центрах некоторых белков в виде аминокислот селеноцистеина. Объём вещества в человеческом организме составляет 10−14 мг. Основная часть находится в печени, почках, селезёнке, яичках и семенных канатиках у мужчин. В небольших количествах микроэлемент присутствует в костном мозге, сердце, лёгких, коже, волосах и ногтях.
Вещество взаимодействует с различными витаминами и ферментами. Он обнаружен в составе более 30 биологических соединений. Благодаря учёным удалось узнать о пользе и вреде селена для организма человека:

- Микроэлемент восстанавливает работу нервной и эндокринной системы.
- Препараты с этим веществом усиливают иммунитет.
- Селен улучшает функцию сосудов и препятствует развитию сердечно-сосудистых патологий.
- Сильный антиоксидант тормозит старение организма и выводит из него чужеродные вещества.
- Неметалл снижает возможность развития злокачественных опухолей.
- Он улучшает работу половых желёз и стимулирует репродуктивную функцию.
- Селен нормализует процессы обменов в человеческом организме и защищает его от возможного токсического действия кадмия, ртути, свинца, серебра и таллия.
- Вещество уменьшает боли при воспалениях.
Микроэлемент также участвует в обмене белков, жиров и углеводов. Без него не обходятся окислительно-восстановительные процессы. Из занимательных фактов о селене нужно отметить, что он контролирует весь цикл жизни клетки.
Полезные продукты
Для людей суточная норма селена составляет 70−110 мкг. Объём зависит от возраста и половой принадлежности человека. Для взрослых мужчин максимальное количество вещества в день составляет 140 мкг.
Селеном богаты продукты как животного, так и растительного происхождения:

- злаковые культуры;
- масло оливы;
- орехи;
- томаты;
- маслины;
- чеснок;
- грибы; и другие морепродукты;
- говяжьи почки и печень;
- морская соль;
- ржаной хлеб;
- яйца курицы.

Повышенное содержание микроэлемента в человеческом организме может вызвать тошноту, рвоту или понос. В некоторых случаях развивается депрессия. На избыток вещества указывают такие симптомы, как желтушность и шелушение кожи, разрушение ногтей, выпадающие волосы, отсутствие аппетита, постоянная усталость и расстройства ЦНС. Если в организме повышается объём ртути, меди или сульфатов, тогда наблюдается недостаток селена. К дефициту элемента может привести применение медикаментозных средств от малярии.
Селен выполняет важную роль не только в различных сферах жизни человека, но и в его организме. С правильным рационом получится поддерживать объём вещества на нужном уровне.

Черные, серые и красные аллотропные модификации
Селе́н / Selenium (Se), 34
[Ar] 3d 10 4s 2 4p 4
2,55 (шкала Полинга)
a =4,364; c =4,959 Å
Селе́н — химический элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), 4-го периода в периодической системе, имеет атомный номер 34, обозначается символом Se (лат. Selenium ), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная). CAS-номер: 7782-49-2.
Содержание
История
Сохранился рассказ самого Берцелиуса о том, как произошло это открытие:
Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты [2] .
Происхождение названия
Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Нахождение в природе


Содержание селена в земной коре около 500 мг/т. Основные черты геохимии селена в земной коре определяются близостью его ионного радиуса к ионному радиусу серы. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se, S)3, хастит CoSe2, платинит PbBi2(S, Se)3, ассоциирующие с различными сульфидами, а иногда также с касситеритом. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4·10 −4 мг/л [3] .
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Физические свойства
.jpg/375px-%D0%9C%D0%BE%D0%BD%D0%BE%D0%BA%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%81%D0%B5%D0%BB%D0%B5%D0%BD_(99%2C9999_%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D0%BD%D1%82%D0%BE%D0%B2).jpg)
Твёрдый селен имеет несколько аллотропных модификаций. Наиболее устойчивой модификацией является серый селен. Красный селен представляет собой менее устойчивую аморфную модификацию.
При нагревании серого селена [4] он даёт серый же расплав, а при дальнейшем нагревании испаряется с образованием коричневых паров. При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
Селен — аналог серы и проявляет степени окисления −2 (H2Se), +4 (SeO2) и +6 (H2SeO4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (-2) — гораздо более сильные восстановители, чем соответствующие соединения серы.
Простое вещество — селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно [5] . Окислить селен удаётся только при дополнительном нагревании, при котором он медленно горит синим пламенем, превращаясь в двуокись SeO2. Со щелочными металлами селен реагирует (весьма бурно) только будучи расплавленным [6] .
В отличие от SO2, SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 7 ноября 2012.
- Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
В современной технологии полупроводников применяются селениды многих элементов, например селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
- В медицине, а также в сельском хозяйстве используют микродобавки селена к лекарственным средствам, витаминным препаратам, БАД, и т. п.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл, Ливерморская национальная лаборатория им. Лоуренса, Ливермор, США).
Биологическая роль
Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Изотопы
В природе существует 6 изотопов селена ( 74 Se, 76 Se, 77 Se, 78 Se, 80 Se и 82 Se), из них пять, насколько это известно, стабильны, а один ( 82 Se) испытывает двойной бета-распад с периодом полураспада 9,7·10 19 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94.
Периоды полураспада некоторых радиоактивных изотопов селена:
| Изотоп | Распространённость в природе, % | Период полураспада |
|---|---|---|
| 73 Se | — | 7,1 час. |
| 74 Se | 0,87 | — |
| 75 Se | — | 120,4 сут. |
| 76 Se | 9,02 | — |
| 77 Se | 7,58 | — |
| 77m Se | — | 17,5 сек. |
| 78 Se | 23,52 | — |
| 79 Se | — | 6,5·10 4 лет |
| 79m Se | — | 3,91 мин. |
| 80 Se | 49,82 | — |
| 81 Se | — | 18,6 мин. |
| 81m Se | — | 62 мин. |
| 82 Se | 9,19 | 9,7·10 19 лет |
| 83m Se | — | 69 сек. |
| 83 Se | — | 25 мин. |
См. также
Примечания
Ссылки
- Химические элементы
- Высокоопасные вещества
- Селен
- Радиоактивные элементы
Wikimedia Foundation . 2010 .
Читайте также:
