Серебристо серый металл который притягивается магнитом
Обновлено: 18.05.2024
Тренажер задания 31 из ЕГЭ по химии железа, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии железа с текстовыми решениями и ответами.
1. Соль, полученную при растворении железа в концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
2. Осадок, полученный при взаимодействии хлорида железа (III) и нитрата серебра отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Напишите уравнения описанных реакций.
2FeCl3 + 3Na2S = S↓ + 2FeS↓ + 6NaCl
4. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной стружкой. Продукт реакции растворили в воде и добавили к нему раствор гидроксида цезия. Образовавшийся осадок отфильтровали и прокалили. Напишите уравнения описанных реакций.
5. Простое вещество, полученное при нагревании железной окалины в токе угарного газа, сплавили с серой, и продукт этой реакции подвергли обжигу. Образовавшийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
6. Раствор хлорида железа (III) обработали избытком раствора гидроксида калия. Осадок бурого цвета, образовавшийся в качестве продукта реакции, отфильтровали и прокалили. Вещество, образовавшееся при прокаливании, растворили в концентрированной азотной кислоте. Полученную соль обработали раствором гидрокарбоната калия. Напишите уравнения описанных реакций.
7. На раствор хлорного железа подействовали раствором едкого натра, выпавший осадок отделили и нагрели. Твердый продукт реакции смешали с кальцинированной содой и прокалили. К оставшемуся веществу добавили нитрат и гидроксид натрия, и длительное время нагревали при высокой температуре. Напишите уравнения описанных реакций.
8. Оксид двухвалентного железа нагрели с разбавленной азотной кислотой. Раствор осторожно выпарили, твердый остаток растворили в воде, в полученный раствор внесли железный порошок и через некоторое время профильтровали. К фильтрату добавили раствор едкого кали, выпавший осадок отделили и оставили на воздухе, при этом цвет вещества изменился. Напишите уравнения описанных реакций.
9. Хлористое железо обработали при нагревании концентрированной азотной кислотой и раствор осторожно выпарили. Твердый продукт растворили в воде, добавили к полученному раствору поташ и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании газообразный водород. При этом образовалось вещество бурого цвета. Напишите уравнения описанных реакций.
10. К раствору хлорного железа добавили кальцинированную соду и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании угарный газ и твердый продукт последней реакции ввели во взаимодействие с бромом. Напишите уравнения описанных реакций.
11. Железную окалину растворили в концентрированной азотной кислоте при нагревании. Раствор осторожно выпарили, и продукт реакции растворили в воде. К полученному раствору добавили железный порошок, через некоторое время раствор отфильтровали, и фильтрат обработали раствором едкого кали, в результате выделился осадок светло-зеленого цвета, который быстро темнеет на воздухе. Напишите уравнения описанных реакций.
12. К раствору хлорного железа добавили железный порошок и через некоторое время раствор профильтровали. К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
13. Нерастворимое вещество, образующееся при добавлении в раствор хлористого железа едкого натра, отделили и растворили в разбавленной серной кислоте. В полученный раствор добавили цинковую пыль, выделившийся осадок отфильтровали и растворили в концентрированной соляной кислоте. Напишите уравнения описанных реакций.
14. Железный порошок растворили в большом количестве разбавленной серной кислоты и через полученный раствор пропустили воздух, а затем газ с запахом тухлых яиц. Образовавшуюся нерастворимую соль отделили и растворили в горячем растворе концентрированной азотной кислоты. Напишите уравнения описанных реакций.
15. Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щелочью образуется объемный осадок белого (светло-зеленого) цвета. При обжиге вещества А образуются два оксида. Один из них – газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
16. Серебристо-серый металл, который притягивается магнитом, внесли в горячую концентрированную серную кислоту и нагрели. Раствор охладили и добавили едкий натр до прекращения образования аморфного осадка бурого цвета. Осадок отделили, прокалили и растворили в концентрированной соляной кислоте при нагревании. Напишите уравнения описанных реакций.
17. Вещество, полученное при нагревании железной окалины в атмосфере водорода, внесли в горячую концентрированную кислоту и нагрели. Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
18. Раствор хлорида железа (III) смешали с раствором карбоната калия. Осадок бурого цвета, образовавшийся при этом, отфильтровали, и сплавили с гидроксидом натрия. Полученное вещество обработали избытком раствора серной кислоты, которое необходимо для образования прозрачного раствора. Затем в полученный раствор добавили избыток сульфида калия. Напишите уравнения описанных реакций.
19. Железо сожгли в хлоре. Продукт реакции растворили в воде и в раствор внесли железные опилки. Через некоторое время раствор профильтровали и в фильтрат добавили сульфид натрия. Выделившийся осадок отделили и обработали 20%-ной серной кислотой, получив почти бесцветный раствор. Напишите уравнения описанных реакций.
20. Смесь железного порошка и твердого продукта, полученного при взаимодействии сернистого газа и сероводорода, нагрели без доступа воздуха. Полученный продукт подвергли обжигу на воздухе. Образовавшееся твердое вещество реагирует с алюминием с выделением большого количества тепла. Напишите уравнения описанных реакций.
21. Оксид железа (III) сплавили с содой. Полученный продукт внесли в воду. Выпавший осадок растворили в иодоводородной кислоте. Выделившийся галоген связали тиосульфатом натрия. Напишите уравнения описанных реакций.
22. Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Напишите уравнения описанных реакций.
23. Пирит подвергли обжигу, полученный газ с резким запахом пропустили через сероводородную кислоту. Образовавшийся желтоватый осадок отфильтровали, просушили, смешали с концентрированной азотной кислотой и нагрели. Полученный раствор дает осадок с нитратом бария. Напишите уравнения описанных реакций.
24. Железные опилки растворили в разбавленной серной кислоте, полученный раствор обработали избытком раствора гидроксида натрия. Образовавшийся осадок профильтровали и оставили на воздухе до тех пор, пока он не приобрел бурую окраску. Бурое вещество прокалили до постоянной массы. Напишите уравнения описанных реакций.
25. Провели электролиз раствора хлорида натрия. К полученному раствору добавили хлорид железа (III). Выпавший осадок отфильтровали и прокалили. Твердый остаток растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.

26. Хлорат калия нагрели в присутствии катализатора, при этом выделился бесцветный газ. Сжиганием железа в атмосфере этого газа была получена железная окалина. Ее растворили в разбавленной соляной кислоте. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту. Напишите уравнения описанных реакций.
27. Железо сожгли в хлоре. Полученную соль добавили к раствору карбоната натрия, при этом выпал бурый осадок. Этот осадок отфильтровали и прокалили. Полученное вещество растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.
28. Серу сплавили с железом. Продукт реакции обработали соляной кислотой. Выделившийся при этом газ сожгли в избытке кислорода. Продукты горения поглотили водным раствором сульфата железа (III). Напишите уравнения описанных реакций.
29. В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа (III). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли обработали избытком раствора сульфида калия. Напишите уравнения описанных реакций.
30. Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовавшийся бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.
31. Железо растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора карбоната натрия. Выделившийся осадок отфильтровали и прокалили. Полученное вещество растерли в мелкий порошок вместе с алюминием и смесь подожгли. Она сгорела с выделением большого количества теплоты. Напишите уравнения описанных реакций.
32. Порошок железа нагрели с порошком серы. Продукт реакции растворили в соляной кислоте, и к раствору добавили избыток щелочи. Выпавший осадок прокалили в атмосфере азота. Напишите уравнения описанных реакций.
33. Железо сожгли в атмосфере хлора. Полученную соль растворили в воде и добавили к ней раствор йодида калия. Выпавший осадок простого вещества отделили и разделили на две части. Первую обработали разбавленной азотной кислотой, а вторую нагрели в атмосфере водорода. Напишите уравнения описанных реакций.
34. Железо растворили в соляной кислоте, к полученному раствору добавили гидроксид натрия до прекращения выпадения осадка. В полученную реакционную массу вначале пропустили кислород, а затем добавили иодоводородной кислоты до прекращения выпадения осадка. Напишите уравнения описанных реакций.
35. Осадок, полученный при взаимодействии растворов сульфата железа (III) и нитрата бария, отфильтровали. Фильтрат обработали избытком едкого натрия. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
Тренажер задания 31 ЕГЭ по химии железа
Какие металлы не магнитятся и почему?

Любой ребенок знает, что металлы притягиваются к магнитам. Ведь они не раз вешали магнитики на металлическую дверцу холодильника или буквы с магнитиками на специальную доску. Однако, если приложить ложку к магниту, притяжения не будет. Но ведь ложка тоже металлическая, почему тогда так происходит? Итак, давайте выясним, какие металлы не магнитятся.
Научная точка зрения
Чтобы определить, какие металлы не магнитятся, нужно выяснить, как все металлы вообще могут относиться к магнитам и магнитному полю. По отношению к внесенному магнитному полю все вещества делят на диамагнетики, парамагнетики и ферромагнетики.
Каждый атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Они непрерывно движутся, что создает магнитное поле. Магнитные поля электронов одного атома могут усиливать друг друга или уничтожать, что зависит от направления их движения. Причем скомпенсированы могут быть:
- Магнитные моменты, вызванные движением электронов относительно ядра – орбитальные.
- Магнитные моменты, вызванные вращением электронов вокруг своей оси - спиновые.
Если все магнитные моменты равны нулю, вещество относят к диамагнетикам. Если скомпенсированы только спиновые моменты - к парамагнетикам. Если поля не скомпенсированы – к ферромагнетикам.

Парамагнетики и ферромагнетики
Рассмотрим вариант, когда у каждого атома вещества есть свое магнитное поле. Эти поля разнонаправлены и компенсируют друг друга. Если же рядом с таким веществом положить магнит, то поля сориентируются в одном направлении. У вещества появится магнитное поле, положительный и отрицательный полюс. Тогда вещество притянется к магниту и само может намагнититься, то есть будет притягивать другие металлические предметы. Так, например, можно намагнитить дома стальные скрепки. У каждой появится отрицательный и положительный полюс и можно будет даже подвесить целую цепочку из скрепок на магнит. Такие вещества называют парамагнитными.
Ферромагнетики - небольшая группа веществ, которые притягиваются к магнитам и легко намагничиваются даже в слабом поле.
Диамагнетики
У диамагнетиков магнитные поля внутри каждого атома скомпенсированы. В этом случае при внесении вещества в магнитное поле к собственному движению электронов добавится движение электронов под действием поля. Это движение электронов вызовет дополнительный ток, магнитное поле которого будет направлено против внешнего поля. Поэтому диамагнетик будет слабо отталкиваться от расположенного рядом магнита.
Итак, если подойти с научной точки зрения к вопросу, какие металлы не магнитятся, ответ будет – диамагнитные.
Распределение парамагнетиков и диамагнетиков в периодической системе элементов Менделеева
Магнитные свойства простых веществ периодично изменяются с увеличением порядкового номера элемента.
Вещества, не притягивающиеся к магнитам (диамагнетики), располагаются преимущественно в коротких периодах – 1, 2, 3. Какие металлы не магнитятся? Это литий и бериллий, а натрий, магний и алюминий уже относят к парамагнетикам.

Вещества, притягивающиеся к магнитам (парамагнетики), расположены преимущественно в длинных периодах периодической системы Менделеева – 4, 5, 6, 7.
Однако последние 8 элементов в каждом длинном периоде также являются диамагнетиками.
Кроме того, выделяют три элемента – углерод, кислород и олово, магнитные свойства которых различны у разных аллотропных модификаций.
К тому же называют еще 25 химических элементов, магнитные свойства которых установить не удалось вследствие их радиоактивности и быстрого распада или сложности синтеза.
Магнитные свойства лантаноидов и актиноидов (все они являются металлами) меняются незакономерно. Среди них есть и пара- и диамагнетики.
Выделяют особые магнитоупорядоченные вещества – хром, марганец, железо, кобальт, никель, свойства которых изменяются незакономерно.
Какие металлы не магнитятся: список
Ферромагнетиков, то есть металлов, которые хорошо магнитятся, в природе существует всего 9. Это железо, кобальт, никель, их сплавы и соединения, а также шесть металлов- лантаноидов: гадолиний, тербий, диспрозий, гольмий, эрбий и тулий.
Металлы, притягивающиеся только к очень сильным магнитам (парамагнетики): алюминий, медь, платина, уран.
Поскольку в быту не встречаются настолько большие магниты, которые бы притянули парамагнетик, а также не встречаются металлы-лантаноиды, можно смело утверждать, что все металлы, кроме железа, кобальта, никеля и их сплавов не будут притягиваться к магнитам.
Итак, какие металлы не магнитятся к магниту:
- парамагнетики: алюминий, платина, хром, магний, вольфрам;
- диамагнетики: медь, золото, серебро, цинк, ртуть, кадмий, цирконий.
В целом можно сказать, что черные металлы притягиваются к магниту, цветные – не притягиваются.
Если говорить о сплавах, то сплавы железа магнитятся. К ним относят в первую очередь сталь и чугун. К магниту могут притянуться и драгоценные монеты, поскольку они изготовлены не из чистого цветного металла, а из сплава, который может содержать небольшое количество ферромагнетика. А вот украшения из чистого цветного металла к магниту не притянутся.

Какие металлы не ржавеют и не магнитятся? Это обычная пищевая нержавейка, золотые и серебряные изделия.
Какие драгоценные металлы Магнитятся?
Магнитное поле с определенным уровнем своей напряженности (Н) действует на помещенные в него тела таким образом, что намагничивает их. При этом интенсивность такого намагничивания, которая обозначается буквой J, прямо пропорциональна напряженности поля. В формуле, по которой вычисляется интенсивность намагничивания определенного вещества (J = ϞH), также учитывается коэффициент пропорциональности Ϟ – магнитная восприимчивость вещества.
В зависимости от значения данного коэффициента все материалы могут входить в одну из трех категорий:
- парамагнетики – коэффициент Ϟ больше нуля;
- диамагнетики – Ϟ равен нулю;
- ферромагнетики – вещества, магнитная восприимчивость которых отличается значительной величиной (такие вещества, к которым, в частности, относятся железо, кобальт, никель и кадмий, способны активно намагничиваться, даже будучи помещенными в слабые магнитные поля).

Направления действия магнитных моментов соседних атомов в веществах различной магнитной природы
Магнитные свойства, которыми обладает нержавейка, связаны еще и с ее внутренней структурой, которая может включать в себя аустенит, феррит и мартенсит, а также их комбинации. При этом на магнитные свойства нержавейки оказывают влияние как сами фазовые составляющие, так и то, в каком соотношении они находятся во внутренней структуре.
Нержавейка, которая не магнитится
Очень часто для производства антикоррозийной стали используются сплавы с большим содержанием хрома, никеля и марганца. Из них производится большое количество различного оборудования и изделий для применения в разных сферах. К немагнитным сталям относятся:
- Аустенитные. Из них делают оснащение для судов, холодильников, пищевой промышленности, посуду для кухни и сантехническое оборудование.
- Аустенитно-ферритные. Основные достоинства таких сплавов – это прочность и повышенная стойкость к растрескиванию.
Магнитится ли алюминий?
Чугун – это сплав железа с достаточным содержанием углерода (от 2,14 до 6,67 %).
Концентрация добавленного вещества влияет на ковкость, пластичность и твердость металла, поэтому из сплава железа и менее 2,14 % углерода получают сталь.
Чугунный сплав очень тверд и хрупок, плохо поддается отливке и обработке режущими инструментами. Поэтому отличить чугун от стали достаточно просто по свойствам, внешнему виду и характеристикам.
Высокое содержание углерода придает высокоуглеродистому железному сплаву темный, практически черный цвет. Визуально отличить чугун от стали можно по отсутствию блеска. Также на его поверхности образуется спель – крупные включения пластинчатого графита, которые на изломе видны невооруженным глазом. Появляются они в результате кристаллизации высокоуглеродистых сплавов.
Основные характеристики
Помимо углерода, в состав сплава добавляют марганец, серу, фосфор, кремний, молибден и др. Углерод в нем находится в виде графита или цементита (карбида железа), а их количество определяет разновидность металла. Для всех видов сплава характерна высокая плотность – около 7200 кг/куб. м.
Отличить чугун от другого металла можно по плохой свариваемости. В процессе нагрева происходит окисление кремния в составе железного сплава.
Из-за более высокой температуры плавления оксид кремния затрудняет процесс сварки, поэтому неразъемные соединения образуются с трудом.
При этом у чугунных сплавов относительно низкая температура плавления (от 1150 до 1200 °C, что ниже по сравнению со сталью и чистым железом).
Виды сплавов
- белый – металл с изломом светло-серого оттенка, который плохо поддается обработке, но обладает высокой твердостью;
- серый – материал с высоким содержанием углерода в виде графита, который обладает хорошими литейными свойствами, легко обрабатываем и подходит для производства элементов станков, станин, крышек, шкивов и прессов;
- ковкий – металла, полученный в результате термической обработки белого сплава с образованием хлопьевидного гранита (востребован в автомобильном производстве, при изготовлении сельскохозяйственной техники и запчастей для нее);
- половинчатый – материал для производства износостойких фрикционных деталей;
- высокопрочный – сплав с шаровидным графитом в составе для производства труб и элементов машин.
Чтобы понять, как отличить чугун, важно изучить характерные особенности и сферы применения его разновидностей.
Металлы, которые часто путают
Высокоуглеродистый сплав железа часто путают с другими металлами, используемыми для производства сантехники, фитингов, запорной арматуры, запчастей станков, радиаторов.
Над тем, как определить чугун, задумываются при попытке сдать металлолом в пункт приема.
Лом этого металла – один из самых дешевых, поскольку он плохо поддается переработке, хрупок, из него с трудом удаляются вредные примеси (фосфор и сера).
Поэтому перед поездкой в пункт приема важно определить, чугун или сталь перед вами. Также нередко путают его с чистым железом, алюминием и силумином – сплавом алюминия и кремния, применяемым для производства сковород, кастрюль, смесителей, кранов и др. Отличить чугун от железа и других металлов можно в домашних условиях: по цвету, магнитным свойствам, прочности и даже звуку!
Отличия от железа
Чистое железо – материал, который можно увидеть только в лаборатории. В природе оно практически не встречается, а также не применимо для серийного производства запчастей, сантехнических изделий и предметов быта. Определить, чугун или железо перед вами, можно по внешнему виду: железо имеет светло-серебристый цвет, очень мягко и пластично, а также сильно подвержено коррозии.
При этом важно не путать железо и его производную – сталь. Эти понятия не взаимозаменяемы. Сталь – сплав железа, незначительного количества углерода, марганца, кремния, серы и фосфора.
Этот железоуглеродистый сплав является эластичным, деформируемым, ковким. Отличить сталь от чугуна на глаз также бывает непросто: похожий состав придает им схожие оттенки, но совершенно разные свойства и характеристики.
Сталь проще в обработке, прочнее, не боится ударов и механических воздействий.
Как отличить чугун от стали?
Сталь – высокопрочный материал с температурой плавления примерно 1300–1500 °C. Из нее производят:
- слесарные инструменты (молотки, зубила, отвертки, косы, пилы, ножницы и т.д.);
- детали машин (толкатели, зубчатые колеса);
- пружины и рессоры;
- кузнечные инструменты;
- изделия для обработки камня и древесины;
- трубы и радиаторы;
- хирургическое оборудование;
- стройматериалы;
- посуду, столовые приборы и предметы быта.
Распространено мнение, что отличить чугун от стали можно магнитом. Утверждение верно отчасти, поскольку магнитные свойства металла зависят от состава. Не магнитят аусетнитные и аустенитно-ферритные сплавы с высоким содержанием хрома (до 20 %) и никеля (до 15 %). Включение в состав титана, молибдена, ниобия также снижает магнитные свойства металла.
Отличия стали и чугуна
Высокоуглеродистый сплав магнитится всегда, а сталь – в зависимости от состава. Также чугун определяют по цвету и состоянию поверхности: изделия из него имеют темный, почти черный матовый цвет, а на изломе металл – темно-серый. Также чугунные предметы более массивны и больше весят по сравнению со стальными аналогами, хотя плотность стали значительно выше – до 7900 кг/куб. м.
Сплавы и их магнитные свойства
Медь не магнитится. Если все-таки встречается монета, которая похожа на медь, но магнитными свойствами обладает, то скорее всего, это сплав. В таком сплаве меди будет не более 50%. Это может быть сделано специально, но бывали случаи, когда магнитные свойства проявляла медь, которая не была очищена от примесей в процессе изготовления монеты.
Любому человеку необходимы хотя бы минимальные знания о магнитных свойствах металлов. В большинстве случаев для определения меди этого достаточно — медное изделие к магниту не прилипнет.
Нержавеющие стали с хорошими магнитными свойствами
Хорошими магнитными свойствами отличается нержавейка, в которой преобладают следующие фазовые составляющие:
- Мартенсит – является ферромагнетиком в чистом виде.
- Феррит – данная фазовая составляющая внутренней структуры нержавейки в зависимости от температуры нагрева может принимать две формы. Ферромагнетиком такая структурная форма становится в том случае, если сталь нагревают до температуры, находящейся ниже точки Кюри. Если же температура нагрева нержавейки находится выше этой точки, то в сплаве начинает преобладать высокотемпературный дельта-феррит, который является выраженным парамагнетиком.
Из всего вышесказанного можно сделать вывод о том, что магнитится та нержавейка, во внутренней структуре которой преобладает мартенсит. Как и обычные углеродистые стали, такие сплавы реагируют на магнит. По данному признаку их и можно отличить от немагнитных.

Способность нержавейки магнитится не влияет на её коррозионную стойкость
Нержавеющие стали, в которых преобладает феррит или его смесь с мартенситом, чаще всего также относятся к ферромагнетикам, но их свойства могут различаться в зависимости от соотношения фазовых составляющих их внутренней структуры.
Нержавейка, магнитные свойства которой могут изменяться, – это преимущественно хромистые и хромоникелевые сплавы, которые могут относиться к одной из нижеприведенных групп.
Стали с мартенситной внутренней структурой, которые, как и обычные углеродистые, могут упрочняться при помощи закалки и отпуска. Такая нержавейка, кроме предприятий общего машиностроения, активно используются в быту (в частности, именно из нее производят столовые приборы и режущие инструменты). К наиболее распространенным маркам таких магнитных сталей, изделия из которых производятся с термообработкой и могут подвергаться финишной шлифовке и полировке, относятся 20Х13, 30Х13, 40Х13.

Сталь марки 30Х13 менее пластична, чем сплав 20Х13, несмотря на сходный состав (нажмите для увеличения)
В данную категорию также входит сплав марки 20Х17Н2, который отличается повышенным содержанием хрома в своем химическом составе, что значительно усиливает его коррозионную устойчивость. Почему такая нержавейка популярна? Дело в том, что, кроме высокой устойчивости к коррозии, она характеризуется отличной обрабатываемостью при помощи холодной и горячей штамповки, методов резания. Кроме того, изделия из такого материала хорошо свариваются.
Распространенной магнитной сталью ферритного типа, которая из-за невысокого содержания углерода в своем химическом составе отличается более высокой мягкостью, чем мартенситные сплавы, является 08Х13, активно используемая в пищевом производстве. Из такой нержавейки изготавливают изделия и оборудование, предназначенные для мойки, сортировки, измельчения, сортировки, а также транспортировки пищевого сырья.

Механические свойства стали 08Х13
Популярной маркой магнитной нержавейки, внутренняя структура которой состоит из мартенсита и свободного феррита, является 12Х13.
Магнит и магнитное поле: почему притягивается только металл? .
В справочных таблицах дана удельная магнитная восприимчивостьχ некоторых пара- и диамагнитных тел, которая для изотропных тел определяется выражением:
χ = Y / H
где Y обозначает намагниченность 1г тела, а Н — напряженность внешнего намагничивающего поля.
Таблица магнитная восприимчивость χ для элементов
Твердые тела предполагаются в изотропном состоянии. Температуры (t °С) отвечают стоградусной шкале.
| Элементы | t (°С) | χ-10β |
| Азот | 18 | -0,34 |
| Алюминий | 18 | +0,65 |
| Аргон | 18 | -0,48 |
| Барий | 20 | +0,91 |
| Висмут | 18 | -1,38 |
| 260 | -1,02 | |
| Водород | 18 | -1,98 |
| Вольфрам | 16 | +0,28 |
| Гелий | 18 | -0,47 |
| Золото | 18 | -0,15 |
| -256,6 | -0,13 | |
| Иридий | 25 | +0,14 |
| 200 | +0,17 | |
| 450 | -0,20 | |
| 850 | -0,26 | |
| 1150 | +0,31 | |
| Кадмий | 18 | -0,18 |
| Калий | 20 | +0,52 |
| Кальций | 20 | +1.10 |
| Кислород | 20 | +106,2 |
| Кислород жидкий | -195 | +259,6 |
| Кислород твердый | -240 | +60 |
| Кремний | 20 | -0,13 |
| Литий | 16 | +0,50 |
| Магний | 18 | +0,55 |
| Магний жидкий | 700 | +0,55 |
| Марганец | 22 | +9,9 |
| Медь | 18 | -0,085 |
| Молибден | 18 | +0,04 |
| Натрий | 18 | +0,51 |
| Неон | 18 | -0,33 |
| Олово | 18 | +0,025 |
| Олово серое | 18 | -0,35 |
| Олово жидкое | 400 | -0,036 |
| Палладий | 18 | +5,4 |
| 200 | +4,6 | |
| 750 | +2,6 | |
| 1230 | +1,7 | |
| Платина | 18 | -1,10 |
| 250 | -0,66 | |
| 700 | -0,45 | |
| 1220 | +0,30 | |
| Ртуть | 18 | -0,19 |
| Ртуть твердая | —80 | -0,15 |
| Свинец | 16 | -0,11 |
| Свинец жидкий | 330 | -0,08 |
| Сера ромб | 18 | -0,49 |
| Сера жидкая | 113 | -0,49 |
| 220 | -0,49 | |
| Серебро | 16 | -0,20 |
| Сурьма | 16 | -0,87 |
| Сурьма жидкая | 800 | -0,49 |
| Тантал | 18 | +0,87 |
| 820 | +0,77 | |
| Углерод алмаз | 18 | -0,49 |
| 400 | -0,51 | |
| 1200 | -0,56 | |
| Углерод графит | 20 | -3,5 |
| -170 | -6,0 | |
| 600 | -2,0 | |
| 1000 | -1,3 | |
| Фосфор белый | 20 | -0,90 |
| Хлор жидкий | -60 | -0,57 |
| Хром | 18 | +3,6 |
| 1100 | +4,2 | |
| Цинк | 18 | -0,157 |
| Цинк жидкий | 450 | -0,09 |
| Эрбий | 18 | +22 |
Таблица магнитная восприимчивость χ для некоторых соединений, органических и неорганических
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, — М.: 1960.
НЕМАГНИ́ТНЫЕ МАТЕРИА́ЛЫ
НЕМАГНИ́ТНЫЕ МАТЕРИА́ЛЫ, материалы с низкой магнитной проницаемостью ($μ⩽1,5$). Различают диа- и парамагнитные, слабоферромагнитные и антиферромагнитные материалы.
Строго говоря, абсолютно не обладающих магнитными свойствами материалов не существует, т. к.
диамагнетизм – свойство, присущее всем веществам, которое в большей или меньшей степени может перекрываться электронным или ядерным парамагнетизмом, ферромагнетизмом или антиферромагнетизмом.
К Н. м. относится большинство металлов и сплавов (в т. ч. аустенитные стали и чугуны), а также большинство полимеров и композитов на их основе, дерево, стекло и многие др. материалы. Как конструкционные материалы наибольшее распространение, благодаря высоким механич.
свойствам, износостойкости и долговечности, получили металлич. Н. м., гл. обр. немагнитные стали и чугуны, а также сплавы меди, алюминия, титана (напр., никелид титана) и др.
Немагнитность сталей и чугунов обеспечивается созданием в них структуры аустенита, что достигается соответствующим легированием. Немагнитные сталь и чугун характеризуются высоким удельным электрическим сопротивлением. Лучшими технологич.
свойствами обладают хромоникелевые немагнитные стали, выпускаемые в виде листов, проволоки и лент. Типичный состав немагнитной стали: до 0,12% (по массе) $ce$, до 0,8% $ce$, 1–2% $ce$, 17–19% $ce$, 11–13% $ce$, остальное – $ce;; μ$= 1,05–1,2.
Для деталей сложной конфигурации, от которых не требуется высокой прочности, применяют более дешёвые немагнитные чугуны, удельное электрич. сопротивление которых (1,4–2,0 мкОм·м), как правило, больше, чем у немагнитных сталей (ок.
1 мкОм·м), что обеспечивает малые потери энергии на вихревые токи в деталях, работающих на переменном токе. Наиболее распространены никель-марганцевые чугуны, содержащие (помимо $ce$) 2,6–3,2% $ce$, 5–7,5% $ce$, 9–12% $ce$, 2,5–3,5% $ce$ и до 1,1% $ce;; μ$=1,03–1,06. Н. м.
на основе цветных металлов имеют обычно более низкую магнитную проницаемость, чем немагнитные стали и чугуны, хорошо обрабатываются резанием и давлением, однако их механич. свойства не всегда удовлетворительны, а электрич. сопротивление мало.
Н. м. применяют для изготовления деталей, которые не должны оказывать магнитного влияния на рабочую систему измерит. установок, приборов, машин и аппаратов. Из Н. м.
готовят коробки компасов, детали электроизмерит.
приборов и часов, немагнитные пружины, втулки и фланцы (сквозь которые проходят кабели переменного тока), стягивающие болты и кожухи трансформаторов и электромашин, спец. (немагнитное) мед. оборудование и др.
Естественнонаучные исследования
Эрстед, проводя эксперименты с магнитной стрелкой и проводником, приметил следующую особенность: разряд энергии, направленный в сторону к стрелке, мгновенно на нее действовал, и она начинала отклоняться.
Стрелка всегда отклонялась, с какой бы стороны он не подошел.
Продолжать многократные эксперименты с магнитом стал физик из Франции Доминик Франсуа Араго, взяв за основу трубку из стекла, перемотанную металлической нитью, посередине этого предмета он установил железный стержень. С помощью электричества, находившееся внутри железо начинало резко намагничиваться, из-за этого стали прилипать различные ключи, но стоило отключить разряд, и ключи сразу падали на пол. Исходя из происходящего физик из Франции Андре Ампер, разработал точное описание всего происходящего в этом эксперименте.
Когда магнит притягивает к себе металлические предметы, это кажется волшебством, но в действительности «волшебные» свойства магнитов связаны всего лишь с особой организацией их электронной структуры. Поскольку электрон, вращающийся вокруг атома, создает магнитное поле, все атомы являются маленькими магнитами; однако в большинстве веществ неупорядоченные магнитные эффекты атомов уравновешивают друг друга.

Магнитная цепочка
Касание конца магнита к металлическим скрепкам приводит к возникновению у каждой скрепки северного и южного полюса. Эти полюса ориентируются в том же направлении, что и у магнита. Каждая скрепка стала магнитом.
Бесчисленные маленькие магнитики
Некоторые металлы имеют кристаллическую структуру, образованную атомами, сгруппированными в магнитные домены. Магнитные полюса доменов обычно имеют различное направление (красные стрелки) и не оказывают суммарного магнитного воздействия.
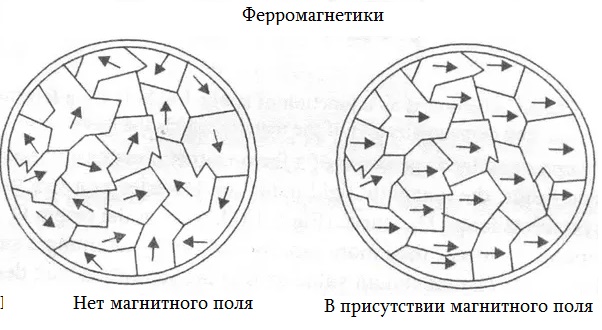
Образование постоянного магнита

Обычно магнитные домены железа ориентированы бессистемно (розовые стрелки), и естественный магнетизм металла не проявляется. Если к железу приблизить магнит (розовый брусок), магнитные домены железа начинают выстраиваться вдоль магнитного поля (зеленые линии). Большинство магнитных доменов железа быстро выстраивается вдоль силовых линий магнитного поля. В результате железо само становится постоянным магнитом.
Магнитно-твердые материалы
Магнитно-твердые материалы применяются для изготовления постоянных магнитов. Эти материалы должны отвечать следующим требованиям:
- обладать большой остаточной индукцией;
- иметь большую максимальную магнитную энергию;
- обладать стабильностью магнитных свойств.
Самым дешевым материалом для постоянных магнитов является углеродистая сталь (0,4 – 1,7 % углерода, остальное – железо). Магниты, изготовленные из углеродистой стали, обладают невысокими магнитными свойствами и быстро теряют их под влиянием нагрева, ударов и сотрясений.
Легированные стали обладают лучшими магнитными свойствами и применяются для изготовления постоянных магнитов чаще, чем углеродистая сталь. К таким сталям относятся хромистая, вольфрамовая, кобальтовая и кобальто-молибденовая.
Для изготовления постоянных магнитов в технике разработаны сплавы на основе железа – никеля – алюминия. Эти сплавы отличаются высокой твердостью и хрупкостью, поэтому они могут обрабатываться только шлифованием. Сплавы обладают исключительно высокими магнитными свойствами и большой магнитной энергией в единице объема.
В таблице 1 приведены данные о составе некоторых магнитно-твердых материалов для изготовления постоянных магнитов.
Химический состав магнитно-твердых материалов
| Наименование материала | Химический состав в весовых процентах | Относительный вес на единицу магнитной энергии |
| Углеродистая сталь Хромистая сталь Вольфрамовая сталь Кобальтовая сталь Кобальто-молибденовая сталь Альни Альниси Альнико Магнико | 0,45 C остальное Fe 2 – 3 Cr; 1 C 5 W; 1 C 5 – 30 Co; 5 – 8 Cr; 1,5 – 5 W 13 – 17 Mo; 10 – 12 Co 12,5 Al; 25 Ni; 5 Cн 14 Al; 34 Ni; 1 Si 10 Al; 17 Ni; 12 Co; 6 Cн 24 Co; 13 Si; 8 Al; 3 Cн | 26,7 17,2 15,8 5,1 – 12,6 3,8 3,6 3,4 3,1 1 |

Читайте также:
