Серое вещество с металлическим блеском
Обновлено: 05.10.2024
Блестящий тёмно-серый неметалл. В газовом состоянии — фиолетовый.
Ио́д / Iodum (I), 53
[Kr] 4d 10 5s 2 5p 5
2,66 (шкала Полинга)
15,52 (I—I) кДж/моль
41,95 (I—I) кДж/моль
Ио́д [3] (тривиальное (общеупотребительное) название — йод [4] ; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum ). Химически активный неметалл, относится к группе галогенов.
Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
Содержание
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης , ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент [5] .
Нахождение в природе


Иод — элемент редкий. Его кларк всего 400 мг/т. Но у иода есть одна особенность — крайняя рассеянность в природе. Будучи далеко не самым распространенным элементом, иод присутствует практически везде. Находится в виде иодидов в морской воде (20 — 30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (5 кг на тонну высушенной морской капусты (ламинарии)). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья [6] .
Физические свойства
Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Изотопы
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только период полураспада остальных изотопов иода составляет от 103 мкс до 1,57·10 7 лет [7] ; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ [8] .
| Массовое число | Содержание в природной смеси, % | Характер излучения | Период полураспада |
|---|---|---|---|
| 118 | — | ~10 мин | |
| 119 | — | β + | 18 мин |
| 120 | — | Э.з. | 1,1 час |
| 121 | — | β + ; γ | 1,5 час |
| 122 | — | β + | 3,5 мин |
| 123 | — | Э.з.; γ | 13 час |
| 124 | — | Э.з.; β + ; γ | 4,5 дня |
| 125 | — | Э.з.; γ | 60 дней |
| 126 | — | Э.з.; β + ; β - ; γ | 13 дней |
| 127 | 100 | ||
| 128 | — | Э.з.; β - ; γ | 25 мин |
| 129 | — | β - ; γ | 1,72·10 7 лет |
| 130 | — | β - ; γ | 12,5 час |
| 131 | — | β - ; γ | 8,05 дня |
| 132 | — | β - ; γ | 2,26 час |
| 133 | — | β - ; γ | 20,8 час |
| 134 | — | β - ; γ | 53 мин |
| 135 | — | β - ; γ | 6,7 час |
| 136 | — | β - ; γ | 1,5 мин |
| 137 | — | β - ; n | 19,3 сек |
| 138 | — | β - | 5,9 сек |
| 139 | — | β - | 2,7 сек |
Применение
В медицине

5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором иода используется Зелёнка, Фукорцин, Пиоктанин, растворы перекиси водорода и др.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
В технике
Источники света
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1 % иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Иод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг. [10]
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Токсичность
Иод очень ядовит. Смертельная доза 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход [11] .
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
См. также
Примечания
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Иод" в других словарях:
ИОД — ИОД, Jodum (от греческого ioeides имеющий фиалковый цвет), твердый галоген с химическим обозначением J; атомный вес иода 126,932; иод занимает в периодической системе элементов по порядку 53 место, в 7 ряду VII группы. Кристаллизуется в виде… … Большая медицинская энциклопедия
ИОД — (греч. iodes фиолетовый). Простое тело, в виде сероватых блестящих пластинок, добывается из золы морских водорослей. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ИОД простое (неразлагающееся химически на части)… … Словарь иностранных слов русского языка
ИОД — (Iodum), I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045; относится к галогенам; фиолетовые кристаллы, легко летуч, tпл 113,5шC. Используют для получения иодсодержащих соединений, как катализатор,… … Современная энциклопедия
ИОД — (йод) (лат. Iodum) I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045, относится к галогенам. Черно серые кристаллы с металлическим блеском; плотность 4,94 г/см³, tпл 113,5 .С, tкип 184,35 .С. Уже … Большой Энциклопедический словарь
ИОД — [ёд], иода, муж. (от греч. ioeides фиолетовый). Химический элемент из группы металлоидов, вещество, имеющее кристалы темносерого цвета с металлическим блеском и добываемое из золы некоторых морских водорослей (хим.). При соединении с крахмалом… … Толковый словарь Ушакова
иод — йод Словарь русских синонимов. иод сущ., кол во синонимов: 4 • галоген (7) • йод (2) … Словарь синонимов
Иод — (Iodum), I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045; относится к галогенам; фиолетовые кристаллы, легко летуч, tпл 113,5°C. Используют для получения иодсодержащих соединений, как катализатор,… … Иллюстрированный энциклопедический словарь
Иод — I (от греч. iodes фиолетовый, по цвету паров * a. iodine; н. Jod; ф. iode; и. yodo), хим. элемент VII группы периодич. системы элементов Менделеева, относится к галогенам, ат. н. 53, ат. м. 126,904. В природе известен один стабильный… … Геологическая энциклопедия
ИОД — (Iodum; ФХ, список Б), химический элемент VII группы периодической системы Д. И. Менделеева, атомная масса 126, 9044, серовато чёрные с металлическим блеском пластинки или сростки кристаллов с характерным запахом. Очень мало растворим в воде,… … Ветеринарный энциклопедический словарь
иод — см. Йод. * * * иод йод (лат. Iodum), химический элемент VII группы периодической системы, относится к галогенам. Чёрно серые кристаллы с металлическим блеском; плотность 4,94 г/см3, tпл 113,5ºC, tкип 184,35ºC. Уже при обычной температуре… … Энциклопедический словарь
Химия углерода

В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
· Обновлено 12 июля 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s 2 2s 2 2р 2 .
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s 2 2s 1 2p 3 .
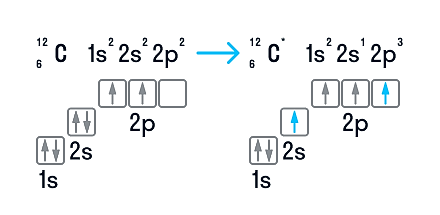
Возможные валентности: II, IV.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
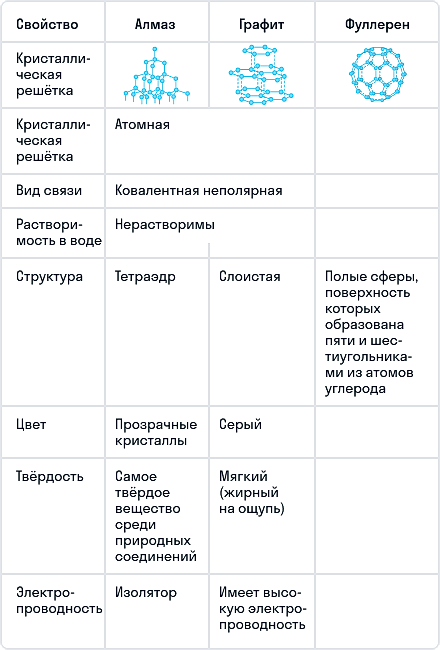
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
· Обновлено 8 июня 2022
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Серое вещество

На микрофотографии: серое вещество с клеточными телами нейронов — справа, тёмно-розовые структуры, и белое вещество — слева, сетчатые структуры светло-розового цвета
(окраска гематоксилин-флоксин-шафраном, большое увеличение)
Серое вещество (лат. substantia grisea ) — главный компонент центральной нервной системы позвоночных животных [1] и человека, включающий клеточные тела нейронов, нейропиль (частично: дендриты, безмиелиновые аксоны, отростки глиальных клеток [2] ), глиальные клетки (астроциты и олигодендроциты), а также капилляры. Противопоставляется белому веществу мозга, не содержащему тел нейронов и состоящему главным образом из пучков миелиновых волокон [3] . Цветовая дифференциация белого и серого вещества нервной ткани обусловлена белым цветом миелина. Серое вещество живых тканей имеет серо-коричневую окраску, которую придают кровеносные капилляры и клеточные тела нейронов [4] .
Расположение
Серое вещество сосредоточено в коре больших полушарий, коре мозжечка, а также в глубинных структурах головного мозга: таламусе (лат. thalamus ), гипоталамусе (лат. hypothalamus ), субталамусе (ядро Люиса, лат. nucleus subthalamicus Luisi ), базальных ганглиях (скорлупа [en] (лат. putamen ), бледный шар (лат. globus pallidus ), прилежащее ядро (лат. nucleus accumbens septi ); ядро перегородки (лат. nucleus septi pellucidi )), ядрах мозжечка (зубчатое [en] (лат. nucleus dentatus ), шаровидное [en] (лат. nucleus globosus cerebelli ), пробковидное [en] (лат. nucleus emboliformes ), ядро шатра [en] ) (лат. nucleus fastigii cerebelli ), ствола мозга (чёрная субстанция [en] (лат. substantia nigra ), красное ядро [en] (лат. nucleus ruber ), ядра оливы [en] (лат. oliva ) и черепных нервов [en] (лат. nucleus nervi cranialis )), — и в серых столбах спинного мозга (в сечении — передние (лат. cornu anterius medullae spinalis ), боковые (лат. cornu laterale medullae spinalis ) и задние рога (лат. cornu posterius medullae spinalis )) [5] .
Функции
Серое вещество, состоящее из тел нейронов, их безмиелиновых отростков и глиальных клеток [2] , представлено в областях мозга, контролирующих мышечную активность, отвечающих за сенсорное восприятие (например, зрение, слух), память, эмоции и речь.
Исследования
Существенная положительная корреляция была обнаружена между объёмом серого вещества у пожилых людей и показателями семантической и кратковременной памяти. В то же время эти показатели не зависели от объёма белого вещества. Очевидно, индивидуальные различия познавательных функций, которые относительно хорошо сохраняются с возрастом, обусловлены различиями объёма серого вещества у здоровых пожилых людей [6] .
Некоторые особенности распределения серого вещества могут быть связаны с нарушениями психики. Не обнаруживается различий в общем объёме серого вещества у пациентов, страдающих биполярным расстройством I типа [en] , и здоровых людей. Но у таких больных меньше объём серого вещества в левой нижней теменной дольке, верхней височной и средней лобной извилинах правого полушария, а также в левом хвостатом ядре. Объём серого вещества средней лобной извилины правого полушария коррелировал с продолжительностью заболевания и числом эпизодов у пациентов [7] .
Курение и серое вещество
Потеря серого вещества и познавательных функций у заядлых курильщиков происходит быстрее, чем у некурящих. Хронические курильщики, не курившие во время исследования, потеряли меньше клеток мозга и сохранили лучше мыслительные функции, нежели те, кто продолжал курить [8] .
Жестокое обращение с детьми и объём серого вещества
По-видимому, у подростков, которые подвергались жестокому обращению и были лишены родительской заботы, понижено содержание серого вещества в префронтальной коре головного мозга [9] .
1. Углерод. Аллотропия углерода
Углерод — химический элемент № \(6\). Он расположен в IVА группе втором периоде Периодической системы.
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления \(–4\), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: \( +2\) или \(+4\).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ . В земной коре распространены карбонаты (например, Ca CO 3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений , главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Существует несколько аллотропных видоизменений, образованных атомами углерода. Наиболее распространены алмаз и графит .
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.

Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.

Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (\(3700\) °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа , древесный уголь и кокс . Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией .

Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные , и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
Читайте также:
