Сероводород металл или неметалл
Обновлено: 04.10.2024
СЕРА
S (sulfur),
неметаллический химический элемент, член семейства халькогенов (O, S, Se, Te и Po) - IVA подгруппы периодической системы элементов. Cера, как и многие ее применения, известны с далекой древности. А.Лавуазье утверждал, что сера - это элемент. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Применение. Около половины ежегодного потребления серы идет на производство таких промышленных химических продуктов, как серная кислота, диоксид серы и дисульфид углерода (сероуглерод). Кроме того, сера широко используется в производстве инсектицидов, спичек, удобрений, взрывчатых веществ, бумаги, полимеров, красок и красителей, при вулканизации каучука. Ведущее место в добыче серы занимают США, страны СНГ и Канада.
Распространенность в природе. Сера встречается в свободном состоянии (самородная сера). Кроме того, имеются огромные запасы серы в виде сульфидных руд, прежде всего руд свинца (свинцовый блеск), цинка (цинковая обманка), меди (медный блеск) и железа (пирит). При извлечении металлов из этих руд освобождаются от серы обычно обжигом в присутствии кислорода, при этом образуется диоксид серы(IV), который часто выбрасывается в атмосферу без использования. Кроме сульфидных руд достаточно много серы встречается в виде сульфатов, например, сульфата кальция (гипс), сульфата бария (барит). В морской воде и многих минеральных водах присутствуют растворимые в воде сульфаты магния и натрия. В некоторых минеральных водах встречается сульфид водорода (сероводород). В промышленности серу можно получать как побочный продукт процессов в плавильных, коксовых печах, при нефтепереработке, из топочных или природных газов. Из природных подземных отложений серу добывают, расплавляя ее перегретой водой и доставляя на поверхность сжатым воздухом и насосами. Во фраш-процессе извлечения серы из сероносных отложений на установке в виде концентрических труб, запатентованной Г.Фрашем в 1891, сера получается чистотой до 99,5%.

ФРАШ-ПРОЦЕСС для извлечения природной серы из подземных месторождений.
Свойства. Сера имеет вид желтого порошка или хрупкой кристаллической массы без запаха и вкуса и нерастворима в воде. Для серы характерны несколько аллотропных модификаций. Наиболее известны следующие: кристаллическая сера - ромбическая (самородная сера, a-S) и моноклинная (призматическая сера, b-S); аморфная - коллоидная (серное молоко) и пластическая; промежуточная аморфно-кристаллическая - сублимированная (серный цвет). СВОЙСТВА СЕРЫ
Атомный номер 16 Атомная масса 32,066 Изотопы
Температура плавления, ° С 112,8 (a , ромбич.), 119,0 (b , моноклин.) Температура кипения, ° С 444,6 Плотность, г/см3 2,06 (ромбич.), 1,957 (моноклин.) Твердость (по Моосу) 1,5-2,5 Содержание в земной коре, % (масс.) 0,052 Степени окисления -2, +2, +4, +6 (реже -1, 0, +1, +3, +5 )
Кристаллическая сера. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично "срезаны" углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
Некристаллическая сера. Твердая сера существует также в двух некристаллических, аморфных, формах. Коллоидная сера получается при осаждении серы из раствора (например, при кипячении серы с известью) и фильтровании с последующим добавлением хлороводородной кислоты к прозрачному фильтрату. Осадок представляет собой мелкодисперсную белую и хорошо растворимую в CS2 серу. Коллоидную серу используют в медицине как антисептик, слабительное и противопаразитическое средство в виде порошков и мазей. Другая некристаллическая форма - пластическая сера - образуется при резком охлаждении расплава, например, холодной водой. Пластическая сера бывает темнокрасного или коричневого цвета, она каучукоподобна (плотность 2,046 г/см3) и не растворяется в CS2; при хранении становится хрупкой, желтеет и по мере превращения в ромбическую все лучше растворяется в CS2. В дополнение к этим кристаллическим и аморфным формам существует промежуточная форма, известная как серный цвет или сублимированная сера, которая получается конденсацией паров серы, минуя жидкую фазу. Она состоит из мельчайших зерен, имеющих центр кристаллизации и аморфную поверхность. Эта форма медленно и не полностью растворяется в CS2. После обработки аммиаком для очистки от таких примесей, как мышьяк, получается продукт, известный в медицине как промытая сера, которая используется аналогично коллоидной сере.
Жидкое состояние. Молекулы серы состоят из замкнутой цепочки восьми атомов (S8). Жидкая сера обладает необычным свойством: с повышением температуры ее вязкость увеличивается. Ниже 160° С сера - типичная жидкость желтоватого цвета, ее состав соответствует формуле S8 и обозначается l-S. С повышением температуры кольцевые молекулы S8 начинают разрываться и соединяться друг с другом, образуя длинные цепи (m-S), цвет жидкой серы становится темнокрасным, вязкость возрастает, достигая максимума при 200-250° С. При дальнейшем повышении температуры жидкая сера светлеет, длинные цепи рвутся, образуя короткие, с меньшей способностью к переплетению, что приводит к меньшей вязкости.
Газ. Сера кипит при 444,6° C, образуя оранжево-желтые пары, состоящие преимущественно из молекул S8. С повышением температуры окраска паров переходит в темнокрасную, затем в палевую, а при 650° C в соломенно-желтую. При дальнейшем нагревании молекулы S8 диссоциируют, образуя равновесные формы S6, S4 и S2 при разных температурах. И, наконец, при >1000° С пары состоят практически из молекул S2, а при 2000° С - из одноатомных молекул.
Химические свойства. Сера - типичный неметалл. На внешней электронной оболочке у нее шесть электронов, и она легче присоединяет электроны других элементов, чем отдает свои. Со многими металлами реагирует с выделением тепла (например, при соединении с медью, железом, цинком). Она соединяется и почти со всеми неметаллами, хотя не так энергично.
Соединения. Диоксид серы образуется при сжигании серы на воздухе, в частности, при обжиге сульфидных руд металлов. Диоксид серы - бесцветный газ с удушающим запахом. Это ангидрид сернистой кислоты, он легко растворяется в воде с образованием сернистой кислоты. Диоксид легко сжижается (т. кип. -10° C) и его хранят в стальных цилиндрах. Диоксид используют в производстве серной кислоты, в холодильных установках, для отбеливания текстиля, древесной массы, соломы, свекловичного сахара, для консервации фруктов и овощей, для дезинфекции, в пивоваренных и пищевых производствах. Сернистая кислота H2SO3 существует только в разбавленных растворах (менее 6%). Это слабая кислота, образующая средние и кислые соли (сульфиты и гидросульфиты). Сернистая кислота - хороший восстановитель, реагируя с кислородом образует серную кислоту. Сернистая кислота находит несколько областей применения, среди которых - обесцвечивание шелка, шерсти, бумаги, древесной массы и аналогичных веществ. Она используется как антисептик и консервант, особенно для предотвращения брожения вина в бочках, для предотвращения ферментации зерна при извлечении крахмала. Кислоту используют и для сохранения продуктов. Наибольшее значение из ее солей имеет гидросульфит кальция Ca(HSO3)2, используемый при переработке древесной щепы в целлюлозу. Триоксид серы SO3 (серный ангидрид), образующий с водой серную кислоту, представляет собой либо бесцветную жидкость, либо белое кристаллическое вещество (кристаллизуется при 16,8° С; т. кип. 44,7° С). Он образуется при окислении диоксида серы кислородом в присутствии соответствующего катализатора (платина, пентаоксид ванадия). Триоксид серы сильно дымит во влажном воздухе и растворяется в воде, образуя серную кислоту и выделяя много тепла. Его используют в производстве серной кислоты и получении синтетических органических веществ.
Серная кислота H2SO4. Безводная H2SO4 - бесцветная маслянистая жидкость, растворяет SO3, образуя олеум. Смешивается с водой в любых отношениях. При растворении в воде образуются гидраты с выделением очень большого количества теплоты; поэтому во избежание разбрызгивания кислоты обычно при растворении осторожно, постепенно добавляют кислоту в воду, а не наоборот. Концентрированная кислота хорошо поглощает пары воды и поэтому применяется для осушения газов. По этой же причине она приводит к обугливанию органических веществ, особенно углеводов (крахмала, сахара и т.п.). При попадании на кожу вызывает сильные ожоги, пары разъедают слизистую дыхательных путей и глаз. Серная кислота - сильный окислитель. Конц. H2SO4 окисляет HI, HBr до I2 и Br2 соответственно, уголь - до CO2, серу - до SO2, металлы - до сульфатов. Разбавленная кислота тоже окисляет металлы, стоящие в ряду напряжений до водорода. H2SO4 - сильная двухосновная кислота, образующая средние и кислые соли - сульфаты и гидросульфаты; большинство ее солей растворимы в воде, за исключением сульфатов бария, стронция и свинца, малорастворим сульфат кальция. Серная кислота - один из важнейших продуктов химической промышленности (производящей щелочи, кислоты, соли, минеральные удобрения, хлор). Ее получают главным образом контактным или башенным способом по принципиальной схеме:
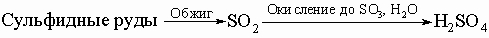
Большая часть получаемой кислоты идет на производство минеральных удобрений (суперфосфат, сульфат аммония). Серная кислота служит исходным сырьем для получения солей и других кислот, для синтеза органических веществ, искусственных волокон, для очистки керосина, нефтяных масел, бензола, толоуола, при изготовлении красок, травлении черных металлов, в гидрометаллургии урана и некоторых цветных металлов, для получения моющих и лекарственных средств, как электролит в свинцовых аккумуляторах и как осушитель. Тиосерная кислота H2S2O3 структурно аналогична серной кислоте за исключением замены одного кислорода на атом серы. Наиболее важным производным кислоты является тиосульфат натрия Na2S2O3 - бесцветные кристаллы, образующиеся при кипячении сульфита натрия Na2SO3 с серным цветом. Тиосульфат (или гипосульфит) натрия используется в фотографии как закрепитель (фиксаж). Сульфонал (CH3)2C(SO2C2H5)2 - белое кристаллическое вещество, без запаха, слабо растворимое в воде, является наркотиком и используется как седативное и снотворное средство. Сульфид водорода H2S (сероводород) - бесцветный газ с резким неприятным запахом тухлых яиц. Он несколько тяжелее воздуха (плотность 1,189 г/дм3), легко сжижается в бесцветную жидкость и хорошо растворим в воде. Раствор в воде является слабой кислотой с рН СЕРА 4. Жидкий сероводород используют как растворитель. Раствор и газ широко применяют в качественном анализе для отделения и определения многих металлов. Вдыхание незначительного количества сероводорода вызывает головную боль и тошноту, большие количества или непрерывное вдыхание сероводорода вызывают паралич нервной системы, сердца и легких. Паралич наступает неожиданно, в результате нарушения жизненных функций организма. Монохлорид серы S2Cl2 - дымящая масляная жидкость янтарного цвета с едким запахом, слезоточивая и затрудняющая дыхание. Она дымит во влажном воздухе и разлагается водой, но растворима в сероуглероде. Монохлорид серы - хороший растворитель для серы, иода, галогенидов металлов и органических соединений. Монохлорид используется для вулканизации каучука, в производстве типографской краски и инсектицидов. При реакции с этиленом образуется летучая жидкость, известная как горчичный газ (ClC2H4)2S - токсичное соединение, используемое как боевое химическое отравляющее вещество раздражающего действия. Дисульфид углерода CS2 (сероуглерод) - бледножелтая жидкость, ядовитая и легко воспламеняющаяся. CS2 получают синтезом из элементов в электрической печи. Вещество нерастворимо в воде, имеет высокий коэффициент светопреломления, высокое давление паров, низкую температуру кипения (46° C). Сероуглерод - эффективный растворитель жиров, масел, каучука и резин - широко используют для экстракции масел, в производстве искусственного шелка, лаков, резиновых клеев и спичек, уничтожения амбарных долгоносиков и одежной моли, для дезинфекции почв. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Справочник сернокислотчика. М., 1971 Бусев А.И., Симонова Л.Н. Аналитическая химия серы. М., 1975
Химия сероводорода

Чтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
· Обновлено 5 марта 2022
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
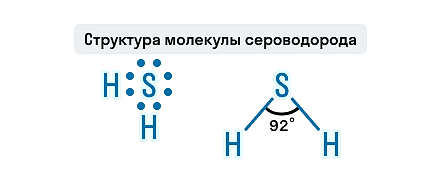
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Сероводород можно получить путем нагревания смеси парафина и серы:
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
Полное горение. Продукты реакции — диоксид серы и вода:
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
раствор сероводорода реагирует с основными оксидами:
взаимодействие со щелочами:
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
в реакции с бромной водой наблюдается обесцвечивание раствора:
окисление сероводорода подкисленным раствором перманганата калия:
сероводород в кислой среде реагирует с дихроматом калия:
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S −2 → S +4 соответствует уравнение:
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
Сероводород
Сероводоро́д (серни́стый водоро́д, сульфид водорода, дигидросульфид) — бесцветный газ с запахом протухших яиц и сладковатым вкусом. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы. Концентрационные пределы воспламенения с воздухом составляют 4,5 — 45 % сероводорода.
Содержание
Физические свойства
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10 −29 Кл·м). В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота.
Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
Ka = 6.9·10 −7 моль/л; pKa = 6.89.
(обычная соль, при избытке NaOH) (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO4 2− , например:
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов раствора сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для щелочных и щелочноземельных металлов известны также гидросульфиды M + HS и M 2+ (HS)². Гидросульфиды Са²+ и Sr 2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Получение
- Взаимодействие сульфида алюминия с водой(эта реакция отличается чистотой полученного сероводорода):
Соединения, генетически связанные с сероводородом
Является первым членом в ряде полисульфидов (сульфанов) — H2Sn (n=1±9).
Применение
Сероводород из-за своей токсичности находит ограниченное применение.
- В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
- В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
- Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
- Используют в органическом синтезе для получения тиофена и меркаптанов.
- В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Биологическая активность
Сероводород является газотрансмиттером, в микромолярных концентрациях имеет цитопротекторные свойства (антинекротические и антиапоптические). В малых концентрациях стимулирует продукцию cAMP, активирует антиоксидантные системы, имеет противовоспалительное действие. В миллимолярных концентрациях цитотоксичен. [2]
Токсикология
Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [3]
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
Примечания
- ↑Польза сероводородных ванн
- ↑ Szabó C. Hydrogen sulphide and its therapeutic potential. Nature Reviews 2007;6: 918—935
- ↑ Long-term effects on the olfactory system of exposure to hydrogen sulphide / AR Hirsch and G Zavala Smell and Taste Treatment and Research Foundation, Chicago, IL 60611, USA.
Литература
- , Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001
- Малин К. М. Справочник сернокислотчика. — М.: Химия, 1971
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
- Неорганические кислоты
- Соединения серы
- Соединения водорода
- Газы
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Сероводород" в других словарях:
сероводород — сероводород … Орфографический словарь-справочник
СЕРОВОДОРОД — (сернистый водород) H2S, бесцветный газ с запахом тухлых яиц; tпл ?85,54 .С, tкип ?60,35 .С; при 0 .С сжижается под давлением 1 МПа. Восстановитель. Побочный продукт при очистке нефтепродуктов, коксовании угля и др.; образуется при разложении… … Большой Энциклопедический словарь
СЕРОВОДОРОД — (H2S), бесцветный, ядовитый газ с запахом тухлых яиц. Образуется в процессах гниения, содержится в сырой нефти. Получают действием серной кислоты на сульфиды металлов. Используется в традиционном КАЧЕСТВЕННОМ АНАЛИЗЕ. Свойства: температура… … Научно-технический энциклопедический словарь
СЕРОВОДОРОД — СЕРОВОДОРОД, сероводорода, мн. нет, муж. (хим.). Газ, образующийся при гниении белковых веществ, издающий запах тухлых яиц. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
СЕРОВОДОРОД — СЕРОВОДОРОД, а, муж. Бесцветный газ с резким неприятным запахом, образующийся при разложении белковых веществ. | прил. сероводородный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
сероводород — сущ., кол во синонимов: 1 • газ (55) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
СЕРОВОДОРОД — бесцветный ядовитый газ H2S с неприятным специфическим запахом. Обладает слабокислотными свойствами. 1 л С. при t 0 °C и давлении 760 мм составляет 1,539 г. Встречается в нефтях, в природных водах, в газах биохимического происхождения, как… … Геологическая энциклопедия
СЕРОВОДОРОД — СЕРОВОДОРОД, H2S (молекулярный вес 34,07), бесцветный газ с характерным запахом тухлых яиц. Литр газа при нормальных условиях (0°, 760 мм) весит 1,5392 г. Темп, кипения 62°, плавления 83°; С. входит в состав газообразных выделений… … Большая медицинская энциклопедия
сероводород — СЕРОВОДОРОД, а, м Бесцветный газ с резким неприятным запахом, образующийся при разложении белковых веществ и представляющий собой соединение серы с водородом. Сероводород содержится в некоторых минеральных водах и лечебных грязях и используется… … Толковый словарь русских существительных
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .

Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения. Это метан, силан, аммиак, фосфин, арсин, сероводород, вода, галогеноводороды. Способы получения и химические свойства.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Читайте также:
